霍山石斛多糖的制备、功能和产品开发的研究进展
2019-03-28,,,
, ,,
(九仙尊霍山石斛股份有限公司,上海 201199)
霍山石斛(DendrobiumhuoshanenseCZ. Tang et S.J. Cheng)是兰科石斛属多年生草本植物,又称“米斛”,其茎入药,是我国传统医药中的一种名贵中药材,产于安徽大别山的霍山及临近地区[1]。药用石斛种类繁多,但功效差别很大,传统医学认为霍山石斛是最道地、最为珍贵的石斛品种[2-4]。清代赵学敏《本草纲目拾遗》中明确、详尽地阐释了霍山石斛:“……系出六安州及颖州府霍山县,名霍山石斛,最佳。形短只寸许,形如累米,嚼之微有浆、黏齿,有解暑醒脾,止渴利水,益人力气的功效……”。这充分揭示了六安石斛与霍山石斛一脉相承的密切关系[5-6]。现代研究亦表明,霍山石斛植株矮小,长3~9 cm,茎直立由下向上逐渐变细,呈圆锥状,形似米粒,花呈淡黄绿色,明显区别于铁皮石斛、细茎石斛及其它石斛,具有独特的地理分布、形态特征、遗传结构及药理活性[7-8]。
目前,香菇多糖、灰树花多糖、肝素、云芝糖肽及硫酸酯多糖等多糖药物和保健品,已成为当今生命科学研究和开发的热点,被广泛用于肿瘤、糖尿病、艾滋病、血栓等疾病的治疗和防治[9]。现代药理和化学成分分析表明,霍山石斛中主要的活性成分是多糖类化合物,具有提高免疫力、降血糖、抗肿瘤、抗氧化、保肝护胃及抗白内障等作用,其理化及结构特征与药用活性密切相关[10-11]。从上个世纪五十年代开始,研究者相继对霍山石斛多糖的提取纯化、结构解析及功能活性等方面做了大量研究,并取得了一定的成果[12]。本文在查阅收集大量文献基础上,系统整理与归纳霍山石斛多糖的研究现状,对多糖的分离纯化、结构特征、生物活性及消化吸收进行综述,并对相关专利及产品开发进行分析,为霍山石斛资源开发利用,保健食品、药品开发提供参考和理论依据。
1 霍山石斛多糖的提取、分离纯化
目前,霍山石斛的研究原料主要包括类原球茎、栽培茎和野生植株3类,在此基础上对不同原材料中霍山石斛多糖提取、分离纯化工艺及多糖含量变化规律进行系统研究。
1.1 霍山石斛原材料对多糖含量的影响
霍山石斛多糖含量与原材料、生长条件和提取方法等相关,不同器官组织、生长期、采收时期及不同种源植株中多糖含量差异显著[13-15]。在霍山石斛的道地产区,仿野生栽培的霍山石斛,已逐渐替代野生石斛成为药用霍山石斛的主要来源,实现了从试管苗或人工诱导种子萌发产生实生苗的大规模生产[16]。魏刚等[17]比较研究10批栽培的霍山石斛样品的HPLC指纹图谱,表明栽培的霍山石斛具有比较稳定的HPLC特征图谱,其质量稳定,研究还分析了1批野生霍山石斛与栽培霍山石斛特征图谱,相似度为0.839,主要特征峰基本一致,表明栽培成功可行。金海英等[18]根据石斛苗的生长周期,将霍山石斛分为石斛原球茎、石斛小苗、石斛中苗、石斛大苗和石斛驯化苗5个阶段(周期约18个月),在组培过程中,石斛的多糖含量在相对较低的水平上稳步增长(4.7%~14%),且霍山石斛在栽培2年后多糖含量达到最高35.74%(共4年)。而陈程等[19]的研究表明,霍山石斛组培过程中(类原球茎、类原球茎芽、一节苗、多节苗和栽培苗)多糖的单糖组成比例上略有差异,但在多糖含量、多糖组分、化学特性等理化性质和免疫活性方面无显著差异,具有相似的促进小鼠脾细胞产生IFN-γ和TNF-α的作用,表现出一定的稳定性。陈乃东等[20]对1~4年株龄的组培霍山石斛、野生霍山石斛及河南石斛的多糖和乙醇溶出物动态积累规律进行研究,结果亦表明,以多糖和醇溶出物总量计,组培的霍山石斛以栽培2年采收为宜(合计4~5年),野生霍山石斛及河南石斛以3年株龄的品质最佳。陈乃东等[21]对组培的霍山石斛和野生的霍山石斛的单糖组成分析表明,两者均含有6种单糖:木糖、葡萄糖、甘露糖、半乳糖、半乳糖醛酸和核糖,但单糖比例差异显著。同时,钱明雪[15]研究了霍山石斛(栽培苗)多糖的生化特性与季节性变化规律,整体上,多糖含量和粘度呈现出冬季高于夏季的趋势,1月份多糖含量最高(40.107 g/100 g干重),8月份多糖含量最低(20.093 g/100 g干重);同时,不同季节的多糖均具有调节肠黏膜免疫的活性,从当年11月至次年4月的霍山石斛多糖的肠黏膜免疫调节活性整体上高于采自5~10月霍山石斛的多糖。总体上来看,当以霍山石斛多糖含量及生化特性为采收标准时,霍山石斛的最佳种植年限为4~5年,最佳的采收时期为当年的11月至翌年的4月。对不同原料及生长发育过程中主要活性成分多糖的变化规律进行研究,有助于后期多糖的分离纯化和药材的合理开发利用。
1.2 霍山石斛多糖的提取
目前,霍山石斛多糖的提取制备多采用水提醇沉、酶法辅助提取、微波和超声波辅助提取等方法。在传统水提醇沉工艺中,黄森等[22]利用Box-Behnken法对霍山石斛类原球茎中活性多糖的提取条件进行优化,得到其最佳工艺条件为:提取温度69.4 ℃,pH5.9,料液比1∶20,提取次数2次,提取时间1.57 h,霍山石斛多糖提取率最高,达到0.1821 g/g。进一步研究表明,DEAE-52树脂脱色效果较佳,脱色率达到65.47%。张炜玲等[23]采用响应面法优化霍山石斛多糖的提取工艺,最佳提取工艺条件为:料液比为1∶340 (g/mL),提取时间3.25 h,沉淀多糖的乙醇浓度86%,在此条件下霍山石斛多糖的提取率达到38.78%。Xian等[24]利用微波辅助提取霍山石斛多糖工艺,最优工艺条件为提取4次,每次40 min,微波功率550 W,多糖得率达到19.1%,并证实提取次数对多糖得率影响显著。秦霞等[25]利用超声波辅助法提取霍山石斛多糖,多糖得率达到28.02%,其最佳提取条件为料液比1∶10 (g/mL)、提取时间30 min、超声功率250 W。刘艳艳等[26]利用超声波辅助法提取霍山石斛多糖,在此最优优化条件下多糖平均得率是传统热水浸提工艺的1.70倍,同时超声波辅助提取工艺所得霍山石斛多糖的还原力和ABTS自由基清除率均优于热水浸提的多糖。魏明等[27]利用超声波协同纤维素酶法提取霍山石斛多糖,最佳提取工艺条件为料液比1∶40 (g/mL)、纤维素酶500 U/g、酶解温度40 ℃,酶解时间3 h,超声波功率为300 W,超声时间6 min,此时多糖提取量达到0.283 g/g。另外,刘石泉等[28]以疏花石斛为原料对4种提取工艺(传统水浸提法、纤维素酶法、超声辅助法和微波辅助法)进行比较,确定纤维素酶法提取多糖得率最高(11.84%),是多糖提取时的首选方案,而传统水浸提法(9.75%)宜结合超声辅助法(10.78%)和微波辅助法(9.91%)从而提高多糖得率。需要注意的是,酶法提取多糖虽提高提取率且条件也比较温和,但采用纤维素酶会降解O-乙酰-β-D-1,4-葡甘露聚糖,在铁皮石斛、霍山石斛及细茎石斛中均发现有此类多糖[29]。同时采用超声波和微波辅助提取可显著的缩短提取时间,但多糖经过超声或微波处理后其糖键可能会发生断裂等不利影响[29]。霍山石斛多糖的提取方法需要结合多糖的结构特征和生物活性作更进一步的综合分析,从而根据实验目的选择合适的提取方法。
1.3 霍山石斛多糖的分离纯化
多糖的纯度会影响其生物活性,获得高纯度的多糖是将其应用在医药领域不可或缺、至关重要的一步。如需要确证单一多糖化学结构或混合多糖中每一个多糖的单糖组成及其摩尔比,其纯度必须在95%以上,因而多糖的分离纯化及纯度检测显的非常重要。
霍山石斛多糖的分离纯化过程主要包括分离纯化(脱色、除蛋白及低聚糖等杂质)和纯度鉴定。黄森[30]对2种脱蛋白方法和4种脱色方法进行比较研究,Sevag法脱蛋白效果(84.73%)优于三氯乙酸(TCA)法(82.99%),且Sevag法多糖总量保持较好。同时比较酒精、H2O2、活性炭和DEAE-纤维素法的脱色效果,其中二乙氨乙基(DEAE)-纤维素法脱色率最高(65.47%),多糖损失率较小(31.73%)。王琳炜等[31]以霍山铁皮石斛为原料,比较Sevag法、酶法(胰蛋白酶)及酶法-Sevag法对多糖脱蛋白效果及多糖损失率的影响,结果表明,酶法-Sevag法联用,蛋白脱除率最高(81.58%),且多糖的损失率低(15.63%)。而Sevag法消耗试剂大,多糖损失率较高(32.72%),且酶法蛋白脱除率低(71.88%)。
Zha等[32]最早采用DEAE-纤维素离子交换色谱、Sephacryl S-200、Sephadex G-75和Sephadex G-100等凝胶渗透色谱分离方法,从霍山石斛类原球茎的水溶性多糖中首次分离到一种分子量为22 kDa的均一性多糖HPS-1B23。潘利华等[33]利用DEAE-纤维素离子交换树脂、Sephacryl S-200从组培霍山石斛茎中分离纯化,得到单一多糖组分DHP-W2。Hsieh等[34]利用DEAE-cellulose和Sephacryl S-200从霍山石斛叶和茎的黏液中分离得到一种分子量为9.7×103Da的多糖。蒋玉兰[35]利用DEAE-52和Sephacryl S-200从霍山石斛中分离得到一个大分子多糖组分DHP-W4,分子量为1.2×106Da。由上可以看出,霍山石斛多糖的分离纯化过程中宜采用DEAE-纤维素法脱色和酶法-Sevag法联用去除蛋白质,而制备霍山石斛均一多糖主要采用离子交换色谱、凝胶渗透色谱等柱层析方法。值得注意的是,柱层析方法耗时多、产量低,不能满足工业化大生产,需要更加高效的分离纯化方法,其中分级醇沉、盐析及超滤等对霍山石斛多糖的影响有待进一步确证。
2 霍山石斛多糖的理化性质及结构特征
霍山石斛多糖的分子量分布、单糖组成、空间结构及糖苷键的连接方式具有明显特征,多糖的结构与其功效的表达有密不可分的联系。通过比较发现(表1),霍山石斛多糖主要由葡萄糖(Glc)、甘露糖(Man)、半乳糖(Gal)及少量的阿拉伯糖(Ara)、鼠李糖(Rha)和木糖(Xyl)组成(以葡萄糖为主,葡萄糖:甘露糖>2∶1),推测确定霍山石斛多糖主要是一类O-乙酰葡萄甘露聚糖,广泛存在(1→4)-α-D-Glcp、(1→6)-α-D-Glcp、(1→6)-β-D-Glcp、(1→4)-β-D-Glcp、(1→3,6)-β-Manp、(1→4)-β-Manp、(1→3,6)-α-D-Manp等糖苷键连接方式。但其分子量、单糖组成、连接位置及顺序存在较大差异,这可能是由霍山石斛生长环境、提取纯化等的不同引起的。Zha等[32]首次从从霍山石斛中成功分离出HPS-1B23,该多糖为α-吡喃构型,平均分子量为2.2×104Da,由葡萄糖、甘露糖、半乳糖按31∶10∶8的摩尔比组成,具有增强免疫力的功效。肖婧婧[37]从霍山石斛类原球茎中分离纯化到一大分子均一多糖DHPD2,分子量8.09×106Da,主要由半乳糖、葡萄糖、阿拉伯糖、甘露糖、木糖、鼠李糖组成,其摩尔比为0.896∶0.723∶0.2∶0.072∶0.031∶0.028。Li等[38]从霍山石斛类原球茎的粗多糖中分离纯化得到一种相对分子质量为2.32×105Da单一多糖DHP-4A,单糖组成分析表明,DHPD-4A由葡萄糖、阿拉伯糖、甘露糖和鼠李糖构成,摩尔比为13.8∶3.0∶6.1∶2.1。冯宝军[39]从霍山石斛中分离纯化到一分子量为7.3×104Da的多糖组分DHP-W2,主要由葡萄糖、木糖和半乳糖按1.1∶1.0∶0.5的分子摩尔比以及少量的半乳糖醛酸组成。Tian等[40]采用Sephadex G-100凝胶层析对霍山石斛中性多糖(DHP1)进一步分离纯化,得到DHP1A和DHP1B两种多糖片段,相对分子质量分别为6.7、3.51 kDa。DHP1A主要由葡萄糖、甘露糖、半乳糖组成,其摩尔比为16∶2.5∶1,DHP1B主要由葡萄糖、甘露糖、半乳糖组成,其摩尔比为10.55∶1.00∶0.21。这些与文献报道[41]的铁皮石斛多糖结构特征差异显著,铁皮石斛多糖主要由葡萄糖、半乳糖、甘露糖、木糖、阿拉伯糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸等单糖组成(甘露糖占主要),广泛存在(1→4)-β-D-Glcp、(1→4)-α-D-Glcp、(1→6)-α-D-Glcp、(1→4)-β-D-Manp等糖苷键连接方式,同时与香菇多糖(抗肿瘤)、猴头菌多糖(保肝护胃)和灵芝多糖(抗肿瘤)以β-1,3、β-1,3,6为主的葡聚糖差异显著[42-44]。综合上述研究可以看出,不同种源、品种及提取纯化方法得到的霍山石斛多糖的理化性质相差较大,目前分离纯化到的多糖的分子量主要集中在几万,大分子量的均一多糖仍报道较少,需进一步深入研究。
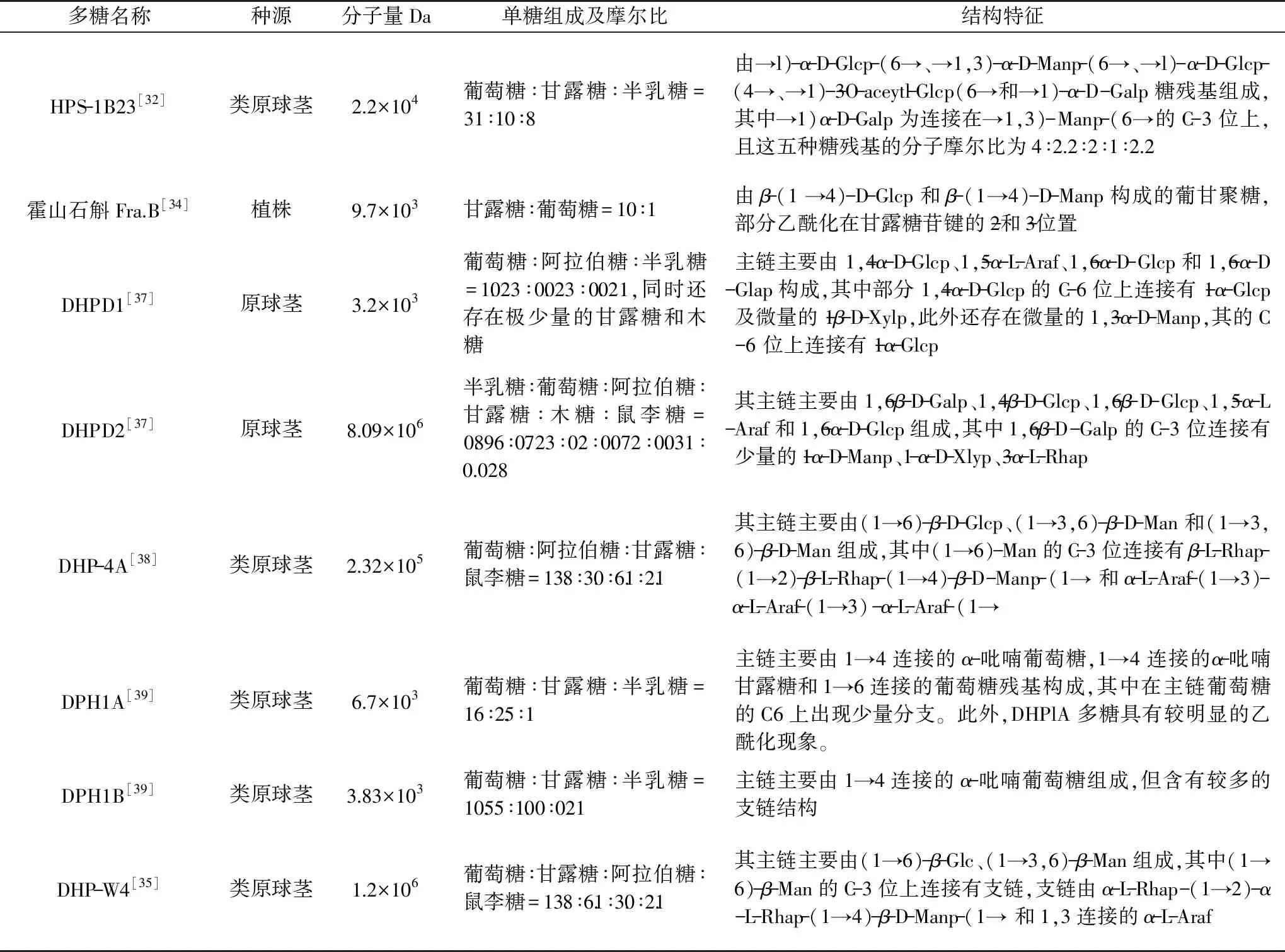
表1 霍山石斛多糖的理化性质和结构特征Table 1 Physicochemical properties and structural features of polysaccharides from Dendrobium huoshanense
3 霍山石斛多糖的生物活性
霍山石斛具有广泛的药理作用,是一种无毒、安全的保健食品原料。现代科学研究表明:霍山石斛多糖具有增强免疫力、抗肿瘤、抗氧化、降血糖、保肝护胃和抗白内障等多种生物活性。
3.1 促进细胞健康
3.1.1 抗肿瘤 霍山石斛多糖可通过抑制肿瘤细胞的生长而起到抗肿瘤作用,鲍丽娟等[45]比较了霍山石斛、铁皮石斛、金钗石斛和马鞭石斛等四种石斛的水提物对人宫颈癌HelaS3和肝癌HepG2细胞的体外抑制作用,结果表明,四种石斛水提物对HelaS3和HepG2细胞均有不同程度的细胞毒性作用,且在所选浓度范围内对剂量和时间有依赖性。同时,激光扫描共聚焦显微观察HelaS3和HepG2细胞,发现细胞正处于凋亡期,从而从形态学验证了其抑瘤作用。张丹丹等[46]研究发现,经霍山石斛多糖DHP-2处理过的胃癌细胞SGC-7901形态发生固缩,凋亡效果显著,不仅能明显下调原癌基因cmyc的表达,表达仅为对照的42.34%。同时,能显著抑制癌基因野生型p53的表达,其表达比对照高1.04倍。到目前为止,关于霍山石斛的抗肿瘤作用研究还局限于体外活性筛选,因此有必要开展霍山石斛体内抗肿瘤作用试验,对其活性进行深入的研究,阐明霍山石斛的抗肿瘤作用机制。
3.1.2 增强免疫力 霍山石斛多糖可通过活化淋巴细胞、激活巨噬细胞、自然杀伤/淋巴因子激活的杀伤细胞(NK/LAK细胞)等来调节机体的免疫功能,从而发挥抗肿瘤作用。首先,Zha[32]和Hsieh[34]等证实了霍山石斛水溶性总多糖具有促进小鼠巨噬细胞和脾细胞释放肿瘤坏死因子-α(TNF-α)、γ-干扰素(IFN-γ)、白介素10(IL-10)等细胞因子和粒细胞-巨噬细胞集落刺激因子(GM-CSF)等造血生长因子的功能,并通过分离纯化、结构表征和构效关系的研究表明,石斛多糖发挥免疫增强活性需要适度的乙酰化。李胜立等[47]通过研究霍山石斛类原球茎对小鼠免疫调节活性的有效部位及其毒理安全性评价,认为其具有免疫调节活性的有效部位为石斛多糖,且该多糖无毒、无致突变作用。陈程等[19]对不同发育阶段的霍山石斛多糖组分(其单糖组成具有差异)的体外免疫活性实验表明,其不同发育阶段霍山石斛多糖的免疫活性却无显著性差异,具有相似的促进小鼠脾细胞产生IFN-γ和TNF-α的作用。Li等[38]实验证实霍山石斛多糖组分DHP-4A具有免疫活性,可以通过激活p38、ERK、JNK和NF-κB的核易位显著地刺激RAW264.7巨噬细胞分泌NO、TNF-α、白介素-6(IL-6)和IL-10。可以看出,国内外对霍山石斛多糖的研究主要侧重于对动物机体细胞、体液免疫、细胞因子诱生等方面,而对免疫系统中各种细胞表面、细胞内和细胞间信息传递,受体和它们的控制基因的发生、分化和表达过程许多机制尚未阐明。
3.1.3 抗氧化 目前,普遍认为氧化应激与衰老、神经病变、糖尿病、心血管疾病和癌症密切相关,从霍山石斛中分离纯化的石斛多糖对此类疾病的治疗有辅助作用。查学强等[48]比较了霍山石斛和铁皮石斛多糖的清除自由基的能力,结果表明霍山石斛多糖具有更强的抗氧化活性能力。Tian等[40]实验证实低分子量霍山石斛多糖组分DHP1A(分子量6.70 kDa)也具有抗氧化活性。而郝杰等[49]对不同分子量霍山石斛多糖的抗氧化效果进行研究,结果表明,不同相对分子量的多糖,在不同抗氧化体系中,其抗氧化活性差异显著,大分子量的多糖具有更好的抗氧化活性。已有研究表明霍山石斛多糖均具有较显著的抗氧化效果,其抗氧化效果的大小与石斛的种类、多糖的纯度、分子量的大小等因素相关。同时,对于铁皮石斛,鲍素华等[50]研究认为不同相对分子质量铁皮石斛多糖均有抗氧化活性,且抗氧化能力与其相对分子质量大小有关,在其研究中,铁皮石斛多糖分子量小于35.3 kDa或大于74.4 kDa的生物活性更高。综上分析表明,霍山石斛多糖具有很强的清除DPPH自由基、超氧自由基、H2O2和羟基自由基的能力,并具有显著的还原力和抑制Fe2+-VC诱导的脂质过氧化,可以从不同角度改善细胞健康。
3.2 降血糖及抗白内障
糖尿病是一种由于缺乏胰岛素、胰岛素抵抗引起的代谢疾病,其常伴有视网膜病变、白内障、神经病变、肾病、心血管疾病等并发症。Pan[32]和李秀芳等[51]以四氧嘧啶为诱导剂建立糖尿病小鼠模型,比较霍山石斛(DHP)与4种药典石斛多糖(铁皮石斛DOP、金钗石斛DNP、流苏石斛DFP和鼓槌石斛DCP)的降血糖活性差异,研究发现,DHP、DOP、DNP三种多糖可显著降低糖尿病小鼠空腹血糖(FBG)和糖化血清蛋白(GSP),同时提高血清胰岛素(INS)的水平,组织病理学发现DHP、DOP、DNP可修复或减缓胰岛的损伤,从而证实DHP、DOP、DNP具有降血糖的效果,且霍山石斛多糖降血糖作用最为显著。何苗[52]的研究表明,霍山石斛胶囊可显著减少糖尿病(DM)大鼠的饮水、饮食及排泄量,有效改善DM大鼠“三多一少”的病症;可降低DM大鼠的血糖水平和血清甘油三脂、胆固醇和游离脂肪酸水平,调节胰岛素水平;可修复胰岛B细胞,改善细胞形态,增加B细胞数量,从而刺激胰岛素分泌,有效调节血糖水平。同时罗建平课题组[53-54],使用糖尿病型大鼠白内障模型,对霍山石斛抗白内障活性化学成分进行研究,表明霍山石斛多糖可以显著抑制白内障的形成和发展,进一步的药理实验表明,霍山石斛多糖可以从下调一氧化氮合酶基因表达和上调谷胱甘肽家族抗氧化酶活性两方面,协同抑制晶状体蛋白的糖基化交联变性,从而抑制晶状体的浑浊进程并延缓白内障的发生。因而,霍山石斛多糖是一种良好的糖尿病性白内障防治药物,它能从氧化途径和蛋白糖基化途径同时抑制晶状体浑浊进程。药用石斛是一类具有明目的传统中药材,早在《神农本草经》中就有记载,同时清睛粉中也含有石斛成分,因而霍山石斛多糖抗白内障活性、作用机理和相关产品的开发具有较大的研发空间。
3.3 保护肝脏
目前,酒精性肝损伤已成为仅次于肝炎病毒导致肝损伤的第二大病因,对酒精性肝损伤的防治直接关系到人类的健康安全。孟海涛等[55]以亚急性酒精性肝损伤小鼠为实验动物模型进行研究,明确多糖是霍山石斛抗小鼠亚急性酒精性肝损伤的功能因子。其中,水提粗多糖各个剂量组均可显著改善肝脏组织损伤和脂肪变性,降低血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)活性及低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、甘油三酯(TG)水平,提高血清高密度脂蛋白胆固醇(HDL-C)含量,增强肝组织乙醇脱氢酶(ADH)、乙醛脱氢酶(ALDH)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性,降低肝组织谷胱甘肽(GSH)损耗,抑制肝组织丙二醛(MDA)含量增加。在不同提取物中,霍山石斛水提醇溶物抗亚急性酒精性肝损伤的活性最差,水提物、醇沉物、冷冻干燥物均具有一定的肝损伤保护活性。王凤华等[56]证实霍山石斛水提取物可降低酒精对肝细胞的损伤作用,其作用机制可能是通过介导NF-κB/p65和p38 MAPK发挥抗氧化、抗炎作用来实现的。钱明雪等[57]分析了6种石斛多糖(霍山石斛、铁皮石斛、流苏石斛、鼓槌石斛、金钗石斛和细茎石斛)对亚急性酒精性肝损伤的干预效果,结果表明,6种石斛多糖的酒精性肝损伤保护活性存在差异,霍山石斛对缓解酒精性肝损伤的效果最好,其中DHP、DOP、DFP能够抑制小鼠肝组织P4502E1 mRNA的表达,DHP和DOP对小鼠肝组织TNF-α、IL-1 mRNA表达的具有更强的抑制作用。田长城等[58]用四氯化碳(CCl4)构建小鼠急性肝损伤模型,评价霍山石斛不同多糖成分的保肝作用。结果表明,DHP1多糖组分可以有效增强小鼠肝组织对CCl4毒性的抵抗,降低CCl4诱导的血清中谷丙酸转氨酶(ALT)和谷草转氨酶(AST)活性的升高,抑制肝组织中丙二醛(MDA)的过量表达,同时对超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性呈现恢复作用,表现出良好的预防肝损伤作用。进一步分析表明,DHP1A的摄入可以有效降低CCl4肝损伤中各项生化指标的升高,同时,降低丙二醛和8-羟基脱氧鸟苷(8-OHdG)的产生。DHP1A进一步调节小鼠肝脏内各种炎性分子的表达,如肿瘤坏死因子(TNF-α)、白介素(IL)-1β、单核细胞趋化蛋白(MCP)-11、巨噬细胞炎性蛋白(MIP)-2和CD68。此外,DHP1A还能够干扰CCl4诱导的核因子(NF)-kB的激活,从而缓解小鼠的肝损伤[59]。可以看出霍山石斛多糖能够有效增强对酒精性肝损伤、化学性肝损伤的抵抗能力,是一种潜在的保肝成分,同时其发挥作用的机制与抗氧化损伤和脂质代谢调节有关,而活性多糖的结构基础及分子作用机理有待更深入研究。
3.4 其他功能活性
霍山石斛多糖除了具有提高免疫力、抗氧化、抗肿瘤、降血糖、保护肝脏及抗白内障等功能活性外,文献报道霍山石斛多糖还具有降血脂、抗糖基化和抗疲劳等作用。例如,张静等[60]研究发现霍山石斛胶囊能够调节血脂代谢异常,增强抗氧化能力,具有防治脂肪肝和抗动脉粥样硬化等作用。肖婧婧[37]的研究表明,霍山石斛多糖DHPD1和DHPD2,具有抗蛋白质非酶糖基化的活性,能够抑制糖基化终产物(AGEs)的形成,它与糖尿病慢性并发症、动脉粥样硬化、心血管疾病的发生发展密切相关。夏云建等[61]研究表明,霍山石斛多糖具有抗疲劳的作用,能够显著延长小鼠游泳时间,降低运动后小鼠的乳酸累积,降低血清尿素氮和丙二醛水平,增加运动后小鼠的肝糖原储备值。Wu等[62]研究表明,霍山石斛多糖抑制IL-5、IL-13、IFN-γ和TGF-β1等细胞因子的分泌、改善过敏性皮肤炎患者的体征和症状。霍山石斛的药理研究在近十年来取得一定的进展,尤其针对多糖的研究,取得了可喜的成果,但目前研究仅局限于初步的活性筛选和药效验证,对作用机制研究涉及不深,更少见临床的规范研究。
4 霍山石斛多糖消化、代谢研究进展
随着药代动力学和肠吸收方法的不断发展和创新,多糖的吸收研究也取得了突破性进展。消化和酵解作为吸收的关键步骤,是使食品变成能被机体吸收的物质,进而在机体发挥其相应功能的过程,因此,对物质消化行为的研究成为了国际研究的热点。多糖作为大分子糖类,一般认为它难以在胃肠道中被人体消化和吸收,常被用作药物的保护涂层[63]。多糖的主要代谢途径是:通过肠道微生物在结肠处发生酵解作用,产生大量的短链脂肪酸,如乙酸、丙酸和丁酸[64]。目前,关于石斛多糖的消化吸收研究还很少,李凡[65]和Xie[66]等研究表明,霍山石斛多糖(DHP-2A,分子量1.78×106Da)经口服作用进入胃肠道后发生降解作用,生成一个可以在胃肠道中稳定存在的霍山石斛多糖片段(分子量1.17×104Da)。霍山石斛多糖(DHP-2A)在胃肠道中降解的研究表明,霍山石斛多糖(DHP-2A)在体外胃液中发生降解生成一个稳定存在的片段且其保留时间与体内实验结果一致,但其在体外唾液、肠液中很稳定,说明霍山石斛多糖(DHP-2A)降解的部位是小鼠的胃,最终可以通过吸收作用进入血液。张冠亚[67]对铁皮石斛多糖体外模拟胃肠道消化的研究表明,唾液不能改变多糖的分子量和还原糖含量,在模拟胃中和模拟肠道中,多糖的分子量降低,从(314.51±6.09) kDa分别减小到(244.79±2.99) kDa和(229.91±1.59) kDa,同时还原糖含量增加,反应后的消化液经过透析并没有检测到单糖的产生,表明消化过程中没有单糖的产生,同时多糖的整体结构并没有受到破坏,胃和小肠并不能消化多糖。最终发现铁皮石斛多糖的糖苷键连接被人体肠道菌群破坏,促进结肠发育、改善肠道功能和加速肠道蠕动。可以看出,关于不同石斛多糖在胃肠道吸收机制存在一定差异,有待进一步深入研究,为后续多糖在体内发挥功效提供理论基础。
5 霍山石斛产品开发
5.1 霍山石斛保健食品开发利用现状
目前,《中国药典》收录的胃安胶囊、阴虚胃痛颗粒,是以石斛为主药,以胃肠道疾病为主治的中成药,同时收录的石斛夜光丸,具有滋阴补肾,清肝明目的功效[2]。而脉络宁注射液、清睛粉等均含有石斛成分。根据国家食品药品监督管理局批准的国内保健品目录和进口保健品目录,目前有5种石斛(霍山石斛、铁皮石斛、金钗石斛、铜皮石斛、细茎石斛)被开发成保健食品,它们分别是霍山石斛(3种剂型,2个品牌)、铁皮石斛(10种剂型,43个品牌)和金钗石斛(4种剂型,5个品牌),其余均为一个产品。其中,以霍山石斛为主要原料的保健食品的具体情况为:九仙尊霍山石斛股份有限公司开发的霍山石斛清养颗粒(国食健字G20130623)、清养浸膏(国食健字G20140033);安徽永生堂药业有限责任公司开发的科苑R霍山石斛胶囊(卫食健字(2001)第0012号)。可以看出,霍山石斛为原料开发出的保健品剂型种类和保健功能远低于铁皮石斛,不能满足客户对不同剂型和功能的需求,因此在霍山石斛类产品的深度开发和综合利用方面还有待加强。
5.2 产品安全性和功能评价
目前,霍山石斛类产品的安全性评价结果表明,霍山石斛类原球茎多糖无毒,无致突变作用;霍山石斛茎(人工栽培),无急性毒性、亚急性毒性和致突变作用,在试验剂量范围内,霍山石斛属安全性保健食品原料。张炜玲等[68]将200只健康雌性小鼠分为5个试验组,每组分空白对照、低、中和高(0.5、1.0、3.0 g/(kg·bw))4个剂量组的剂量连续灌胃给药30 d,完成复方霍山石斛浸膏增强免疫力的研究,不同剂量组均可刺激小鼠脾淋巴细胞的增殖和转化作用,可促进小鼠迟发型变态反应,提高小鼠抗体生成细胞数和血清溶血素水平,增强小鼠的单核-腹腔巨噬细胞吞噬功能、碳廓清能力和NK细胞的活性。吴文华等[69]参照《保健食品检验与评价技术规范》要求,分别对不同剂量组的小鼠进行细胞免疫功能、体液免疫功能、单核-噬细胞功能、NK细胞活性测定。结果表明,复方霍山石斛含片具有增强免疫力的作用,其细胞免疫功能和单核-巨噬细胞功能为阳性,体液免疫功能和NK细胞活性为阴性。与此同时陈锋等[70]研究表明,该复方霍山石斛含片具有清咽功能。根据相关文献报道[71-73],霍山石斛可以深度开发石斛多糖方面的保健品或药品,具备抗氧化、辅助降血糖、清咽润喉和保护肝脏等功效。
6 结论与展望
近些年来,针对霍山石斛多糖活性的研究已成为研究热点,近50年来霍山石斛在组织快繁、化学成分和药理活性等研究方面取得了很大的进展,为规模化仿野生栽培提供良好的技术保障,从而在根本上改善因野生霍山石斛资源濒临灭绝导致材料缺乏、成本昂贵等研发和加工问题。值得注意的是,目前分离纯化的霍山石斛均一多糖,基本上来源于霍山石斛悬浮细胞培养体系及圆球茎,而对于霍山石斛原药材中多糖的研究,目前尚停留在提取及含量测定阶段,很少有关于霍山石斛原药材的多糖分离、鉴定等报道。目前,Zha[32]研究表明,霍山石斛类原球茎总多糖的组分和生物活性均与野生霍山石斛相当,主要组分和主要活性组分均为HPS-1。而陈乃东等[21]对霍山石斛、铜皮石斛多糖的研究表明,试管苗途径植株的多糖从单糖种类到含量,与野生植株明显不同,试管苗时期内生真菌的缺失可能是重要原因。王娣等[74]研究表明,内生菌SH-01对霍山石斛试管苗的生长有显著的促进作用,但对主要有效成分石斛多糖和生物碱的积累并没有影响。因此,针对从原药材中分离纯化活性多糖工作有待进一步加强,明确不同原材料对多糖特性的影响。
当前,霍山石斛的综合利用主要集中在中药保健品,如霍山石斛枫斗、石斛颗粒、石斛浸膏等,但其开发深度远满足不了市场需求,应加强深度开发,以满足不同人群对霍山石斛产品的养生保健需求。然而,大多数保健食品只停留在霍山石斛整体功能上,其中的天然活性物质的开发利用的深度和广度还远远不够,基本还多处于提取和一级结构分析上,同时多糖进入体内的变化过程及发挥作用的机制,及更多的毒理学实验及临床实验也需进一步开展。因此,未来的研究应注重四方面工作:一是加强霍山石斛原药材多糖的分离纯化,用均一多糖进行药理活性和作用机理研究;二是加强霍山石斛多糖的化学结构研究,并在一级结构和高级结构层次上开展药用石斛多糖的构效关系研究,为后期深入开发霍山石斛类中成药做准备;三是霍山石斛多糖的体内消化稳定性研究,探索其在胃肠道中的降解和吸收机制;四是进一步完善霍山石斛产品的安全性和毒理学评价。
