无机盐对湖北花楸叶多糖醇沉效率 及其抗氧化性的影响
2019-03-28,,,*,,
,,,*,,
(1.西北农林科技大学风景园林艺术学院,陕西杨凌 712100; 2.西北农林科技大学林学院,陕西杨凌 712100)
湖北花楸(SorbushupehensisC. K. Schneid.)为花楸属植物,为落叶乔木或灌木。我国有 50 余种花楸属植物,产于西南、西北以及东北地区。该属植物具有重要的经济价值,密集的花序可使其作园林观赏植物,其中部分种类植物是果树育种和砧木的重要原料,种子油用于肥皂及医药工业,树皮用于鞣皮工业中[1-2]。研究发现,该属植物中含有较丰富的黄酮、花青素、双联苯酚、类山梨酸苷、生氰苷等成分,并在药理作用上具有强抗氧化、抗癌、抗辐射和止咳平喘等作用,引起了国内外的广泛关注[3-6]。关于湖北花楸叶中所含的多糖的研究目前尚未见报道。
植物多糖具有一定的生物活性,具有免疫调节、抗肿瘤、降血糖、降血脂、抗菌抗病毒、保护肝脏等保健作用[7]。植物中多糖提取方法包括水提法、酸碱提法、超声波辅助提取法、微波辅助提取法、等多种方法[8-10],这些提取方法所提多糖都需要进一步的纯化。多糖的纯化方法有盐析法、乙醇沉淀法、柱层析法、超滤法,其中乙醇沉淀法运用最为广泛[11]。乙醇沉淀法利用多糖能溶于乙醇而杂质不溶于乙醇的特性,在加入乙醇后,有效成分转溶于乙醇中,而杂质则被沉淀出来。此法虽能提取出大量的多糖,但是往往存在醇沉不彻底的缺点,致使原料利用率低下,其次,醇沉的过程大多需要过夜,存在耗时较长的问题。在水和有机溶剂的混合溶液中,加入一定量的无机盐可改变水相的极性,提高两相中的化合物分离效果,这一过程与盐析的原理相似。如果这一原理运用于多糖的醇沉过程,将大大提升其提取效率[12]。针对在提取多糖的醇沉过程中存在的以上问题,本文以湖北花楸叶多糖为对象,研究添加无机盐对其醇沉特性的影响,通过探索其醇沉规律来缩短醇沉时间,提高提取效率,同时为其他植物多糖提取的醇沉过程提供参考思路。
1 材料和方法
1.1 材料与仪器
湖北花楸叶 采集于秦岭火地塘,风干,-20 ℃保存;1,1-二苯基-2-三硝基苯肼 北京中生瑞泰科技有限公司;抗坏血酸 美国Sigma公司;无水乙醇、Na2SO4、(NH3)2SO4、NaCl、葡萄糖、苯酚、浓硫酸、K3[Fe(CN)6]、三氯乙酸、FeCl3、FeSO4、水杨酸 均购于科密欧化学试剂公司。
TU-19紫外光光度计 北京普析通用仪器有限责任公司;FA1204B电子分析天平 上海天平仪器厂;R213B旋转薄膜蒸发仪 上海申生科技有限公司;FX超声波清洗仪 济宁丰鑫超声设备有限公司;SHB-3循环真空泵 上海申生可以有限公司;索氏提取器 蜀牛玻璃仪器有限公司;C-MAG MS4磁力搅拌器 上海精密仪器仪表有限公司;TGL-16M冷冻离心机 湘仪离心机仪器有限公司;WJX-200高速多功能粉碎机 上海缘沃工贸公司;FD8-3T立式冷冻干燥机 GOLD-SIM公司;TENSOR II傅里叶变换近红外光谱仪 德国Bruker Optics公司。
1.2 实验方法
1.2.1 花楸叶的预处理 将湖北花楸叶烘干(55 ℃,72 h),粉碎,过60目筛,然后用石油醚(沸程60~90 ℃)脱脂8 h,得脱脂花楸叶粉末,保存备用。
1.2.2 花楸叶多糖提取液的制备 精准1.00 g脱脂的花楸叶粉末于锥形瓶中,超声波辅助水热提取,提取条件为:料液比1∶30 (g/mL),超声时间40 min,超声功率350 W,提取温度60 ℃[13]。抽滤提取液,上清液于40 ℃,0.1 MPa下旋转蒸发浓缩至原体积五分之一,浓缩液于4 ℃下可经过醇沉后得到多糖。
1.2.3 花楸叶多糖含量的测定 采用苯酚-硫酸法测定花楸叶中多糖含量[14],以葡萄糖为标准品,于490 nm处测定吸光值,以葡萄糖质量浓度为横坐标x(mg/mL),吸光值Y为纵坐标,绘制标准曲线,得到标准曲线方程为:Y=16.64x-0.0124(R2=0.9992)。
多糖得率的计算公式如下:
多糖得率(%)=花楸叶提取液中多糖质量×100/原料质量
1.2.4 单因素实验
1.2.4.1 无机盐种类及浓度对多糖醇沉特性的影响 选取三种不同种类的无机盐(NH3)2SO4、Na2SO4、NaCl)在其浓度(1.2%、1.6%、2.0%、2.4%、2.8%),加入4倍体积无水乙醇,醇沉24 h,过滤得所提多糖,测定多糖得率。
1.2.4.2 乙醇体积倍数对加盐后醇沉特性的影响 取所制备的提取浓缩液,添加2、3、4、5、6倍体积的乙醇和2.4%的Na2SO4,醇沉24 h,过滤得所提多糖,测定多糖得率。
1.2.4.3 醇沉时间对加盐后醇沉特性的影响 取所制备的提取浓缩液,添加4倍体积的乙醇和2.4%的Na2SO4,分别醇沉2、6、12、24 h,过滤得所提多糖,测定多糖得率。
1.2.5 正交试验 在单因素实验的基础上,考察Na2SO4浓度A、醇沉时间B、醇沉体积C对多糖得率的影响,并采用三因素三水平L9(33)正交试验,来确定提高多糖得率的最佳条件,并在最佳条件下进行多糖得率验证试验。
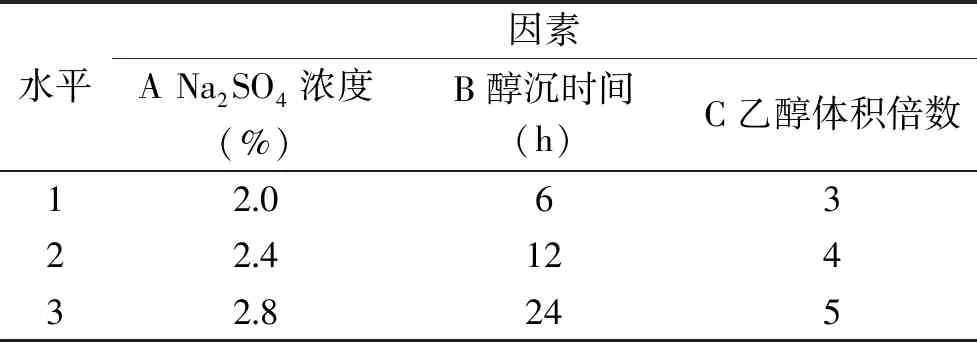
表1 正交试验的因素水平表Table 1 Factors and levelsTable of orthogonal array test
1.2.6 红外表征 将超声提取醇沉的多糖溶液与加入2% Na2SO4醇沉的所得多糖溶液倒入分子量为5000和10000 Da半透膜中,透析出无机盐,截留得到不同分子量大小的多糖,纯化后将溶液冷冻干燥[15]。采用KBr压片法,在4000~400 cm-1范围内进行红外光谱扫描,检测无机盐的加入对醇沉多糖的结构是否有影响。
1.2.7 抗氧活性的测定
1.2.7.1 总抗氧化能力的测定 参照文献[16]将2 mL不同浓度多糖溶液与1 mL PBS(pH=7.0)、1 mL 1% K3[Fe(CN)6]溶液置于50 ℃中水浴20 min,加入2.5 mL三氯乙酸均匀混合,6000 r/min离心15 min,取上清液2.5 mL,加入0.5 mL新配制的0.1% FeCl3溶液,混合均匀,于700 nm处测定吸光值。蒸馏水为空白对照,同等浓度维生素C为阳性对照。每个样品三组重复,取平均值。
1.2.7.2 DPPH自由基清除能力的测定 参照文献[17]的方法,将2 mL不同浓度的多糖溶液与2 mL 0.25 mmol/L DPPH-乙醇溶液混合,混匀后静置30 min,以无水乙醇为参比,于517 nm处测定吸光值分别为A,维生素C为阳性对照。每个样品三组重复,取平均值。样品对DPPH自由基的清除率则为:
DPPH自由基清除率(%)=(A1-A2)×100/A1
其中:A1为加入多糖溶液反应后的A值,A2为蒸馏水代替多糖样品液后的A值。
1.2.7.3 羟自由基清除能力的测定 参照文献[18]的方法,将2 mL不同浓度多糖溶液,2 mL 6 mmol/L FeSO4溶液与2 mL 6 mmol/L H2O2溶液加入试管中,摇匀后静置15 min,再加入2 mL 6 mmol/L水杨酸溶液,摇匀后静置30 min,于510 nm处测定吸光值A,蒸馏水为空白对照,维生素C为阳性对照。每个样品做三组重复,取平均值。样品对羟自由基的清除率为:
羟自由基清除率(%)=[A0-(A1-A2)]×100/A0
其中:A0为不加多糖溶液的空白值,A1为加入多糖液反应后的A值,A2为不加水杨酸时溶液的A值。
1.3 数据处理
上述方法中多糖得率实验每组重复三次,取平均值,采用Excel软件作图,多糖的红外表征采用Origin8软件作图。
2 结果与分析
2.1 单因素实验结果
2.1.1 无机盐种类及浓度对多糖得率的影响 不同的无机盐会对醇沉体系的相平衡造成不同的影响[12],因此添加不同种类无机盐后多糖的醇沉效果定会存在差异。不同浓度的Na2SO4、NaCl、(NH3)2SO4进对多糖得率的影响如图1所示。
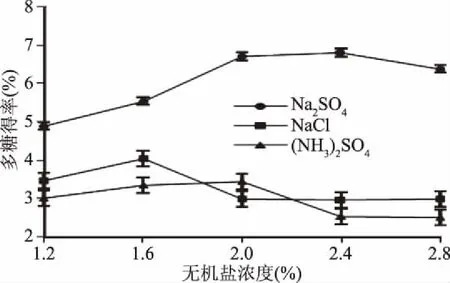
图1 无机盐种类对醇沉过程的多糖得率的影响Fig.1 Effects of different kinds of inorganic salts on the yield of polysaccharide in the process of alcohol precipitation
多糖的提取液采用传统的醇沉方法纯化,其多糖得率为2.54%。由图1看出,加入一定浓度范围的三种无机盐,均能够一定程度上提高多糖的得率,其中,添加Na2SO4时多糖的得率提高最为明显。当Na2SO4浓度为2.4%时,多糖的得率趋于稳定;当浓度过高时,多糖得率反而缓慢下降。当(NH4)2SO4浓度大于2%,NaCl浓度大于1.6%时,多糖的得率反而有较大幅度的减少。无机盐浓度不同,对多糖得率影响也不相同,在一定的浓度内,多糖得率随着无机盐浓度的升高而升高,当无机盐浓度达到一定数值时,多糖得率基本维持稳定。无机盐浓度较低时,可能会与水结合形成盐溶液,从而降低多糖与水结合的可能性,从而使得多糖醇沉效率提高,当无机盐浓度达到一定数值时到饱和状态,其对多糖醇沉影响不再明显[12]。此外,过高的添加量会导致过高的成本,因此,本实验选择的无机盐为Na2SO4,浓度为2.4%。
2.1.2 乙醇体积倍数对多糖得率的影响 乙醇体积倍数在醇沉过程中有重要的影响。适量的乙醇体积倍数可以使多糖在较低的成本下尽可能多地醇沉出来。不同体积倍数的无水乙醇对多糖醇沉效率影响很大。当无水乙醇的体积倍数为多糖溶液的2~4倍时,多糖得率呈升高趋势;当无水乙醇的体积倍数为多糖溶液的4倍以上时,多糖得率基本稳定。原因可能为:当乙醇体积倍数过低时,果胶和其他水溶性色素溶解性好,从而影响了多糖在溶剂中的溶解,提取液中多糖含量低,提取效果差;当乙醇体积倍数过高时,溶液极性过低,不利于多糖溶解[12]。因此选择无水乙醇添加倍数为多糖溶液的4倍进行后续实验。
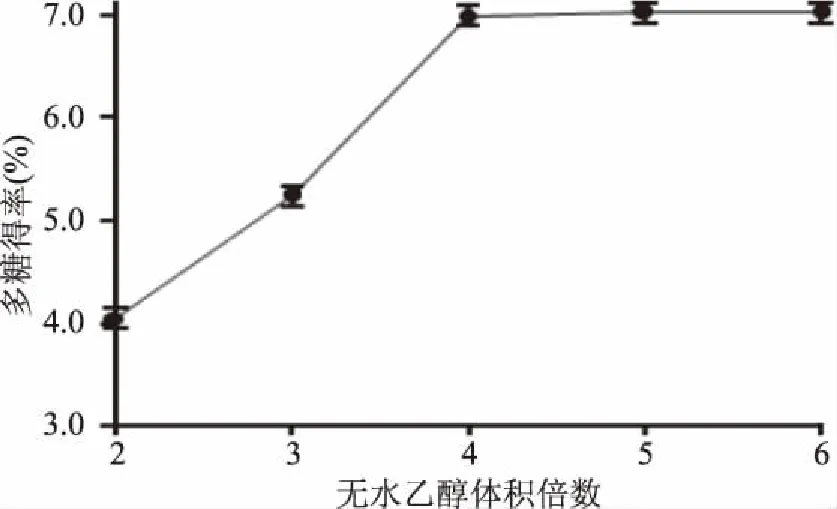
图2 乙醇体积倍数对醇沉过程的多糖得率的影响Fig.2 Effect of different ethanol volume multiple on the yield of polysaccharide in alcohol precipitation process
2.1.3 醇沉时间对多糖得率的影响 醇沉时间对多糖醇沉过程影响极为重要,由于醇沉过程过长是醇沉法的一大弊端,也是影响醇沉效率的重要原因。优化醇沉时间将大大提升醇沉效率。
醇沉时间是影响多糖得率的另一个重要因素。当醇沉时间较短时,醇沉不彻底,多糖得率较低,延长醇沉时间可提升多糖得率[11]。图3可以看出,随着醇沉时间的增加,多糖得率有所提高;当超过12 h时,多糖得率基本稳定为7.00%。这表明,添加无机盐后醇沉过程在12 h基本趋于平衡,因此醇沉时间选择为12 h。
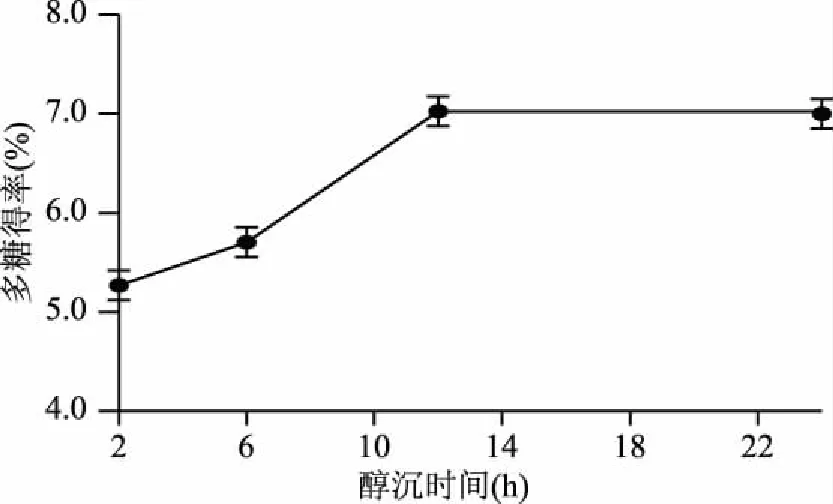
图3 醇沉时间对醇沉过程的多糖得率的影响Fig.3 Effect of alcohol precipitation time on the yield of polysaccharide in alcohol precipitation process
2.2 正交试验结果
由表2可知,不同处理条件对多糖提取得率的影响为:醇沉时间>乙醇体积倍数>Na2SO4浓度,说明醇沉时间对多糖得率的影响最为重要。同时,通过正交试验得到多糖醇沉最佳处理体系为A1B2C3,即Na2SO4浓度为2.0%,醇沉时间12 h,加入无水乙醇体积为5倍。在该条件下进行多次验证试验,多糖得率为7.2%±0.12%,而相同提取条件下不添加Na2SO4多糖得率仅有2.54%,说明该条件能够有效提高多糖得率。

表2 正交试验设计及结果Table 2 Design and results of orthogonal test
2.3 红外表征
花楸叶多糖冷冻干燥后得到浅褐色粉末,将粉末采用KBr压片法制作红外光谱,多糖的结构特征可以通过FT-IR光谱鉴定。IR图谱显示,在3420 cm-1附近的吸收峰是糖类分子间或分子内的O-H键伸缩振动,2928 cm-1附近的吸收峰为烷基的C-H键伸缩振动,这两组峰均属于多糖的特征吸收峰[20],四种花楸多糖均出现了典型的多糖特征峰,且各红外光谱很相似,说明四种多糖的碳链骨架基本一致[21]。在光谱图中,四种多糖均在3400 cm-1附近出现了较宽的吸收峰,是O-H伸缩振动的结果,表明多糖分子内和多糖分子间均存在氢键。在2930 cm-1附近的吸收峰为C-H的振动。1724 cm-1的吸收峰处为酯键羰基(-COOR)形成的伸缩振动,1612 cm-1附近为羧基的羰基C=O伸缩振动,1400~1200 cm-1处的吸收峰为C-H的变形振动,这些特征吸收峰均表明样品为多聚糖组分,根据文献初步判断为低酯多糖[22]。1417 cm-1的峰是C-H变角振动峰。在1017 cm-1的吸收峰是糖苷键C-O-C非对称伸缩振动,说明了多糖中都存在吡喃环构象。在895 cm-1处的吸收峰表明多糖中存在β-构型糖[20]。1530 cm-1附近处出现的峰是N-H变角振动的信号,表明这四种多糖的红外光谱图还具有酰胺结构的特征吸收峰,由此推断透析得到的四种多糖很可能为氨基多糖[20];四种糖在1450~1200 cm-1之间出现的一些不太尖的峰是羧基伸缩振动引起的,是糖类化合物的特征峰;1073 cm-1附近处出现的强吸收峰是由C-O形成的伸缩振动区,该吸收峰是C-OH和吡喃环上的醚键C-O-C特征吸收峰,说明四种组分中都存在吡喃糖苷键;在916和785 cm-1处出现的微弱吸收峰表明β-型糖苷键的存在,表明多糖是吡喃型多糖[20]。
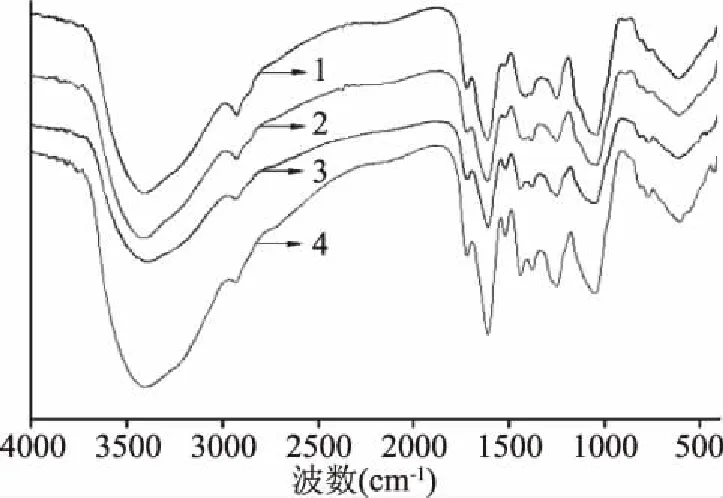
图4 不同醇沉条件下的多糖红外光谱图Fig.4 Infrared spectra of polysaccharides under different alcohol precipitation conditions 注:1:过5000分子量膜多糖;2:加Na2SO4过5000 分子量膜多糖;3:过10000分子量膜多糖; 4:加Na2SO4过10000分子量膜多糖。
2.4 抗氧化活性
2.4.1 总抗氧化性 Fe3+-TPTZ可被样品中的多糖还原成Fe2+的形式,溶液颜色由无色变为浅蓝色,在593 nm波长处有最大吸收,根据吸光值的大小可以计算出样品的总抗氧化活性[23]。由图5可知,在一定的浓度范围内,多糖溶液的活性与VC相近,说明花楸多糖具有较好的抗氧化性,其抗氧化能力的不同与多糖的单糖组成、分子质量分布和结构等多种因素有关[20]。这说明醇沉中加入无机盐后,所提多糖并没有失去抗氧化活性。
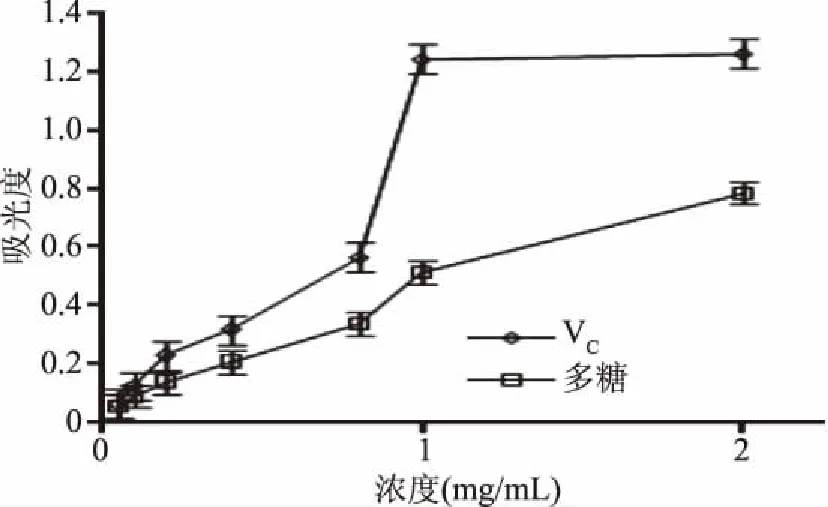
图5 多糖的总抗氧化能力Fig.5 Total antioxidant capacity of polysaccharides
2.4.2 DPPH自由基清除活性 DPPH自由基是一种稳定的自由基,甲醇溶液显紫色,自由基清除剂能够与DPPH的单电子被配对,在最大吸收波长处颜色变浅,吸光度也随之变小[24]。DPPH自由基清除率越高,说明其抗氧化能力越大,以VC为对照,其抗氧化性如图6所示。多糖浓度与DPPH自由基清除率基本呈线性关系,当多糖浓度到达2.0 mg/mL时,其DPPH自由基清除率达到了72.87%,这与文献中报道的同浓度黄秋葵花多糖的DPPH自由基清除能力相似[22]。这说明醇沉加入无机盐后,所提多糖具有较好的DPPH自由基清除能力。
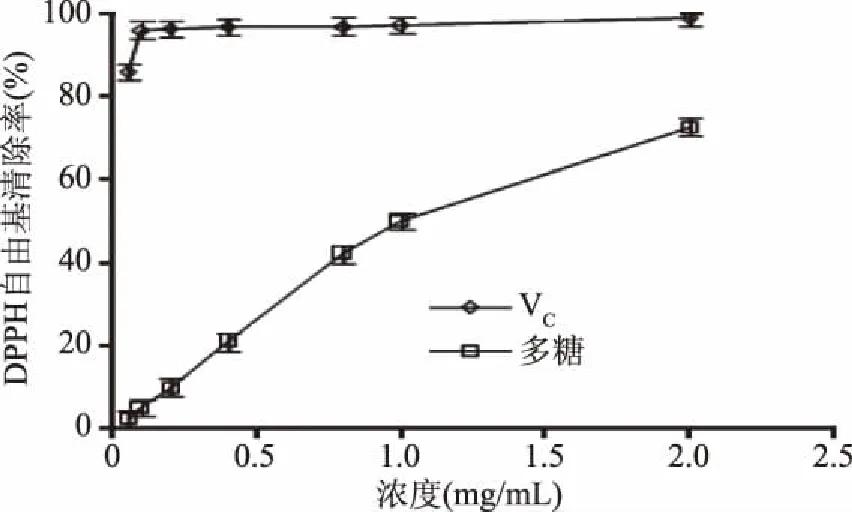
图6 多糖的DPPH自由基清除能力Fig.6 DPPH free radical scavenging ability of polysaccharide
2.4.3 羟自由基清除活性 羟基自由基的清除率能力也是多糖的抗氧化活性指标之一。由图7可以看出,随着多糖浓度的增加,其羟自由基清除率也随之增高,当加入无机盐的醇沉多糖浓度到达2 mg/mL时,其羟基自由基清除率达到了68.39%。与文献报道的藜麦叶片多糖相比,花楸叶所提多糖的羟自由基清除能力较低[7,25],但这一结果仍能表明所提花楸叶多糖具有一定的抗氧化活性。
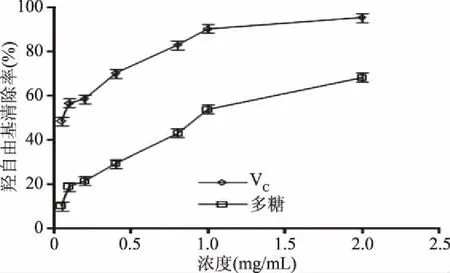
图7 多糖的羟自由基清除能力Fig.7 Hydroxyl radical scavenging ability of polysaccharid
3 结论
利用超声复合无机盐提取的方法从湖北花楸叶中提取多糖,通过正交试验的方法获得最优工艺为:Na2SO4浓度为2.0%,醇沉时间为12 h,加入无水乙醇体积倍数为5倍。在该条件下进行多次验证试验,多糖得率为7.2%±0.12%,而不添加无机盐的多糖得率2.54%,这说明添加无机盐可以有效提高醇沉过程中的多糖得率。红外光谱显示,将提取的多糖经过不同分子量半透膜进行纯化后,无机盐的添加并没有破坏多糖结构。且抗氧化活性实验也表明,其抗氧化活性依旧很高。这种方法作为一种高效的醇沉方法,可以广泛用于从植物材料中提取多糖,有较大的应用前景。
