原发性牙齿萌出障碍1例及文献复习
2019-03-27赵增波王惠敏陈志宇孟祥杰吕炳建
赵增波 王惠敏 陈志宇 孟祥杰 吕炳建
牙齿萌出是牙冠向咬合面移动的过程,涉及多因素(牙囊、破骨细胞及相关信号等)的相互作用,某一因素出现异常都可能会引起牙齿萌出异常[1,2]。原发性牙齿萌出障碍(primary failure of eruption,PFE)定义为部分牙齿萌出障碍,在临床上是找不到明确的局部或全身因素的,而是由牙齿萌出机制本身出现了异常,称为原发性牙齿萌出障碍[3]。PFE是一种罕见疾病,是由牙齿本身萌出机制异常所引起的。临床检查没有明确的病因,经常涉及某一个或某几个象限,正畸牵引效果较差[4]。由于该病病因不明,临床诊断比较困难,尤其应与机械性牙齿萌出障碍(mechanical failure of eruption,MFE)的诊断相鉴别。MFE 是由于邻近牙或多生牙、牙槽骨黏连、增生组织等机械原因导致的牙齿萌出障碍,多为单颗牙受累,正畸牵引效果较好[5]。本文就本院治疗的1例PFE患者病例报道如下,并结合文献复习。
一、病例报道
患儿,男,10 岁,患儿1年前下前牙萌出乳牙未替换,曾于当地医院拔除滞留乳牙,后其余牙齿未萌出迹象,影响进食,来我院就诊。身体发育未见其他异常。既往史:足月,顺产,否认系统性及全身性疾病史。全身健康情况良好,学习,运动能力正常。家族史:父母,妹妹乳恒牙替换未见明显异常,身体发育未见异常,大伯有牙齿萌出障碍,具体情况不祥。否认系统性及遗传性疾病史。专科检查发现51,52,53,54,55,61,62,63,64,31,72,73,74,75,4 1,82,83,84 正常;65,85,16,26,36,46 未萌出(图1)。影像学检测显示65,85,16,26,36,46 埋伏牙;11,12,13,14,15,17,21,22,23,24,25,27,32,33,3 4,35,37,42,43,44,45,47 牙胚存,85,45 牙囊重叠影像(图2)。临床诊断:原发性牙齿萌出障碍(PFE)。

图1 初诊时口内照
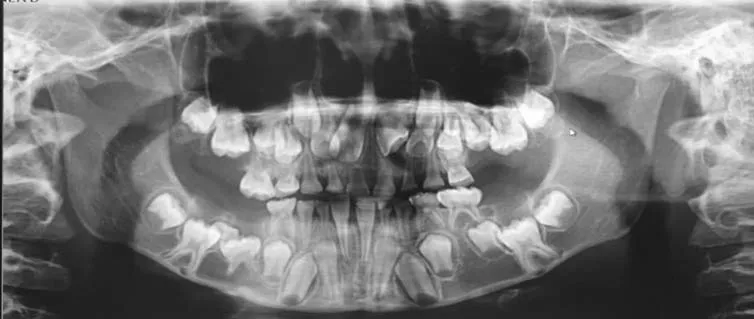
图2 曲面断层片
二、讨论
1.牙齿萌出机制
牙齿萌出的过程,需要在牙囊、牙胚细胞、破骨细胞、成骨细胞及其一系列的相关分子信号精确协调下完成,某一因素出现问题,都可能引起牙齿萌出过程出现异常[1]。牙齿萌出通道主要是牙胚的生成发育促使牙槽骨吸收所形成的,受巨噬细胞合成和分泌出的多种细胞因子影响,破骨细胞发挥作用促使乳牙牙根生理性吸收,从而引起继承恒牙的萌出。
有学者研究[6~9]发现巨噬细胞会分泌产生甲状旁腺素相关蛋白(PTHrP)、激活相应受体促进骨吸收,小鼠牙齿萌出;而将小鼠的PTHrP 基因敲除,小鼠牙齿萌出障碍,表明PTHrP 会调节牙齿萌出。还有学者研究发现,细胞因子也会对牙齿萌出产生影响,细胞因子可以使破骨细胞体积变大,当破骨细胞体积变大时,增强了骨吸收功能,给予小鼠破骨细胞抑制剂后,其牙齿萌出延迟。
关于牙齿萌出动力方面,研究证实[10~12]是由牙周纤维改建和牙周膜血液流体力学提供,牙周膜纤维的成熟改建导致牙齿破龈后的萌出。许多不明原因牙齿萌出障碍多与牙周膜异常有关。
2.PFE的临床表现
1981年Proffit 认为[3]这种不明原因的牙齿萌出障碍,应该是牙齿本身萌出机制,与以往认为的牙根和牙槽骨黏连的理论不同,并将此类疾病命名为“Primary failure of eruption(PFE)”,临床表现概括为以下几点:①常累及恒牙的后牙,以第一恒磨牙最常见,可表现为严重的后牙开合,恒前磨牙和恒尖牙也可受累,恒切牙则极少累及,偶见于乳牙列,萌出程度无规律。②患牙可完全未萌,也可部分萌出。③正畸牵引通常对患牙无效且易导致患牙固连。④可单侧或双侧同时发生,但通常不对称,以单侧居多,无明显的全身系统疾病。⑤PFE具有家族聚集性,具有家族史的病例所占比例为26%~45%。通过对PFE家系进行系谱分析后发现:PFE系常染色体显性遗传,有完全外显率,但表现度可不一。⑥对于散发病例,可用家族史采集不完全和基因突变来解释。
有些学者[5,13,14]根据PFE发病时间,将其分为2型:根据患牙发生萌出障碍的时间,可以将PFE分为2 型。第1 型:在某一时间点患牙同时停止萌出,开合情况,越向远中越重;第2 型:不同患牙萌出障碍的时间可不一致,开合情况不一致。
3.PFE发病机制
发病机制一直以来对牙齿萌出机制的研究从未停止,也存在众多学说,至今未有定论,对PFE疾病的发病机制也未有全面的认识。早期Proffit 等[3]研究发现PFE可能与牙周膜血运异常有关。近年来从分子生物学基因角度研究发现PFE的致病基因可能是编码甲状旁腺激素受体1(parathyroidhormone receptor 1,PTH1R),其与甲状旁腺相关蛋白(parathyroid hormone-related peptide,PTHrP 或PTHLH)和甲状旁腺素(parathyroid hormone,PTH)相结合,发挥作用[7~9],如若PTH1R 基因发生突变,可能会打破成骨和破骨作用之间的平衡,引起PFE疾病的发生。
Frazier-Bowers 等[15]研究发现PFE患者都携带突变的PTH1R 基因,进一步证实了PFE与PTH1R基因的关系。Frazier-Bowers 等[16]还研究认为PFE是一种显性遗传病,发现PFE患者在编码区会发生两个显性突变,其他突变则发生在非功能区域。同时,还发现PTH1R 基因突变患者不仅患有PFE,还伴有骨关节炎,认为PFE和骨关节炎存在某种关联。
目前为止PFE的发生与PTH1R 基因的联系和发生的机制仍需要我们探索研究。
4.PFE诊断及鉴别诊断
因涉及临床治疗等问题,故PFE的早期正确诊断比较重要。Stellzig-Eisenhauer 等[16]定义的诊断标准为:①正常萌出时间期间未萌出,单颗牙或多颗牙部分萌出或完全未萌,无固连或其他萌出障碍的征象;②患牙冠方有正常骨吸收形成的萌出道;③患牙远中的牙齿全部受累;④后牙开牙合;⑤正畸牵引无效。
和PFE比较容易混淆的是MFE,MFE 一般只影响单颗牙,其冠方无正常骨吸收通道,由于邻近牙或多生牙、牙槽骨黏连、增生组织等机械原因导致的牙齿萌出障碍,正畸牵引效果较好[17]。临床遇到牙齿萌出障碍患者,需根据累及牙齿数和影像学资料详细鉴别诊断。
PFE致病基因PTH1R 基因的发现,为PFE的鉴别诊断提供了新思路。但PFE的诊断仍缺少一个金标准,这也是有待我们继续探索研究的。
5.PFE治疗原则及预后
PFE的治疗非常困难。正畸牵引对于PFE患牙是无效的,且经常会引起牙齿固连。可以使用高嵌体或全冠对部分萌出的患牙进行修复。对于无法采用冠修复的患者,可以考虑拔除PFE的患牙,采取种植修复的方法。种植修复条件不满足的情况下,只能考虑可摘局部义齿修复。曾报道[18~20]使用颌骨牵引成骨技术治疗后牙开合的患者,也可以为PFE患者提供一种新的治疗思路。PFE患者的治疗较复杂,需要口腔多科室的共同协作。
