蜕皮甾酮抑制肿瘤坏死因子α诱导的HaCaT细胞的炎症因子的产生
2019-03-27胡惠清李静方坤卢彩红吕保先龙剑文
胡惠清 ,李静 ,方坤 ,卢彩红 ,吕保先 ,龙剑文
(1.武汉市第九医院,湖北武汉438000;2.湖北中医药大学第一临床学院,湖北武汉430061)
在皮炎,湿疹炎症性皮肤病中,炎症细胞的迁移受趋化因子调节。这些由各种类型细胞释放的信号分子,能够调节免疫炎症细胞的游走到炎症部位,参与炎症的发生和发展[1]。其中,胸腺和活化调节趋化因子(TARC)[2]、人巨噬细胞来源的趋化因子(MDC/CCL22)[3]、调节激活正常T-细胞表达分泌因子(RANTES/CCL5)[4]是典型的趋化因子,此外,白细胞介素(IL)-8对中性粒细胞有明显趋化作用[5],研究还表明IL-8还有很强的促血管生成作用[6],上述趋化因子均可表达于角质形成细胞,广泛参与炎症反应,与慢性炎症的严重程度密切相关。
NF-κB是触发炎症反应的一类重要转录因子,可调控多种炎症相关蛋白基因的表达。NF-κB的异常调节与癌症、自身免疫性疾病以及炎症有关[7]。丝裂原活化蛋白激酶(MAPK)通路是一个丝氨酸/苏氨酸特异性蛋白激酶家族,包括c-Jun氨基末端激酶(JNK)、p38蛋白和细胞外调节蛋白激酶(ERK)。MAPKs信号通路在细外信号向胞内传递中起着至关重要的作用,并广泛参与和介导多种刺激引起的炎症反应[8]。因此,NF-κB通路和MAPKs通路通常是抗炎药物的常见靶点。
蜕皮甾酮(Ecdysterone,EDS)是来源于中药牛膝的一类甾酮类分子[9],有抗炎、抗氧化等多种生物学活性[10-11]。以前的研究表明蜕皮甾酮对中波紫外线诱导的HaCaT细胞凋亡,氧化损伤和光老化均具有一定的保护作用[12],但其对皮肤炎症的抑制作用目前还不清楚。本研究通过利用肿瘤坏死因子(TNF)-α刺激人角质形成细胞HaCaT细胞建立的炎症模型,观察了蜕皮甾酮对TNF-α刺激下HaCaT细胞趋化因子和炎症因子表达的影响以及相关的可能机制,现报道如下。
1 材料与方法
1.1 材料 蜕皮甾酮为中国药品生物制品检定所生产,批号111638-201605。HaCaT细胞株购于中国科学院细胞库。细胞核蛋白与细胞浆蛋白抽提试剂盒(上海翊圣生物科技有限公司)。细胞总蛋白抽提试剂盒(北京宝杰罗生物科技有限公司)。CCK-8试剂盒购自武汉博士德生物公司。P65抗体(Abcam)、IκB 抗体(Abcam)、JNK 抗体(Abcam)、p38 抗体(Abcam)、ERK 抗体(Abcam)、p-JNK 抗体(Abcam)、p-p38抗体(Abcam)、p-ERK 抗体(Abcam);辣根酶标记抗兔lgG抗体(Santa cruz);辣根酶标记的βactin抗体(上海兴悠生物科技有限公司);ECL试剂盒(Amersham Biosciences公司)。标记Cy3的抗兔IgG二抗购自武汉博士德生物公司。DAPI购自重庆普立科生物技术有限公司。
1.2 CCK-8法检测蜕皮甾酮对HaCaT细胞增殖活力的影响 HaCaT细胞在96孔板中孵育,调整细胞数为 1×105,加入不同浓度(1.0,1.5,2.0 μmol/L)的蜕皮甾酮共同孵育24 h。后在每个孔中加入CCK-8试剂 10 μL,接着孵育 4 h显色后,测量450 nm处吸光值。以细胞的存活率表示细胞增殖活力。细胞存活率(%)=(测试孔平均吸光度/对照孔平均吸光度)×100。
1.3 ELISA法检测蜕皮甾酮对TNF-α刺激下HaCaT细胞趋化因子产生的影响 HaCaT细胞(1×106细胞/孔)在6孔板中培养,达到融合后,分为4组,正常对照组,TNF-α 组(10 ng/mL),蜕皮甾酮低浓度组(10 ng/mL TNF-α+1.0 μmol/L EDS),蜕皮甾酮中浓度组(10 ng/mL TNF-α+1.5 μmol/L EDS),蜕皮甾酮高浓度组 (10 ng/mL TNF-α+2.0 μmol/L EDS),孵育24 h后,使用ELISA试剂盒测定TARC、MDC、RANTES和 IL-8的产生。
1.4 Western blot检测NF-κ B通路与MAPKs通路相关蛋白的表达 分组和培养同1.3,处理完毕后,用PBS洗涤HaCaT细胞,加入细胞裂解液裂解细胞,在4℃下将细胞裂解液在13 000转/min离心20 min,分别抽提细胞总蛋白,细胞浆蛋白,细胞核蛋白,BCA法蛋白定量。用SDS-PAGE电泳分离总蛋白,并转移到PVDF膜。用5%脱脂牛奶封闭膜,加入一抗孵育。在4℃过夜。在室温下加入二抗孵育1 h,洗膜后用增强化学发光试剂盒检测。结果扫描后,用图像分析软件进行光密度分析,以β-actin为内参校正。
1.5 免疫荧光检测 在室温下用4%多聚甲醛固定细胞20 min,然后用0.5%的Triton X-100破膜30 min,并用5%牛血清白蛋白(BSA)常温封闭1 h。然后,在 4 ℃下,用 NF-κB p65(1∶250)的一抗孵育细胞。洗涤后,加入标记Cy3的二抗(1∶1 000),孵育1 h,然后在 37℃暗室中用 DAPI(5 g/L PBS)染色20 min。使用荧光显微镜拍摄图像。
2 结果
2.1 蜕皮甾酮对HaCaT细胞增殖的影响 CCK-8实验结果表明,不同浓度的蜕皮甾酮对HaCaT细胞增殖活力无明显影响。正常对照组HaCaT胞存活率为 98.93%±0.74%;1.0、1.5、2.0 μmol/L 蜕皮甾酮组分别为 97.59%±1.41%、98.21%±1.51%、97.86%±1.42%。4组存活率差异无统计学意义(F=1.180,P=0.342)。
2.2 蜕皮甾酮对TNF-α刺激后HaCaT细胞上清中TARC、MDC、RANTES和IL-8水平的影响 蜕皮甾酮显著抑制了TNF-α刺激后HaCaT细胞上清中TARC、MDC、RANTES和 IL-8的表达(F=82.979,F=308.305,F=185.169,F=163.729;P<0.01)。与正常对照组比较,TNF-α组HaCaT细胞上清中TARC水平明显上升(q=23.605,P<0.05)。与 TNF-α 组比较,1.0、1.5、2.0 μmol/L 蜕皮甾酮剂量组 HaCaT 细胞上清中TARC的表达逐渐下降,且3组组间比较差异有统计学意义 (q=12.663,q=15.360,q=20.390,P<0.01)。与正常对照组比较,TNF-α组HaCaT细胞上清中 MDC 水平明显上升(q=42.315,P<0.05)。与TNF-α 组比较,1.0、1.5、2.0 μmol/L 蜕皮甾酮剂量组HaCaT细胞上清中MDC的表达逐渐下降,且3组组间比较差异有统计学意义(q=12.961,q=21.210,q=38.083,P<0.01)。与正常对照组比较,TNF-α 组HaCaT细胞上清中RANTES水平明显上升(q=31.951,P<0.01)。与 TNF-α 组比较,1.0、1.5、2.0 μmol/L蜕皮甾酮剂量组HaCaT细胞上清中RANTES的表达逐渐下降,且3组组间比较差异有统计学意义(q=6.893,q=15.195,q=28.150,P<0.01)。与正常对照组比较,TNF-α组HaCaT细胞上清中IL-8水平明显上升(q=32.558,P<0.01)。与 TNF-α组比较,1.0、1.5、2.0 μmol/L 蜕皮甾酮剂量组 HaCaT细胞上清中IL-8的表达逐渐下降,且3组组间比较差异有统计学意义(q=8.508,q=14.549,q=24.157,P<0.01)。见图 1。
2.3 蜕皮甾酮抑制了TNF-α刺激后HaCaT细胞NF-κB通路的活化 与正常对照组比较,TNF-α组HaCaT细胞胞浆中IκBα水平明显下降(q=31.000,P<0.01),而核内 p65 水平明显上升(q=30.081,P<0.01)。提示TNF-α能促进HaCaT细胞NF-κ B通路的活化。与 TNF-α 组比较,经过 1.0、1.5、2.0 μmol/L 蜕皮甾酮处理后,TNF-α刺激后HaCaT细胞胞浆中IκBα 水平逐渐提高(q=6.741,q=15.423,q=23.033,P<0.05),而核内 p65水平明显下降(q=7.859,q=13.595,q=22.944,P<0.01)。而且免疫荧光检测显示,TNF-α刺激后HaCaT细胞NF-κB p65在核内的聚集显著增强,而经过2.0 μmol/L蜕皮甾酮处理后,NF-κB p65在核内的聚集明显降低。见图2、3。
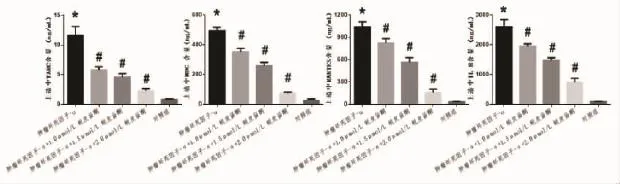
图1 蜕皮甾酮显著抑制了TNF-α刺激后HaCaT细胞上清中TARC、MDC、RANTES和IL-8的产生

图2 蜕皮甾酮上调了TNF-α刺激后HaCaT细胞胞浆中IκBα的水平,下调了胞核内p65的水平
2.4 蜕皮甾酮抑制了TNF-α刺激后HaCaT细胞MAPKs通路的活化 Western blot实验表明,与正常对照组比较,TNF-α组HaCaT细胞MAPKs通路中 p38(q=45.878,p<0.01),ERK(q=53.443,P<0.01),JNK(q=34.116,P<0.01)的磷酸化显著增强。与 TNF-α组比较,1.0、1.5、2.0 μmol/L 蜕皮甾酮显著抑制了TNF-α刺激后HaCaT细胞MAPKs通路中p38(q=8.932,q=26.258,q=38.118,P<0.01),ERK(q=14.056,q=30.651,q=46.952,P<0.01),JNK(q=5.857,q=12.543,q=30.602,P<0.01)的磷酸化,见图 4。
3 讨论
如何有效地处理炎症性皮肤疾患是皮肤医师需要面对的首要临床问题。目前糖皮质激素是处理以上问题的主要手段和方法。尽管糖皮质激素在抑制炎症反应方面表现出了卓越的疗效,但其不良反应也是有目共睹的。中药牛膝在防治慢性炎症性皮肤病方面有显著疗效并得到广泛使用,但其作用机制还需要进一步研究。笔者以前的研究表明牛膝的活性成分蜕皮甾酮对中波紫外线诱导的角质形成细胞的氧化损伤有明显的保护作用。本研究进一步探讨了蜕皮甾酮对角质形成细胞的抗炎作用。
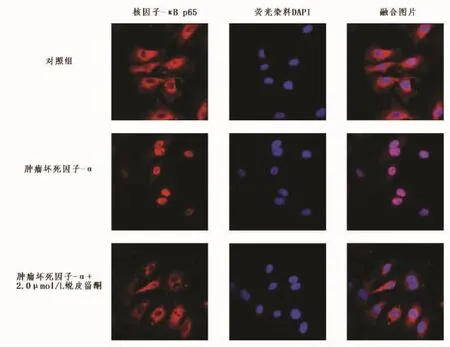
图3 蜕皮甾酮抑制了TNF-α刺激后HaCaT细胞NF-κB p65的核转位

图4 蜕皮甾酮显著抑制了TNF-α刺激后HaCaT细胞p38,ERK,JNK的磷酸化
在炎症性皮肤疾患中,角质形成细胞能产生各种趋化因子,参与炎症性疾病的发生与发展。TARC和MDC由树突状细胞、内皮细胞和角质形成细胞产生,其结合并吸引CCR4+Th2细胞进入炎性组织[13]。多项研究表明特应性皮炎患者血清中TARC和MDC水平较高[14]。且特应性皮炎的严重程度与这些趋化因子水平显著相关[15]。RANTES在银屑病患者的角质形成细胞中过表达,在银屑病的炎症过程中也有重要作用[16]。研究也证实特应性皮炎患者血清中IL-8的水平显著高于正常人,而且IL-8的水平与EASI评分呈正相关关系[17]。在这里,笔者发现蜕皮甾酮明显抑制了TNF-α刺激后HaCaT细胞TARC,MDC,RANTES,IL-8 的产生。
现代研究表明NF-κB可能参与炎症介质中炎症介质和细胞因子的转录调控。在未刺激的细胞中,NF-κB 在细胞质,且入核定位信号被 IκBs(κB抑制剂)抑制。当刺激因子激活细胞时,IκBs被降解,NF-κB转入细胞核,特异性结合靶向DNA元件,激活编码炎症蛋白和因子的基因转录。NF-κB信号通路的抑制可以解释蜕皮甾酮作为炎性反应抑制因子的活性。既往研究表明,蜕皮甾酮能显著抑制H2O2处理后人晶状体上皮细胞核因子κB p65表达[18]。本研究表明,蜕皮甾酮能抑制TNF-α刺激后HaCaT细胞NF-κB p65从细胞质向细胞核的转位,抑制了NF-κB通路的活化。除了NF-κB途径外,越来越多的证据表明MAPKs可能在介导炎症刺激的重要生物学过程和细胞反应中起着至关重要的作用。MAPK信号通路也被认为是潜在的抗炎药物研究的关键分子靶点。既往研究表明,蜕皮甾酮通过抑制p38 MAPK-p53信号通路线粒体依赖机抑制了SH-SY5Y细胞对6-羟基多巴胺诱导的细胞凋亡[19]。此外,蜕皮甾酮可能通过抑制ERK/MAPK信号通路减轻了H2O2对HLEC造成氧化损伤[20]。本研究探讨了蜕皮甾酮对TNF-α诱导的HaCaT细胞JNK、ERK和p38磷酸化水平的抑制作用。根据笔者的研究,蜕皮甾酮能也显著抑制三种MAPKs的磷酸化水平。因此,蜕皮甾酮能抑制TNF-α刺激后HaCaT细胞炎症因子的产生可能与抑制NF-κB通路和MAPK信号通路的活化有关。
综上所述,蜕皮甾酮可能通过调节NF-κB通路和MAPK通路的活化,进而抑制角质形成细胞炎症因子的产生。本研究为蜕皮甾酮应用于炎症性皮肤病提供了一定的依据。
