一种新型PET水解酶的结构与催化机制研究进展
2019-03-26靳玉瑞李爱秀
靳玉瑞,李爱秀,张 力
(中国人民武装警察部队后勤学院基础部数理教研室,天津 300309)
0 前言
PET是一种被广泛应用的高分子芳香族聚酯,由取自原油的对苯二甲酸(TPA)和乙二醇(EG)这2种单体通过酯键相连构成[1]。PET具有优良的综合性能,如质轻、强度大、耐高低温、耐化学腐蚀、绝缘性好、透明度高等,其产品包括纤维级PET和非纤维级PET(如瓶类、薄膜和工程塑料等),前者被应用于纺织业等,后者主要被应用于包装、电子电气、建筑、汽车等领域,其中包装是PET最大的非纤应用市场,也是增速最快的领域。PET可单独作为软包装材料,目前大部分瓶装水、软饮料都使用PET进行灌装;PET还能与铝、氧化硅或纳米材料等复合以改善强度、阻隔性或微波透过性等,使其在食品、药品、化妆品和日用化学品包装等领域,得到更广泛的应用。除民用以外,以PET为基材研制的多功能复合材料,还可用于军用装备元件的制造以及军工产品的包装等,如PET复合材料被用于火工品、引信、火炸药等的内包装,以及武器装备尤其是大型、复杂武器装备系统的封套包装[2-4]。PET改性材料,因具有防静电、防电磁、阻燃和高阻隔等功能,能有效保护军工产品在储存和运输中的性能和安全。
2010年,我国 的PET 产量已达 29 000 kt,成为世界上最大的 PET 生产国和消费国。调查表明,PET 的消费量增长迅速,与此同时也产生了大量的 PET废弃物,特别是PET包装材料在使用后几乎都成为废料。PET作为一种芳香族聚酯,化学惰性强,且生物难降解,其废弃物的积累给环境和生态带来了严峻的压力[5-6]。部队在执行抢险救灾、海上维权等任务时,通常要携带大量物资前行,包括包装食品、饮用水及武器装备等,因此也将产生大量的PET废弃物。如何经济环保地处理这些PET废料,是军地都急需解决的问题,故需要集合各方的技术和资源优势,通过深入融合共同探索解决方案。
近年来,生物降解法因兼具经济效益和环境友好性,利用此类方法处理塑料废弃物成为一个重要的研究方向[7-8]。目前已发现一些能够降解PET的生物酶(如角质酶和脂肪酶等),但这些酶并非以PET为主要底物,且酶降解效率尚不能达到工业化的要求。2016年,Yoshida等[9]发现了一种将PET作为主要能量和碳源的细菌Ideonellasakaiensis201-F6,并分离到对PET降解起关键作用的水解酶PETase。该酶是目前对PET降解活性和底物专属性最强的酶,这引起研究者们的极大兴趣。在对PETase的研究中,解析其突出的PET降解活性需基于对其结构和催化机制的深刻理解。本文主要介绍了PETase的降解活性及相关影响因素,对PETase的晶体结构信息、底物结合模式和催化降解机制进行了总结,重点阐述了该酶发挥突出降解活性的关键结构特征,并对PETase生物降解的研究方向进行了展望。
1 PET的处理
目前对PET废弃物的处理方法有填埋、焚烧和回收利用等。焚烧法是通过专用的焚烧炉烧掉废旧塑料,在此过程中可回收热能,但能量利用率较低,且会产生大量有毒物质。填埋法是将废旧塑料集中用土掩埋,该方法简单易行,但长期不能降解的塑料将成为永久垃圾,不仅占用土地资源,还会进一步污染土壤、地下水等[10]。相比传统的填埋和焚烧,回收利用更加科学有效,能兼顾资源的循环利用和避免环境污染。利用机械加工进行物理回收要求废弃物所含的杂质较少,且加工过程易造成制品的性能降低,一般只能降级使用[11]。化学回收则是将PET解聚成对苯二甲酸二甲酯、TPA、和EG等,使其重新用于高品质化学品的合成,具有较好的经济效益。由于PET仅在非常强烈的化学条件(如强酸、高温等) 下被降解再利用[12],该方法对设备有很高的要求,同时会产生大量的废水,这增加了处理成本,也阻碍了化学回收法的发展。
鉴于环境和资源的友好性,生物降解法处理塑料受到越来越多的关注。近年来研究者发现了一些具有PET水解活性的角质酶(cutinase)[13-14]、脂肪酶(lipase)[15-16]和酯酶(esterase)[17-18]等,其中以角质酶最有潜力,该类酶不仅降解活性更高,且没有“帽子”结构而不像脂肪酶那样需要脂水界面激活[19]。虽然生物降解的应用前景很好,但已发现的PET水解酶活性太低,尽管采用了多种策略去增强酶的活性,仍无法达到工业化的要求。2016年,Yoshida等[9]从I.sakaiensis中分离出一种特殊的PET水解酶PETase,该酶与具有PET水解活性的角质酶有很高的序列相似性(约50 %),但它对PET的水解活性和选择性均明显高于其他PET水解酶。PETase的发现,是PET生物降解研究中的突破性进展,对PETase结构和机制的阐明将为PET乃至其他塑料的降解提供重要线索。
2 PETase的降解活性及相关影响因素
Yoshida等[9]发现I.sakaiensis能够吸附于PET薄膜的表面,其分泌的PETase能将PET降解为主产物对苯二甲酸乙二醇酯单体(MHET)、次产物对苯二甲酸二乙二醇酯(BHET)和TPA,也可将BHET降解为MHET,PET及其产物的分子结构式如图1所示。将PETase与其进化分枝上的3种PET水解酶(来自嗜热放线菌的水解酶TfH[20]、来自枝叶堆肥元基因组的角质酶同系物LCC[21]和来自腐皮镰刀菌的角质酶FsC[22])进行PET水解活性的比较,发现PETase与其他PET水解酶在底物的选择性和水解活性上存在差异。在30 ℃,pH=7条件下,PETase对PET薄膜的水解活性分别是TfH、LCC和FsC的120、5.5和88倍,但对脂肪酶和角质酶的优选底物对硝基苯酯的水解活性显著低于TfH、LCC和FsC。尽管致密的高结晶度PET能显著弱化酯键的酶解[23],PETase对取自塑料瓶的高结晶度PET的活性也明显高于TfH、LCC和FsC。PETase几乎无法降解萘基酯,对该类物质的降解活性约为对硝基苯酯类的百万分之一。但在PETase中分别引入S64M、W130F和N212F突变后,该酶对萘基酯表现出降解活性,其中以W130F突变酶的活性提高最为明显。这可能因为突变型PETase的催化中心疏水性增加,且立体阻碍降低,使体积更大的疏水性萘基能顺利进入酶的催化域凹槽中。Austin等[24]发现PETase对PET的生物基替代物2,5-呋喃二甲酸乙二醇酯(PEF)具有活性,但对脂肪族聚酯类的聚乳酸和聚丁二酸丁二醇酯均无活性。因此推测PETase主要是一种芳香族聚酯酶,并且可能对多种芳香族聚酯具有水解活性。
PETase具有一定的热不稳定性,其最适温度范围是25~35 ℃,在55 ℃时几乎没有活性,通过硫酸铵沉淀和戊二醛交联法固定PETase后,酶的活性比溶液条件下有所下降,但其热稳定性增强,最适温度范围扩大到25~45 ℃,且在65 ℃时仍保留其最高活性的60 %[25]。可见PETase能在室温时表现出很好的PET薄膜降解活性,而TfH、LCC和FsC的活性最佳温度在50~70 ℃,因此在工业应用中PETase对温度条件的要求可能更低。随着酶浓度的增加,PETase相比TfH、LCC和FsC的活度比下降,表明PETase在低浓度下能更有效地降解PET[9]。
PETase对PET的水解活性还受到溶剂中其他组分的影响,如溶剂中盐浓度在100~500 mmol/L的范围内,PETase的酶活性与盐浓度成正比,中等浓度的甘油(10 %~20 %)能够提高酶的活性,而有机溶剂和洗涤剂(如乙醇、丙醇、吐温20等)会降低酶活性。Furukawa等[26]将低结晶度的PET薄膜提前用阴离子表面活性剂处理1 h,然后加入PETase在30 ℃进行水解反应,发现酶在起初3 h的催化活性比不用阴离子表面活性剂处理的对照组提高了120多倍。这可能是因为PETase自身带正电,经阴离子表面活性剂处理后的PET薄膜带负电,因此酶到达PET表面的量增加,进而降解效率提高。该课题组提出PETase表面阴离子区由位于底物结合口袋一侧的Arg24、Arg61和Lys66构成,该区域对阴离子表面活性剂发挥作用至关重要。此外他们发现,0.023 %的十二烷基磺酸钠(SDS)能显著增加PETase对PET薄膜的降解活性,但Liu等[25]发现0.1 %的SDS能完全抑制PETase降解对硝基苯基丁酯,因此对于表面活性剂的影响还有待深入研究。另外,溶液的pH也会影响PETase活性的发挥,该酶在pH为6~10时有活性,其最适pH范围是7~9,在pH=8时达到最佳活性。
3 PETase的晶体结构
目前蛋白数据库(PDB)中收录的PETase晶体结构仅有14个,有关信息如表1所示。其中PETase与配体的复合物晶体结构仅有2个,即R103G/S131A双突变(DM)型PETase分别与对硝基酚(pNP)和HEMT的复合物晶体结构。PETase原型酶以及DM型PETase-HEMT复合物的晶体结构如图2所示,配体pNP和HEMT的分子结构式如图1所示。
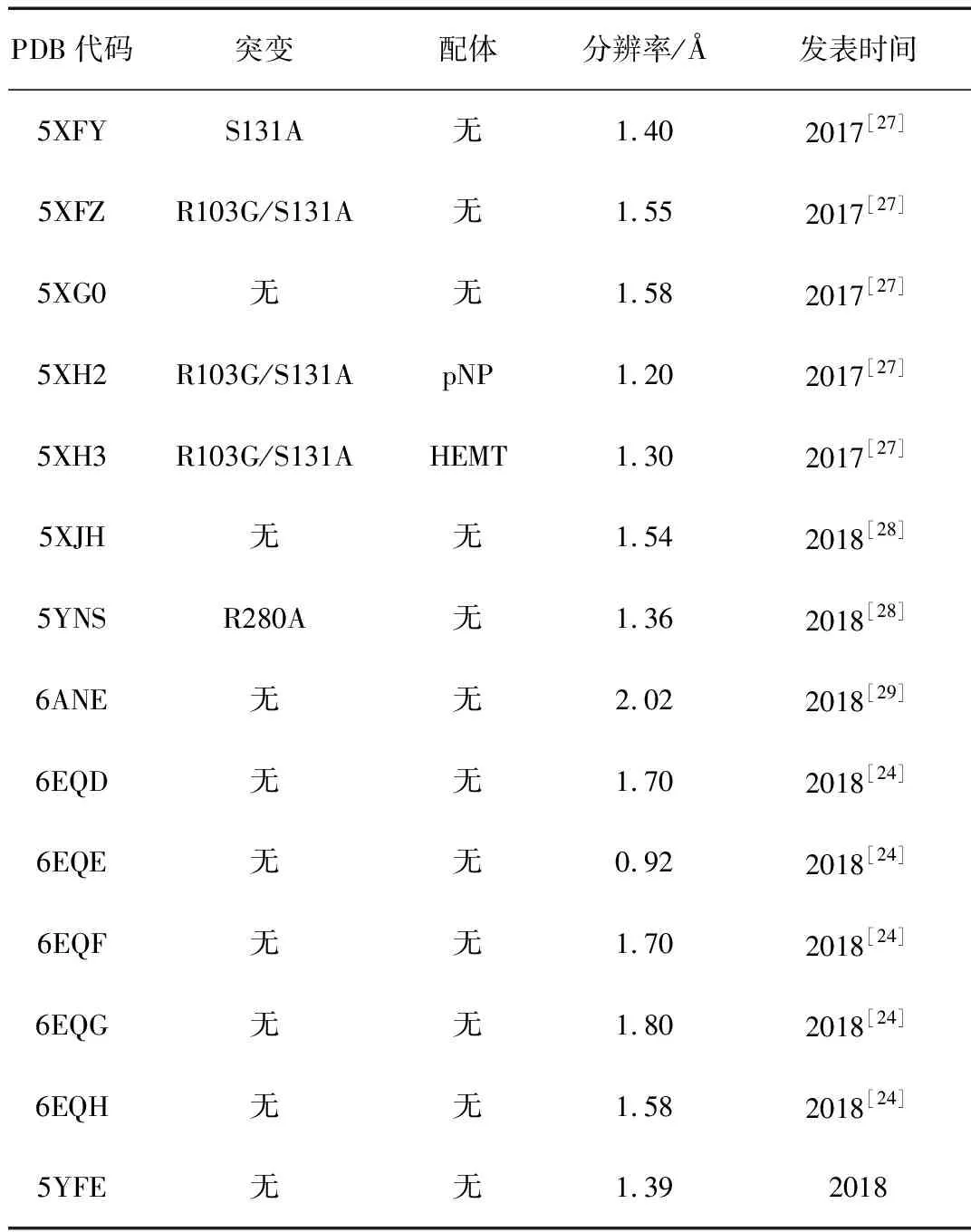
表1 PDB数据库中PETase的晶体结构信息Tab.1 Information of crystal structures of PETase from PDB
在不同的PETase晶体结构[24, 27-29]中,一个非对称单元里曾发现1条或者3条肽链,而排阻色谱实验表明该酶以单体发挥PET水解活性[28]。PETase属于α/β-水解酶超家族,具有典型的ɑ/β-水解酶折叠,结构中心的β-片层(β1~β9)由α-螺旋(α1~α7)所包围。PETase具有在不同PET水解酶之间严格保守的催化三联体Ser131-His208-Asp177。这3个催化残基分别位于β5、β7和β8后的loop环上,其中亲核性Ser131位于高度保守的“亲核肘”(nucleophilic elbow)处,同His208形成氢键并被其诱导极化,而碱性His208则被酸性Asp177所稳定[27-28]。Han等[27]发现催化中心Met132和Tyr58的骨架NH基团形成一个氧阴离子洞,这也是超家族成员酯酶和脂肪酶的共同特征。此外,催化中心附近的Trp156在PETase的3条肽链中分别采取不同构象(“A”“B”和“C”构象),而其他同源酶相应位置的Trp均采取“C”构象,未出现构象“摆动”,这可能是因为PETase的Trp156附近为Ser185,比其他同源酶相应位置的His空间位阻更小,允许Trp156采取多种构象。PETase的表面高度极化,带正电(等电点为9.6);而与其同源性很高的嗜热放线菌角质酶TfCut2[13],其表面散布着酸性和碱性残基,因此更接近于电中性(等电点为6.3)。此外,PETase和TfCut2相比具有更宽的底物结合凹槽,前者凹槽的最宽处约为后者的3倍,该结构对于结晶度较高的芳香族聚酯与活性位点的结合可能是必要的[24]。
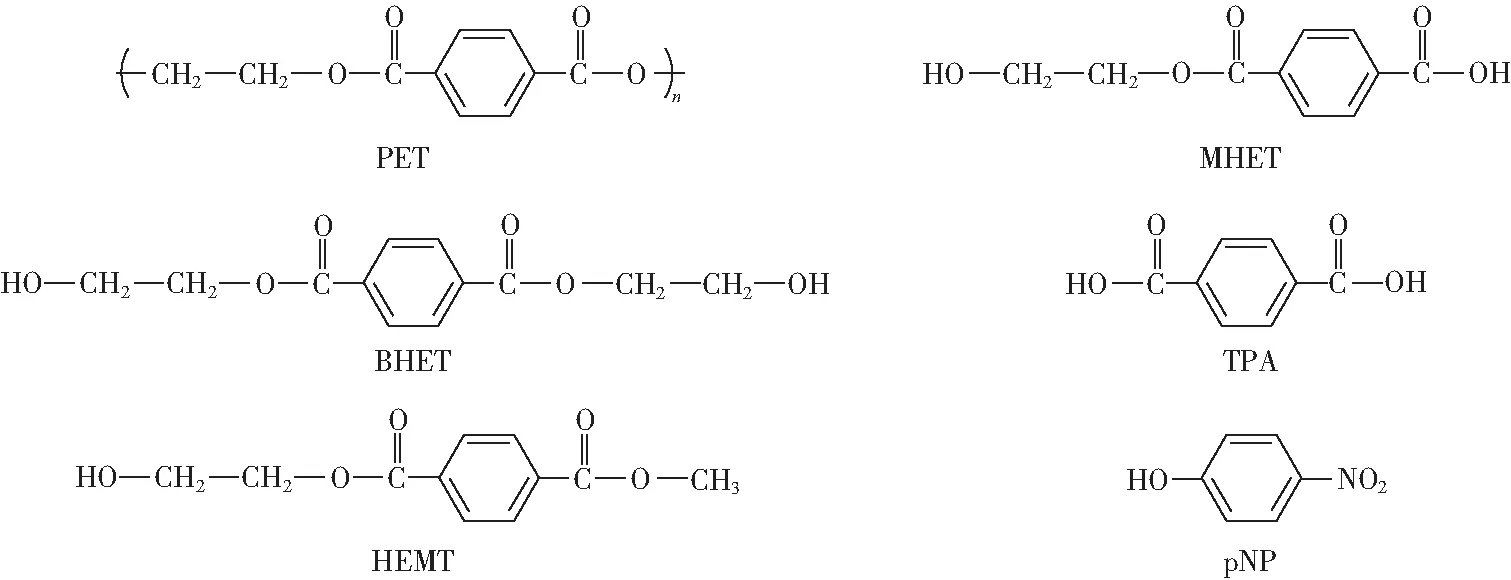
图1 PETase水解反应产物和PETase复合物晶体结构中配体的结构Fig.1 Structures of PETase hydrolysis products and ligands in the crystal complexes of PETase
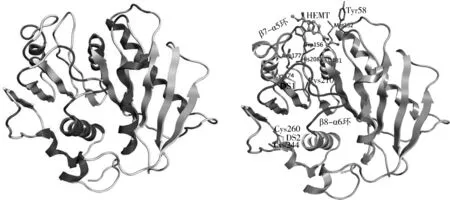
图2 PETase原型酶和DM型PETase-HEMT的晶体结构Fig.2 Crystal structures of apo-form PETase and DM-form PETase-HEMT
目前,研究者还无法得到野生型PETase与配体的复合物晶体,可能是因为PETase的Arg103侧链伸入Ser131附近的狭缝,从而阻碍底物进入结合位点。Han等成功得到含有R103G突变的DM型PETase,以及该酶分别与底物类似物HEMT和产物类似物pNP的复合物晶体结构。将DM型和野生型PETase的晶体结构进行比对,发现突变并未明显改变蛋白的整体折叠(Cα的RMSD=0.144~0.2 Å),因此可利用DM型PETase的复合物晶体结构来推测酶的底物结合模式以及催化机制。此外研究者还测定了多种突变型PETase的晶体结构,如S131A和R280A突变酶等,用以分析定点突变的氨基酸残基是否对酶的底物结合位点及活性产生关键的影响[27-28]。
4 PETase的底物结合模式与催化降解机制
4.1 PETase的底物结合模式
在DM-HEMT和DM-pNP的复合物晶体结构中[27],配体主要以疏水作用结合于PETase表面的浅显凹槽中。HEMT的结合位点包含Ala131、His208、Trp156、Ile179、Trp130、Tyr58和Met132等氨基酸残基,底物一端羰基邻近Ala131,推测其在野生型PETase中会受到Ser131的亲核进攻,同时羰基氧原子指向氧阴离子洞并与之形成氢键,而酯氧原子与His208侧链形成氢键。Trp156采取“B”构象并与底物苯环形成T-型的π-π堆积作用,而其他氨基酸残基则提供疏水作用。pNP与DM型PETase的相互作用残基则明显少于HEMT,只有Trp156、Ile179和Met132与底物形成了疏水作用。有趣的是,pNP和HEMT的位置发生了轻微变化,二者的苯环旋转了约36 °,且pNP的苯环比HEMT远离活性位点约2.3 Å,并与Trp156的吲哚环形成面对面的π-π堆积作用。
Joo等[28]与Han等[27]几乎同时得到了PETase的晶体结构,但前者通过分子对接模拟了一个长底物2-羟乙基四羟乙基对苯二甲酸酯[2-HE(MHET)4]与PETase的结合模式。模拟得到的底物结合口袋是一个长而浅的L型表面凹槽,宽约25~29 Å,长约40 Å,其表面主要呈现疏水性。2-HE(MHET)4中的一个MHET单体结合于亚位点I,其他3个MHET单体分别结合于亚位点II的IIa、IIb和IIc区。其中酶的催化域包含于亚位点I中,该位点与MHET单体的结合模式与Han等[29]得到的HEMT结合模式相似。
4.2 PETase的催化降解机制
基于晶体结构分析、定点突变和分子模拟等技术,研究者初步得到了PETase的催化机制,如图3所示。首先PETase的原酶形式为底物提供了一个可供结合的浅表凹槽,同时催化中心附近的Trp156呈现不同构象。当酶结合PET时,底物中与苯环相连的羰基指向底物结合凹槽的中心,并受到催化三联体的亲核进攻,同时氧阴离子洞使酯键发生极化并稳定反应中间产物,而Trp156采取“B”构象并与PET的TPA基团形成T型π-π堆积作用。接下来的作用机制与经典的角质酶催化机制相同,先形成酰基酶中间体,然后由水分子进行第二次亲核进攻,从而解离酯键。最终得到的苯甲酸基团形成一个大平面,其构象发生旋转从而与Trp156形成面对面的π-π堆积作用,使产物从原来可能较弱的T型π-π堆积作用位点被移走[27]。

图3 PETase的催化降解机制[27]Fig.3 Catalytic mechanism of PETase[27]
5 PETase的关键结构特征
5.1 PETase与其他同源PET水解酶的结构差异
将PETase与其他多个同源的PET水解酶进行蛋白序列比对,发现底物结合位点的氨基酸残基严格保守或者半保守,表明不同PET水解酶具有相似的底物相互作用[27]。但PETase与其他PET水解酶在底物结合位点处还存在细微的差异,这可能是PETase水解活性较高的原因:(1)PETase形成了2个分子内二硫键(DS1和DS2),而其他同源酶只有1个二硫键(DS2)。共同保守的DS2
(cys244-Cys260)连接了酶C末端的α-螺旋和最后一个loop环,因其位于活性位点的反面,推测DS2不会直接影响酶的活性,但会影响其结构的稳定性。PETase专有的DS1
(cys174-Cys210)连接着β7-α5环与β8-α6环,而这两个环分别包含了催化三联体中的Asp177和His208。分子动力学模拟表明,在室温下PETase活性位点的柔性比其他耐热同源酶更大,而这种柔性由DS1控制,DS1的消失将导致催化三联体的不稳定。将DS1连接的2个Cys突变为其他PET水解酶的对应残基Ala后,PETase的热稳定性和活性随着DS1消失均明显下降,因此说明DS1对PETase的热稳定性和活性都有重要意义[27-29]。(2)PETase中的β8-α6环比同源酶TfCut2多出3个残基(Asn215、Ser216和Asn217),该环的延伸促使亚位点II的IIa区与IIb、IIc区相连形成一个长凹槽,而同源酶中更短的环则阻碍了亚位点II长凹槽的形成,使该位点仅包含IIa区。PETase与TfCut2在活性位点I处的残基相同,表明二者与第一个MHET的结合模式相似。但在亚位点II处,PETase中含有Trp130和Ser209,而TfCut2的对应位置为His169和Phe249,将PETase的这两个残基分别突变为TfCut2的相应残基后,发现突变酶对PET和BHET的降解活性均显著下降,表明Trp130和Ser209对PETase活性的发挥很关键,这种残基差异可能导致TfCut2的IIa区更窄更深,而不利于第二个MHET与酶的结合[28]。
5.2 影响PETase活性的关键残基
将PETase底物结合位点处的氨基酸残基进行突变,多数情况下会降低酶的水解活性。将催化域三联体中的Ser、His和Asp分别突变为Ala,则酶对PET薄膜和BHET几乎完全失去活性,说明这3个残基是酶催化反应的关键组成[28]。Tyr58、Thr59突变对PET降解为MHET的效率影响较小,但对MHET进一步降解为TPA的效率影响很大。值得注意的是,尽管PETase的Ser209被替换为Phe或Trp130被替换为His后,酶活性显著降低[28],但对PETase引入S209F/W130H双突变后,酶对PET和PEF的降解活性均高于野生型[24]。Ma等[30]通过分子对接发现Ile179能与长底物对苯二甲酸乙二醇酯二聚体(2PET)形成疏水作用,以往研究发现I179A突变型PETase几乎无水解活性,可能是因为破坏了Ile179的疏水作用。该课题组将Ile179突变为疏水性更强且侧链更长的Phe,设计的新酶能够固定住PET的苯环,从而成功将酶的水解活性提高了2.5倍。
除与底物直接相互作用的氨基酸残基,其他残基也能对PETase的活性产生影响。在PETase的催化水解过程中,Trp156的构象“摆动”可能有利于底物的结合与产物的移走,而Trp156的构象与Ser185紧密相关,将Ser185突变为PETase同源酶的对应残基His后,PETase的活性明显降低,说明该酶的突出活性至少部分依赖于Ser185的存在[27]。同理,L88F通过稳定活性位点的关键残基Tyr58,使突变酶的水解活性提高了2.1倍[30]。位于结合位点IIc区末端的Arg251由于带正电且结构凸出,阻挡了底物结合位点的延伸,将其突变为较小疏水残基Ala后,发现酶对PET薄膜的水解活性在18 h和36 h分别提高了22.4 %和32.4 %。对R251A型PETase进行晶体结构测定,发现突变后酶结合位点的IIc区得到延伸,并出现疏水非突起的凹槽,更有利于容纳PET底物[28]。将同样位于底物结合凹槽边缘的带电Arg61突变为疏水残基Ala后,通过降低其周围的带电性,增强了疏水性PET同PETase的结合,使酶的水解活性提高了1.4倍[30]。
6 结语
PET作为当前产量最高的聚酯,在民用和军用产品的制造及包装中得到广泛的应用。由于PET较难生物降解,产生的大量PET废弃物给生态环境造成严重危害。由于传统的焚烧、填埋和回收方法具有较大的弊端,探索经济、环境友好的生物降解方法成为当下的研究趋势,而重点是找到降解活性强并且应用条件易达到的生物酶,以便能够工业化推广。近年来发现的新型PET水解酶PETase,对PET底物具有很强的选择性,且在常温时的降解活性显著高于其他PET水解酶。通过对PETase的生物降解研究进行总结,得出以下几点启示:
(1)PETase发挥出色水解活性的关键特征为其专属的二硫键DS1和独特的亚结合位点II,可将其作为参考标准用于潜在PET水解酶的筛选;
(2)酶底物结合位点处的残基以及能稳定结合位点空间结构的残基,可能对维持酶的水解活性具有重要影响。此外,降低酶表面结合位点处的带电性可作为酶结构改造的依据,通过增强酶与疏水性PET的结合,进而提高其水解活性;
(3)目前的PETase水解实验主要以低结晶度的PET薄膜为底物,但许多PET废弃物为高结晶度制品,这可能对PETase的有效降解构成挑战,由于PET在较高温度下结晶度下降,设计耐热的PET水解酶可能有助于提高PET的降解效率;
(4)已发现的PETase底物包括PET、PEF和对硝基苯酯等,但该酶不能降解脂肪族聚酯,表明PETase可能是一种芳香族聚酯酶。PETase新底物的发现,以及通过酶结构的改造拓宽底物范围(如萘基酯),将提高PETase的应用价值;
(5)PETase水解活性的发挥与外界条件息息相关,探索适宜的温度、浓度和添加剂等反应条件,或者提高酶对不利条件的耐性,将有助于推进该酶的工业化应用进程。
