血清和胎盘组织TSP-1、Endoglin表达与早发型子痫前期血管生成的相关性
2019-03-26,,,
,,,
(1.金华市中心医院产科,浙江 金华 321000;2.金华市中心医院金西院区,浙江 金华 321075)
妊娠期高血压疾病是妊娠期特发疾病,常表现为妊娠20周后出现高血压、蛋白尿等症状,对患者器官造成诸多负面影响,包括胎盘早剥、肺水肿、子痫、心衰的发病风险显著增加,严重时可能威胁孕产妇生命安全[1-2]。目前子痫前期依据妊娠时间不同分为早发型子痫前期和晚发型子痫前期,其中早发型子痫前期患者病情相对较为严重,且并发症较多、更难控制,孕产妇及胎婴儿结局不良率升高[3]。血小板反应蛋白-1(thrombospondin-1,TSP-1)是内皮血管分泌的内源性血管生成抑制因子,其可与CD36结合,诱导内皮细胞凋亡,抑制新血管形成[4]。Endoglin是转化生长因子(transforming growth factor,TGF-β1)受体复合物成分之一,在新生血管内皮细胞、新愈合伤口及肿瘤生长迅速边缘均呈现明显高表达,且在巨噬细胞、合体滋养层细胞中也呈现高表达状况,有效调控内皮细胞增殖[5]。但早发型子痫前期血管生成及不良结局与TSP-1、Endoglin关系仍鲜有报道,因而笔者对我院收治的早发型子痫前期患者作为研究对象,分析妊娠期血清及胎盘组织TSP-1、Endoglin表达与早发型子痫前期血管生成及不良结局的相关性。
1 资料与方法
1.1 一般资料
选取2016年1月至2017年1月间金华市中心医院收治的60例早发型子痫前期患者作为研究组,同期选取30例健康产检孕妇作为对照组,轻度早发型子痫前期(A组)共30例,年龄(28.48±3.28)岁,孕周(30.83±1.32)周,收缩压(151.38±3.89)mmHg,舒张压(101.83±3.58)mmHg,重度早发型子痫前期(B组)共30例,年龄(28.51±3.31)岁,孕周(30.73±1.35)周,收缩压(162.41±3.92)mmHg,舒张压(109.94±3.57)mmHg,对照组年龄(28.63±3.41)岁,孕周(30.39±1.41)周,收缩压(131.34±3.35)mmHg,舒张压(84.75±3.29)mmHg,各组受试者年龄、孕周差异均无统计学意义(均P>0.05),该研究经本院伦理委员会批准并获得患者的知情同意。
1.2入组及排除标准
入组标准:①患者符合《产科学》中早发型子痫前期诊断标准[6];②均为初产、单胎;③入组前均未接受任何治疗;④患者均以剖宫产终止妊娠。排除标准:①既往有糖尿病、高血压、甲状腺功能亢进;②有酗酒、吸烟、药物或毒品滥用史;③有结核、肝炎等慢性传染性疾病;④心、肝、肾等脏器功能异常。
1.3 方法
本组研究中所有受试者均在入组后采集空腹静脉血5mL,后采用酶联免疫吸附法检测血中TSP-1、Endoglin水平。研究对象分娩时取胎盘,并在胎盘中心母体面避开梗塞和钙化区取全层胎盘组织,使用生理盐水冲洗并采用10%福尔马林溶液固定。采用免疫组化SP法检测A组、B组及对照组胎盘组织中TSP-1及Endoglin水平,并采用CD34双标法记录胎盘中微血管密度,所用试剂盒购买自联科生物科技有限公司,所有操作均严格遵照试剂盒说明书进行操作。
采用SP法行免疫组化检测结果判定标准如下:细胞染色强度分4级,分别记为0分、1分、2分、3分,0分:无着色;1分:染色呈浅黄色;2分:染色呈棕黄色;3分:染色呈棕褐色。依照阳性细胞数进行评分,记为阳性细胞百分数,包括0分、1分、2分、3分、4分,其中未染色记为0分;阳性细胞数<25%记为1分;阳性细胞数在25%~50%记为2分;阳性细胞数在51%~75%记为3分,阳性细胞数>75%记为4分,染色强度与阳性细胞数评分乘积记为免疫组化评分,分为强阳性、阳性、弱阳性和阴性,其中6~8分记为强阳性;4~5分记为阳性;3~2分记为强阳性;0~1分记为阴性。阳性率=(强阳性+阳性+弱阳性)/总例数×100.00%。
1.4 统计学方法
使用SPSS 19.0行统计学分析,计量资料采用均数±标准差(χ±S)的形式表示,多组间比较采用方差分析,两组间比较采用独立样本t检验。计数资料采用例数(百分比)的形式表示,组间比较应用χ2检验。各因素关系采用Spearman相关分析,以P<0.05时表示差异具有统计学意义。
2结果
2.1三组孕妇血清中TSP-1及Endoglin水平比较
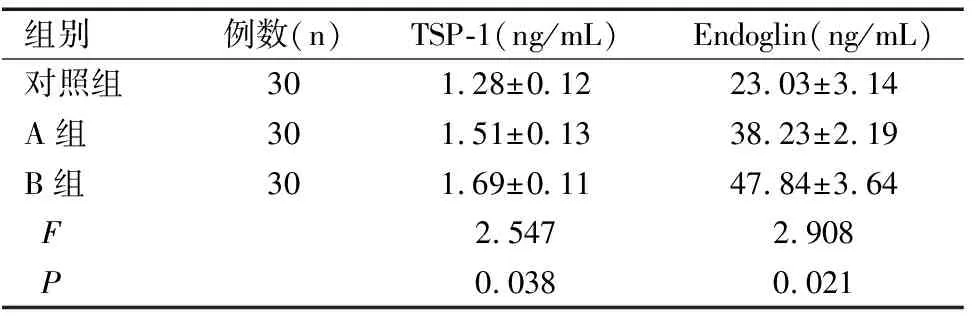
三组孕妇血清TSP-1、Endoglin水平比较均有显著性差异(均P<0.05),B组最高,对照组最低。进一步每两组间比较后发现,B组血清TSP-1、Endoglin水平均显著高于A组和对照组(t值分别为2.346、3.758、2.780、3.995,均P<0.05),A组上述指标显著高于对照组(t值分别为2.258、2.863,均P<0.05),见表1。
表1三组血清中TSP-1及Endoglin水平比较(χ±S)
Table 1 Comparison of serum TSP-1 and Endoglin levels
among three groups(χ±S)
2.2三组孕妇胎盘组织中TSP-1及Endoglin表达比较
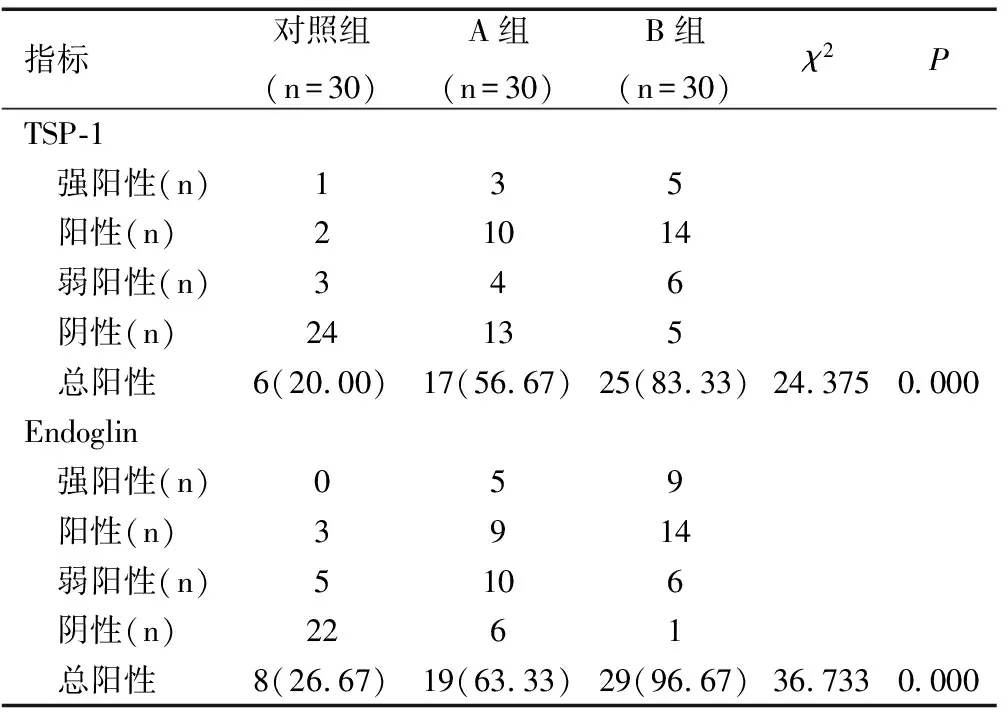
三组孕妇胎盘组织中TSP-1、Endoglin表达比较有显著性差异(均P<0.05),B组最高,对照组最低。进一步每两组间比较后发现,B组孕妇胎盘组织中TSP-1及Endoglin表达均显著高于A组和对照组(χ2值分别为5.079、24.093、2.588、31.093,均P<0.05),A组上述指标显著高于对照组(χ2值分别为8.531、17.143,均P<0.05),见表2。
表2三组孕妇胎盘组织中TSP-1及Endoglin表达比较[n(%)]
Table 2 Comparison of expressions of TSP-1 and Endoglin in placental tissues among three groups[n(%)]
指标对照组(n=30)A组(n=30)B组(n=30)χ2PTSP-1 强阳性(n)135 阳性(n)21014 弱阳性(n)346 阴性(n)24135 总阳性6(20.00)17(56.67)25(83.33)24.3750.000Endoglin 强阳性(n)059 阳性(n)3914 弱阳性(n)5106 阴性(n)2261 总阳性8(26.67)19(63.33)29(96.67)36.7330.000
2.3三组孕妇胎盘组织微血管密度计数结果比较
三组孕妇胎盘组织微血管密度计数有显著性差异(P<0.05),B组最低,对照组最高。进一步每两组间比较后发现,B组显著低于A组和对照组(t值分别为2.547、4.765,均P<0.05),A组显著低于对照组(t=3.558,P<0.05),见表3。
2.4 TSP-1及Endoglin相关性分析
A组及B组患者血清中、胎盘中TSP-1与Endoglin呈显著正相关(均P<0.05),但对照组血清中及胎盘中TSP-1与Endoglin无显著相关性(均P>0.05),见表4。
表3三组孕妇胎盘组织微血管密度计数结果比较(χ±S)
Table 3 Comparison of microvascular density count results in placental tissues among three groups(χ±S)

组别例数(n)微血管密度对照组3090.21±4.23A组3037.84±2.18B组3020.38±2.48F5.326P0.013
表4 TSP-1及Endoglin相关性分析
Table 4 Correlation analysis of TSP-1 and Endoglin

样本源A组B组对照组血清r0.6410.9340.243P0.0470.0000.649胎盘r0.7250.9780.195P0.0380.0000.715
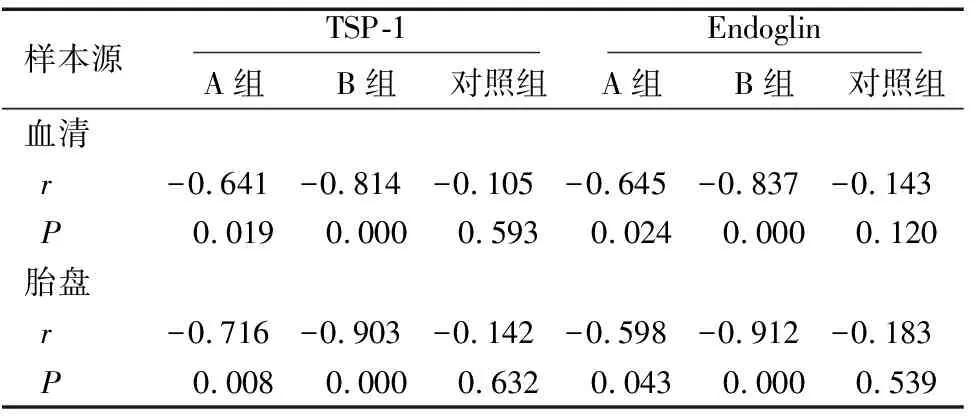
2.5 TSP-1、Endoglin与微血管密度计数相关性分析
A组及B组患者血清中、胎盘组织中TSP-1、Endoglin与微血管密度计数均呈显著负相关(均P<0.05),但对照组血清中及胎盘组织中TSP-1、Endoglin与微血管密度计数均无显著相关性(均P>0.05),见表5。
表5 TSP-1、Endoglin与微血管密度计数相关性分析
Table 5 Correlation analysis between TSP-1 and Endoglin and microvascular density count
样本源 TSP-1 Endoglin A组B组对照组A组B组对照组血清r-0.641 -0.814 -0.105 -0.645 -0.837 -0.143 P0.0190.0000.5930.0240.0000.120胎盘r-0.716 -0.903 -0.142 -0.598 -0.912 -0.183 P0.0080.0000.6320.0430.0000.539
3讨论
3.1子痫前期对孕产妇健康的影响
子痫前期是妊娠期特有疾病,其以蛋白尿、高血压等作为主要临床特征,常可能对患者多个器官、组织造成严重不良影响,严重威胁孕产妇及婴儿的健康,一般情况下,子痫前期常由于全身小血管痉挛,造成内皮损伤,可能诱发患者病发脑出血、脑水肿、肝肾功能损伤、心力衰竭等,可能造成产后出血、胎盘早剥等诸多产科并发症[7]。此外,由于子痫前期患者其胎盘多存在供血不足现象,可能导致胎儿出现胎儿生长受限、胎儿窘迫、死产、死胎等。有研究指出,随着胎盘及胎儿的娩出,妊娠期高血压病理改变并可能伴随出现自行逆转。
3.2 TSP-1与早发型子痫前期的关系
母体抗血管生成因子和循环促血管生成不平衡能在早发型子痫前期发生及发展过程中起到十分重要的作用。TSP-1是人体内重要的一种多功能糖蛋白,是体内天然新生血管生成抑制因子,是重要的新生血管生成内源性抑制物[8]。有报道指出,在子痫前期发生及发展过程中内源性血管生成抑制剂是重要的病理生理过程[9]。TSP-1在血管内皮细胞的激活过程中起到十分作用,增加氧代谢产物和血管活性物质释放量,并可能导致纤维蛋白原沉积增加,最终可能导致血栓形成[10]。本组研究结果发现,早发型子痫前期患者血中及胎盘组织中TSP-1水平均显著高于对照组(P<0.05),且血中及胎盘组织中TSP-1水平与微血管密度计数均显著负相关(P<0.05),结果表明早发型子痫前期患者由于存在抑制新生血管形成和损害血管内皮组织现象,导致血管功能受损。而TSP-1胎盘高水平影响滋养细胞功能,导致胎盘组织出现血管内皮组织受损,造成胎盘组织出现反复缺氧、缺血,导致胎盘功能受损,并与患者预后质量密切相关。
3.3 Endoglin表达与早发型子痫前期的关系
有研究结果显示,正常人体内中Endoglin水平较低,在妊娠后Endoglin水平常随之增高,且随着孕周增加而缓慢上升,且在妊娠25周后大部分常大幅增加且在分娩前达到高峰后逐渐恢复至正常水平[11]。Endoglin过度表达可能导致血管痉挛、脑水肿、高血压发病率增高[12]。本组研究中通过检测所有受试者体内Endoglin水平研究结果显示,早发型子痫前期患者血中及胎盘中Endoglin水平均显著高于对照组(P<0.05),且B组患者血中及胎盘中Endoglin水平显著高于A组(P<0.05)。深入分析发现,微血管密度计数及预后质量均与Endoglin水平密切相关,提示随着早发型子痫前期患者病情发展,胎盘持续缺氧、缺血加速,刺激体内Endoglin水平表达量增加,抑制滋养细胞分化及侵润,诱导滋养细胞侵润过浅。引起全身小血管痉挛,加重患者病情,导致患者预后质量不佳。
综上所述,早发型子痫前期血管生成与患者血清及胎盘组织中TSP-1、Endoglin水平呈显著正相关关系,但本组研究临床样本数较少,有待后续扩大临床样本数深入研究。
