堆肥添加氧化石墨烯和纳米SiO2对高羊茅生长的影响
2019-03-25王鑫禹多立安赵树兰
王鑫禹,多立安,赵树兰
(天津师范大学 生命科学学院,天津 300387)
生活垃圾堆肥富含有机质、氮、磷、钾及植物所需的营养元素,能够提高土壤肥力并刺激植物生长.但由于我国未实行严格的垃圾分类处理,生活垃圾堆肥中含有大量的重金属,这些重金属极易随着施肥进入农田土壤且随土壤径流污染地表及地下水,从而危及人类健康[1].在土壤重金属修复中,纳米材料由于具有尺寸小、比表面积大、吸附效果好等优点而得以应用[2-4].氧化石墨烯(GO)作为碳纳米材料石墨烯的重要衍生物,表面具有丰富的含氧官能团和大的表面积,可以通过配位、静电作用、表面络合以及离子交换等结合重金属离子,在环境污染控制和治理领域发挥着重要作用[5].纳米二氧化硅(nano-SiO2)的微结构呈无定形絮状或网状结构,也是应用较多的一种无机纳米材料[6],如能够明显提升柠檬酸和酒石酸对土壤Pb、Zn和Cd的去除率[7].纳米材料也会在一定程度上影响植物生长.有研究[8-10]发现,某些碳纳米材料可以刺激作物种子萌发,促进植物根系伸长;有些碳纳米材料则对植物生长发育存在负面效应,表现为生长抑制、组织损伤等,如Cakir等[11]研究了氧化石墨烯对豆类种子发芽和幼苗生长的潜在影响,发现氧化石墨烯的存在导致了种子发芽率变小、根与苗的长度变短、质量降低.
在纳米材料对植物生长影响的研究中,报道相对较多的是碳纳米管[12],有关氧化石墨烯和纳米SiO2的研究较少.本研究选择氧化石墨烯和纳米SiO2为钝化剂,以我国北方广泛应用的冷季型草坪草高羊茅(Festucaarundinacea)作为研究对象,探究堆肥基质中添加氧化石墨烯和纳米SiO2对高羊茅生长和抗氧化酶活性的影响,为纳米材料在堆肥重金属修复中的应用和纳米材料的风险评价提供参考.
1 材料与方法
1.1 材料
氧化石墨烯,苏州恒球纳米公司生产,黑色粉末,平均厚度为 3.4~7.0 nm,片层直径 10~50 μm,层数 5~10层,比表面积为100~300 m2/g,纯度为90%.
纳米SiO2,上海麦克林生化公司生产,超微细白色蓬松粉末,比表面积为200 m2/g,粒径为7~40 nm,纯度为99.8%.
生活垃圾堆肥取自天津市小淀生活垃圾堆肥处理厂,过2mm筛备用.基本理化性质:有机质质量分数22.0%,饱和含水量 0.67 mL/g,pH 7.49,全氮 0.58%(质量分数,余同),全磷0.34%,全钾1.21%,有效磷0.078 g/kg,碳氮比为8.37.草坪植物选用高羊茅.
1.2 实验设计
采用直径为7.0 cm、高为7.8 cm的塑料盆.垃圾堆肥自然风干,过2 mm筛.每盆中加入85 g堆肥以及一定质量的GO和纳米SiO2,各处理组的具体配比如表1所示.各种配料混合均匀,以不添加GO和纳米SiO2为对照,每个处理重复4次.选择籽粒饱满、大小均一的高羊茅种子,用体积分数为3%的H2O2表面消毒10 min,无菌水冲洗 3次,每次1~2 min,晾干.每盆堆肥基质表面播撒1 g高羊茅种子进行草坪建植.植物培养期间室内温度为18~28℃,相对湿度为50%,光照为透入室内的自然光(600~28 000 lx).每天补充水分,保证土壤含水量为最大持水量的70%,供植物正常生长所需.经常调换花盆位置,保证受光一致.

表1 各处理组中GO和纳米SiO2的质量分数Tab.1 Mass fraction of GO and nano-SiO2in each treatment %
1.3 测定指标与方法
1.3.1 植物生长指标测定
播种第25 d开始,每隔5 d测一次株高,每盆随机选取5株长势匀称的植株,取其平均株高.第55 d刈割.刈割后小心掰开盆中堆肥,取出完整植株,蒸馏水冲洗干净根部泥土后用滤纸吸干,小心分开地上部分与地下部分.再将地上和地下部分分别在108℃下杀青20 min,80℃烘干至恒重并称量.
1.3.2 叶绿素含量的测定
称取新鲜叶片0.2 g,剪成1~2 mm碎片,浸泡于丙酮-乙醇的混合溶液(体积比为1∶1)中.浸泡24 h后,用分光光度计测量波长663 nm和645 nm下的吸光值.
1.3.3 丙二醛(MDA)含量及抗氧化酶活性测定
丙二醛含量的测定采用硫代巴比妥酸法,分别测定450、532、600 nm处的吸光值,算出MDA的浓度,再折算成单位鲜重组织中的MDA含量,用每克鲜重中MDA的物质的量(μmol/g)表示.
粗酶液的提取:称取新鲜叶片0.5 g,分别加入预冷的提取液3 mL和少许石英砂,充分冰浴研磨后转入离心管中,再用2 mL提取液洗研钵,合并提取液.4℃下10 000 r/min离心20 min,将上清液分装,4℃保存.
过氧化物酶(POD)活性测定:采用愈创木酚法,测定470 nm处吸光度的变化,以每分钟内引起470 nm吸光度变化0.01的酶量为1个酶活力单位(U),单位为U/(g·min).
超氧化歧化酶(SOD)活性测定:采用NBT法,以抑制氮蓝四唑(NBT)光还原50%为1个酶活力单位(U),用每克鲜重的酶活力单位数(U/g)表示.
过氧化氢酶(CAT)活性测定:采用紫外分光光度法,于240 nm处测定吸光度变化,以每分钟内引起240 nm吸光度减少0.1的酶量为1个酶活力单位(U),单位为U/(g·min).
抗坏血酸过氧化物酶(APX)活性测定:以每分钟氧化1 μmol抗坏血酸的酶量为1个酶活力单位(U),单位为U/(g·min).
1.3.4 数据处理
采用SPSS 19.0进行单因素方差分析(One way ANOVA),采用Tukey法在P=0.05水平进行数据差异统计学意义检验,采用Microsoft Excel 2007作图.
2 结果与分析
2.1 GO和纳米SiO2对高羊茅株高和生物量的影响
堆肥中添加不同比例的GO和纳米SiO2后,高羊茅的株高如表2所示.
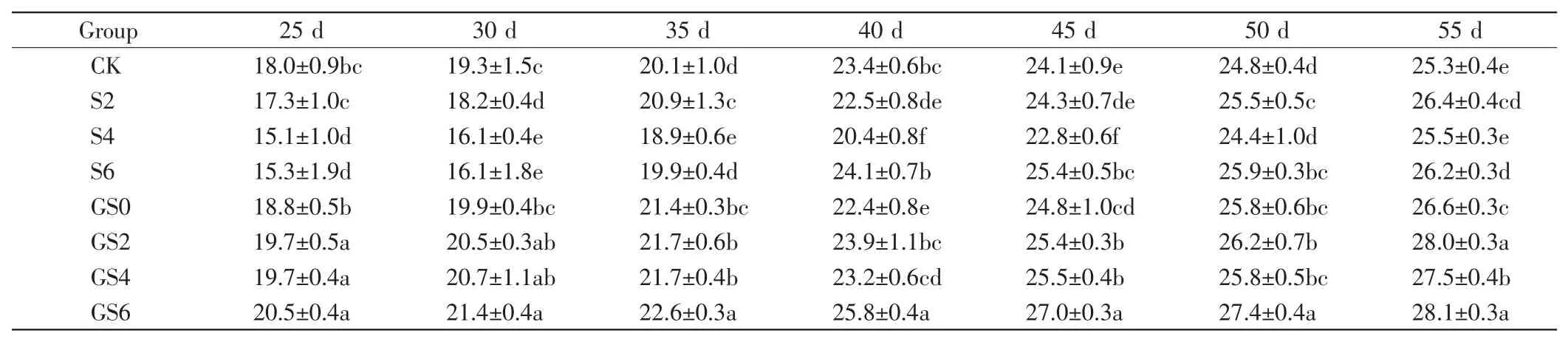
表2 GO和纳米SiO2对高羊茅株高的影响Tab.2 Effects of GO and nano-SiO2on height of Festuca arundinacea cm
由表2可以看出,在整个生长期内,共同添加GO和纳米SiO2的处理组株高显著高于对照组,并且随着纳米SiO2添加量的增加株高增大.在前40 d,单独添加纳米SiO2处理组的株高低于对照组的数值,共同施加GO和纳米SiO2的处理组中株高大于对照组的数值.在第50d到第55 d,添加纳米SiO2的处理组株高较对照组有显著增加,且随着添加量的增加株高有增加趋势.与单独添加纳米SiO2的处理组相比,添加1.0%GO后株高显著增加.在整个生长期内,添加GO和0.6%纳米SiO2的处理组中高羊茅株高达到最大值,与对照组的差异具有统计学意义(P<0.05).
单独添加0.2%纳米SiO2的处理组中,高羊茅地上干重较对照组略有增加,0.6%和0.4%纳米SiO2处理组的地上干重相近,略低于对照组的数值,如图1所示.
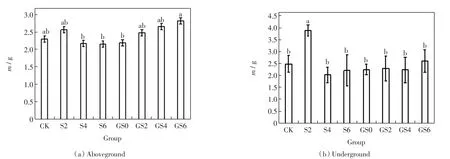
图1 GO和纳米SiO2对高羊茅干重的影响Fig.1 Effects of GO and nano-SiO2on dry weight of Festuca arundinacea
堆肥基质中共同施加了GO和纳米SiO2后,同对照组或单独添加纳米SiO2的处理组相比,高羊茅地上干重增加并随着纳米SiO2添加量的增加而增加.GO和0.6%纳米SiO2处理组中高羊茅的地上干重最大.
除了0.2%纳米SiO2处理组的地下干重显著大于对照组外(P<0.05),其余处理组的地下干重均与对照组相近.各处理组的地下干重较对照组减少但差异不具有统计学意义(P>0.05).
2.2 GO和纳米SiO2对高羊茅叶绿素含量的影响
不同处理组中高羊茅的叶绿素含量如表3所示.由表3可以看出,堆肥基质中添加了GO和纳米SiO2后,各处理组高羊茅的叶绿素a、叶绿素b、总叶绿素含量均低于对照组的数值,但差异不具统计学意义(P>0.05).单独添加0.6%纳米SiO2的处理组中,高羊茅叶绿素a和总叶绿素含最低,分别比对照组降低了12.77%和9.27%.单独添加GO的处理组中,高羊茅叶绿素b含量最低,较对照组降低了8.95%.
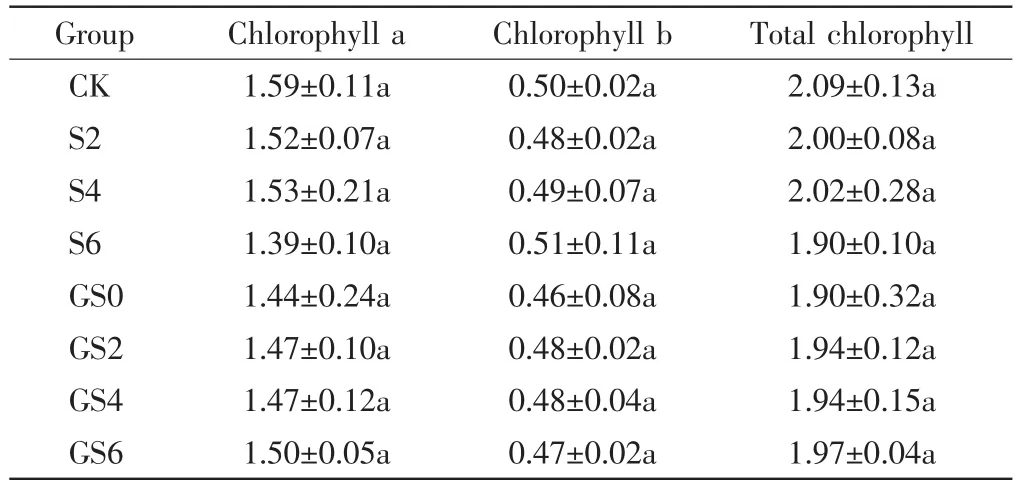
表3 GO和纳米SiO2对高羊茅叶绿素含量的影响Tab.3 Effects of GO and nano-SiO2on chlorophyll content of Festuca arundinacea (mg·g-1)
2.3 GO和纳米SiO2对高羊茅MDA含量的影响
不同处理组的高羊茅MDA含量如图2所示.
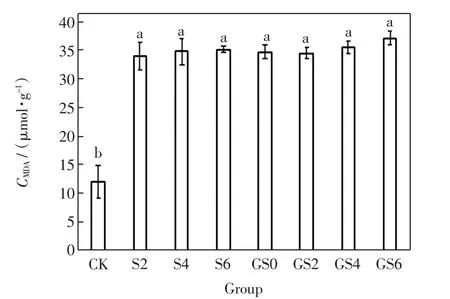
图2 GO和纳米SiO2对高羊茅MDA含量的影响Fig.2 Effects of GO and nano-SiO2on MDA content of Festuca arundinacea
由图2可以看出,添加GO和纳米SiO2的7个处理组中,高羊茅的MDA含量显著增加,分别是对照组的2.89、2.84、2.88、2.90、2.97、2.93、3.09 倍.无论是添加GO还是纳米SiO2,都对高羊茅的MDA含量产生了相同的影响,使高羊茅的膜脂过氧化物含量显著增加.添加了1.0%GO和0.6%纳米SiO2处理组中的MDA含量最高.
2.4 GO和纳米SiO2对高羊茅抗氧化酶活性的影响
不同处理组中高羊茅的抗氧化酶活性如表4所示.
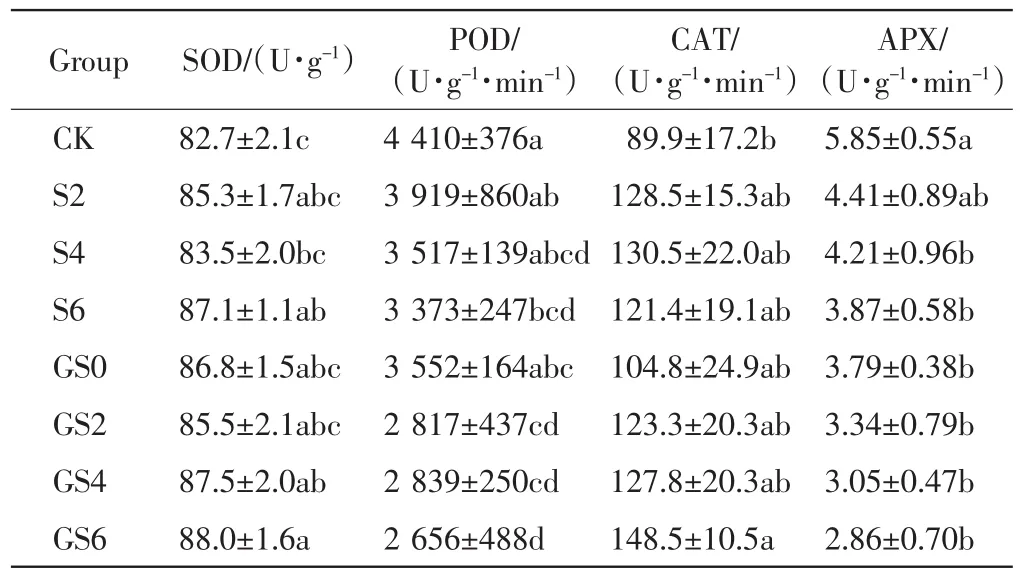
表4 GO和纳米SiO2对高羊茅抗氧化酶活性的影响Tab.4 Effects of GO and nano-SiO2on the antioxidant enzyme activity of Festuca arundinacea
由表4可以看出,单独添加纳米SiO2的处理组中,高羊茅的SOD和CAT活性均高于对照组.堆肥中共同施加了GO和纳米SiO2后,这2种酶的活性也高于对照组的数值.随着纳米SiO2添加量的增加,2种酶的活性呈增加趋势.0.6%纳米SiO2处理组中,SOD和CAT活性分别比对照组增加了6.41%和65.18%.
堆肥中添加GO和纳米SiO2后,高羊茅的POD和APX活性显著低于对照组的数值(P<0.05),随着GO和纳米SiO2添加量的增加,2种酶的活性呈下降趋势.与单独添加纳米SiO2的处理组相比,添加GO后,POD和APX活性均显著下降,GO和0.6%纳米SiO2处理组中的POD和APX活性分别比对照组降低了39.78%和51.10%.
3 讨论与结论
有研究显示,纳米材料对植物生长具有正向调节作用,能够显著提高植株的株高、根长、生物量等[8-10].本研究以添加了氧化石墨烯和纳米SiO2的堆肥为基质培养高羊茅,结果发现,高羊茅经过55 d的生长,2种钝化剂都能显著增加高羊茅的株高,促进高羊茅的生长,在氧化石墨烯和0.6%SiO2的共同作用下,高羊茅株高出现最大值,但是对生物量的影响不显著.添加GO和纳米SiO2后,高羊茅的叶绿素a、叶绿素b、总叶绿素含量较对照组均略有下降.Zhang等[13]、文双喜等[14]有类似的研究结果,纳米二氧化钛(TiO2-NPs)处理下芦苇叶绿素含量均随处理浓度的升高而下降,且粒径越小下降幅度越大.也有研究[15]表明,在水稻生育后期补施纳米硅肥可直接增强叶片中的叶绿素含量,从而增强光合作用.可见,纳米材料对植物叶绿素含量的影响可能与纳米材料的种类、浓度、施加时期、植物种类等有关.本研究中,堆肥添加GO和纳米SiO2后,高羊茅MDA含量较对照组显著增加,是对照组的2~3倍,说明添加纳米材料后造成了高羊茅细胞膜的过氧化.抗氧化酶系统是植物体重要的防御系统组成成分,为细胞清除活性氧.SOD、POD、APX和CAT等可以作为植物受到胁迫的指示指标[16].在这个过程中,有的抗氧化酶会随着处理时间的延长出现先升高后降低的变化;有的抗氧化酶会随着处理时间的延长活性一直降低[17].本研究表明,堆肥中添加了一定量的GO和纳米SiO2后,高羊茅的抗氧化酶活性随之发生变化.SOD和CAT活性随着纳米SiO2添加量的升高而提高,POD和APX活性随着纳米SiO2添加量的升高而降低.结合MDA含量和抗氧化酶活性来看,堆肥中添加纳米材料能够使高羊茅的膜脂过氧化程度加重,MDA含量显著增加,而POD、APX活性却较对照组显著下降,说明添加纳米材料影响了高羊茅细胞内蛋白质等物质的合成,造成了抗氧化酶的活性降低[18].王震宇等[19]的研究也发现,多壁碳纳米管处理可以诱导SOD活性的升高,提高植物抗氧化的能力.SOD与O2·-作用生成 H2O2和 O2,POD 和 CAT 又可继续分解H2O2,从而降低植株体内H2O2的浓度,起到保护机体免受活性氧物质伤害的作用.4种抗氧化酶在添加纳米材料后产生了不同的变化趋势,说明细胞通过抗氧化酶的协同作用抵抗氧化胁迫.
综上所述,本研究以添加了GO和纳米SiO2的堆肥为基质培养高羊茅,在一定生长时期内,GO和纳米SiO2显著增加了高羊茅的株高,降低了叶绿素含量.高羊茅的MDA含量显著增加,POD、APX活性下降,SOD、CAT活性提高.因此认为,GO和纳米SiO2可以促进高羊茅的生长,但也对高羊茅产生了一定的胁迫,激活了高羊茅的自我保护机制,在生长期内此胁迫并不影响高羊茅的正常生长发育.
