组织蛋白表达水平检测方法的比较分析
2019-03-25余斯琦苏春玉于东渤朱长军董智雄
鲍 鹏 ,余斯琦 ,苏春玉 ,于东渤 ,朱长军 ,董智雄
(1.天津师范大学 生命科学学院,天津 300387;2.天津师范大学 天津市动植物抗性重点实验室,天津 300387;3.天津师范大学 分子细胞系统生物学重点实验室,天津 300387)
生物体中,蛋白质是基因表达的产物,也是最终执行生物功能的分子.核仁是真核细胞内核糖体生物发生的场所,它通过控制核糖体的生物发生调控细胞的各项基本生命活动[1-5].有研究发现,大量与核仁和核糖体生物发生途径相关的蛋白在肿瘤中的表达水平升高,可用于肿瘤诊断、恶性程度判断及预后等.如核仁蛋白NOP14在胰腺癌肝转移灶中表达上调,可能通过促进肿瘤微血管形成导致胰腺癌的生长和转移[6-7];核仁蛋白EBP2在肺癌细胞系中高表达,且它的过表达能促进肺癌细胞的增殖[8];核仁蛋白PES1在乳腺癌组织中高表达,它与乳腺癌的发生和发展相关,可作为乳腺癌的生物标记物[9-11].
常用于组织蛋白表达水平检测的方法有Western blot、酶联免疫吸附技术(ELISA)、免疫荧光染色、免疫组织化学染色等.Western blot可以检测样品中是否存在目的蛋白的抗原、在组织中的含量及其抗原多肽链的相对分子质量等,具有高效、简便、灵敏等特点,但在检测过程中经常会出现非特异性条带、膜本底差、显色不好等问题,从而影响实验结果.ELISA多用于定量分析,其灵敏度极高,可以定量检测蛋白,直接读出浓度,但如果抗体出现非特异性结合,则通过ELISA得到的数值可信度会降低,且该方法也无法检测目的蛋白与特定蛋白质的结合情况.免疫荧光染色和免疫组织化学染色中,目前常用的是冰冻切片免疫荧光染色、石蜡切片免疫组织化学染色和石蜡切片免疫荧光染色.冰冻切片免疫荧光染色最突出的优点是能够较完好地保存多种抗原的免疫活性,染色方法简单、快速、敏感,容易重复,结果容易判断,但冰冻组织块很小,难以长期保存,因此无法用于回顾性分析研究[1].石蜡切片的优点是组织结构保存良好,在病理和回顾性研究中有较大的实用价值,能切连续薄片,组织结构清晰,抗原定位准确.石蜡切片虽优点较多,但在制片过程中要经过酒精、二甲苯等有机溶剂的处理,组织内抗原活性失去较多.总之,组织蛋白表达的检测方法很多,各有利弊,目前还没有一个明确、统一的检测方法.
本课题组通过检索和分析Oncomine肿瘤基因数据库发现,核仁蛋白RRP15与结肠癌的发生发展密切相关,其表达量在癌组织中上调了2.65倍.本研究制备了RRP15的特异性抗体,分别利用免疫组织化学染色和免疫荧光染色方法,检测该蛋白在组织中的表达水平.以RRP15 mRNA的表达水平为参照,比较不同染色方法的优劣性,从而为找到一种能够快速、准确定量检测组织蛋白表达水平的方法提供参考.
1 材料与方法
1.1 主要材料与仪器
1.1.1 材料
12例病例标本购置于武汉谷歌生物科技有限公司.
1.1.2 仪器
荧光共聚焦显微镜(Eclipse90i),日本Nikon公司;实时荧光定量PCR仪,美国Bio-Rad公司.
1.1.3 试剂
特异性多克隆兔抗RRP15抗体,本实验室自制;辣根过氧化物酶(Horse radish peroxidase,HRP)标记的山羊抗兔抗体,美国Immuno公司;Trizol试剂盒,美国Invitrogen公司;免疫组化试剂盒,丹港生物科技有限公司;Ultra SYBR Mixture,北京康为世纪生物科技有限公司.
1.2 方法
1.2.1 Real-time PCR检测RRP15 mRNA的表达
使用Trizol试剂盒(操作参照说明书)提取肿瘤组织和正常组织的总RNA.取2 μg总RNA进行反转录合成cDNA.PCR总反应体系为20 μL,包括oligo dT 1 μL、dNTP 4 μL、5×buffer 4 μL、反转录酶 1 μL,加高压水补足至20 μL,将上述样品混匀,利用PCR仪进行扩增.反应参数:25 ℃ 10 min;42 ℃ 1 h;95 ℃ 5 min;4℃保温.合成cDNA后进行PCR反应,检测RRP15 mRNA的表达水平,以β-actin为内参.PCR引物包括:RRP15 上游引物(5′-GGTAACTGGAGCCGTAG-3′)、下游引物(5′-GGACTTTAGCCATAGCAT-3′);β-actin 上游引物(5′-TCGTGCGTGACATTAAGGAG-3′)、β-actin下游引物(5′-ATGCCAGGGTACATGGTGGT-3′).PCR总反应体系为20 μL,包括2×Ultra SYBR Mixture PCR缓冲液 10 μL、10 μmol/L 的上、 下游引物各 1 μL、cDNA模板1.5 μL,超纯水补足至20 μL.反应条件:95℃预变性10 min;95℃反变性10 s,55℃退火30 s,72℃延伸30s,共35个循环.溶解曲线分析:95℃15s,60℃ 1 min,95℃ 15 s,60℃ 15 s.
1.2.2 免疫组织荧光染色法
石蜡切片免疫组织荧光染色步骤如下:(1)切片常规脱蜡至水;(2)将切片放入柠檬酸钠缓冲液中,微波炉低火加热 15 min,用 PBS 冲洗一次,5 min;(3)加入500 μL 封闭液,37 ℃孵育 20 min;(4)滴加稀释的一抗工作液兔抗RRP15,37℃孵育2 h,用PBS冲洗3次;(5) 滴加 500 μL第二抗体,37℃湿盒孵育 1 h,用PBS 冲洗 3次;(6)滴加 500 μL 的 DAPI,37℃湿盒孵育5 min,用PBS洗3次,封片.
1.2.3 免疫组织化学染色法
石蜡切片免疫组织化学染色步骤如下:(1)切片常规脱蜡至水;(2)将切片放入柠檬酸钠缓冲液中,中火煮沸8 min,停火8 min,中低火煮7 min,用PBS洗一次;(3)将切片放入体积分数为3%的H2O2中,37℃避光孵育 25 min,PBS洗 3次;(4) 加入 500 μL 封闭液,37℃孵育10 min;(5)滴加稀释的一抗工作液兔抗RRP15,4℃过夜;(6)PBS洗 3次,滴加 500 μL 兔抗生物素化二抗,37℃湿盒孵育10 min,PBS冲洗3次;(7)滴加500 μL HRP标记链亲和素,37℃湿盒孵育10 min,PBS冲洗 3次;(8)滴加 400μL 新鲜配制的DAB显色液作用7 min,水洗10 min,苏木精复染1 min,用流水冲洗返蓝,分化30 s,流水冲洗5 min,伊红染色1 min,流水冲洗5 min,梯度乙醇脱水,浸入二甲苯,自然晾干后,中性树胶封片,在光学显微镜下观察.
1.2.4 统计学分析
采用SPSS 22.0软件进行统计分析,等级资料采用非参数秩和检验进行分析,P<0.05时差异具有统计学意义.
2 结果与分析
2.1 Oncomine数据库分析RRP15蛋白在结肠癌中的表达
利用Oncomine数据库分析RRP15蛋白在多种癌症中的表达情况,结果如图1所示.由图1可以看出,相对于正常结肠组织,RRP15蛋白在结肠癌组织中的表达显著升高,其表达量是正常组织中的2.65倍.
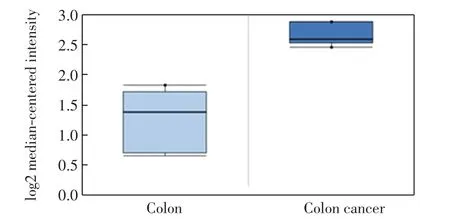
图1 Oncomine数据显示RRP15在结肠癌中高表达Fig.1 High expression of RRP15 in colon cancer showed by oncomine data
2.2 Real-time PCR检测RRP15在结肠癌中的表达
从12例结肠癌病人的癌组织及相应的癌旁正常组织中选取RRP15为目的蛋白,利用Trizol法提取组织的总RNA,反转录后得到cDNA,进行Real-time PCR检测,定量结果如图2所示.由图2(a)可以看出,在 12例病人中,1号、2号、5~8号、10~12号病例的结肠癌组织中,RRP15 mRNA的水平明显高于癌旁组织,3号、4号、9号病例中的表达有不同程度的下调.由图2(b)可以看出,结肠癌组织中RRP15的表达量为癌旁组织的1.88倍.
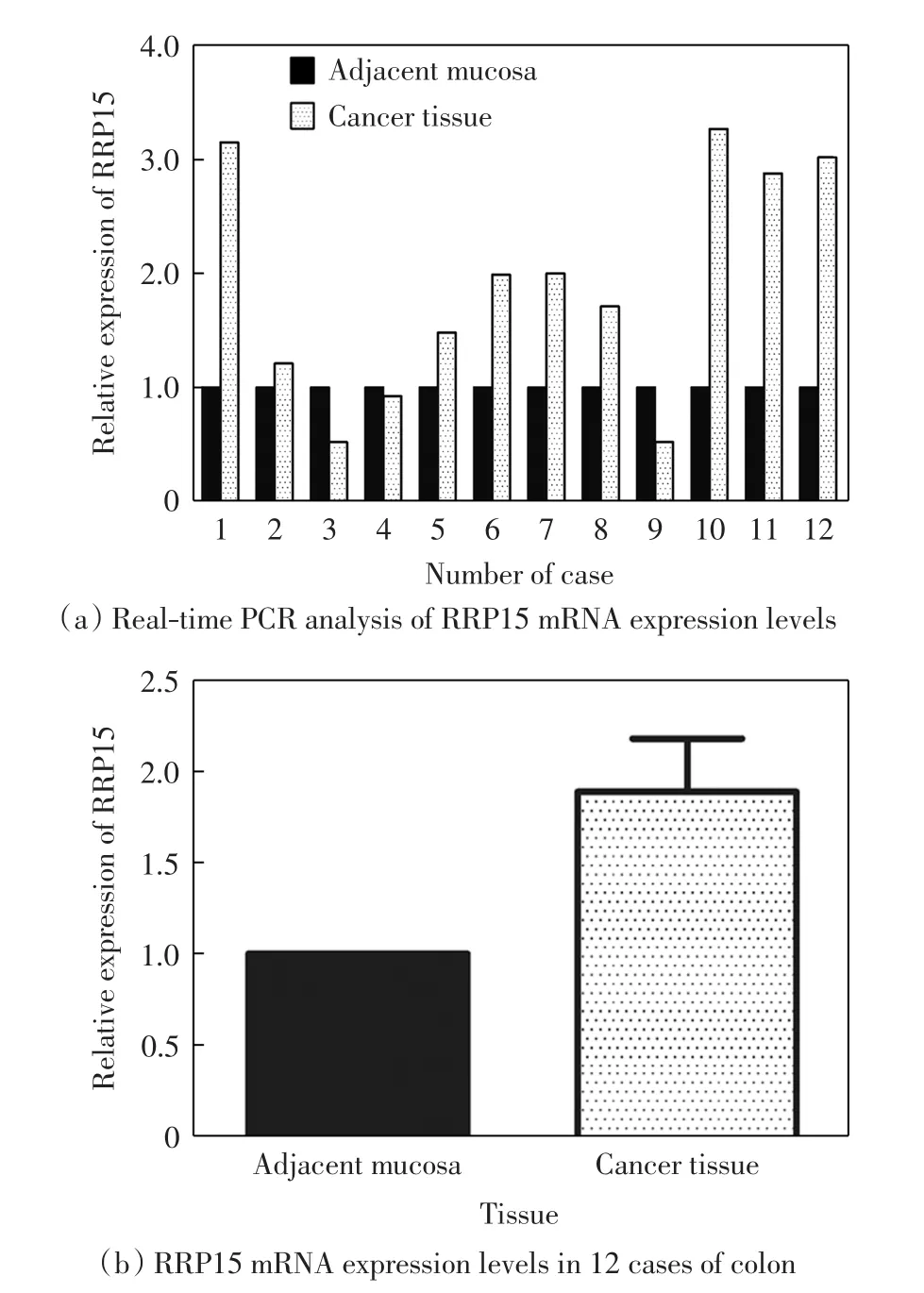
图2 RRP15 mRNA在结肠癌组织中的表达Fig.2 RRP15 mRNA expression in colon cancer tissues
2.3 免疫荧光染色法检测RRP15在结肠癌中的表达
制备12例结肠癌病人的癌组织及癌旁组织的石蜡切片,进行免疫荧光染色,在荧光显微镜下以相同曝光时间进行图像采集,之后用Image Pro Plus统计其荧光强度,结果如图3所示.由图3(a)和图3(b)可以看出,在12例结肠癌病人中,1号、2号、6号、7号、8号、10号、11号、12号结肠癌组织中RRP15的荧光强度明显高于癌旁组织,3号、4号、5号、9号结肠癌组织中的荧光强度则弱于癌旁组织,这与Real-time PCR的结果基本一致.综合所有病例的结果可知,RRP15在结肠癌组织中的荧光强度是癌旁组织的1.29倍,如图3(c)所示.
2.4 免疫组织化学染色法检测RRP15在结肠癌中的表达
利用免疫组织化学染色法检测12例结肠癌病人的癌组织及癌旁组织中RRP15的表达,结果如图4所示.
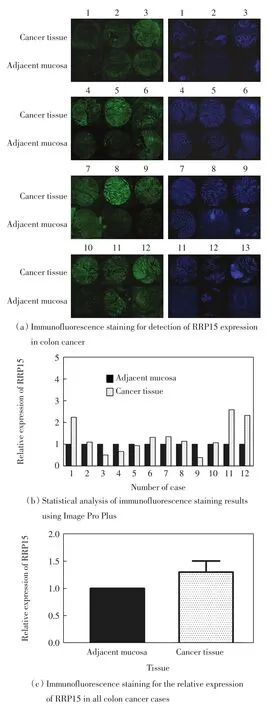
图3 免疫荧光染色检测RRP15在结肠癌中的表达Fig.3 Detection of RRP15 expression in colon cancer tissues using immunofluorescence staining
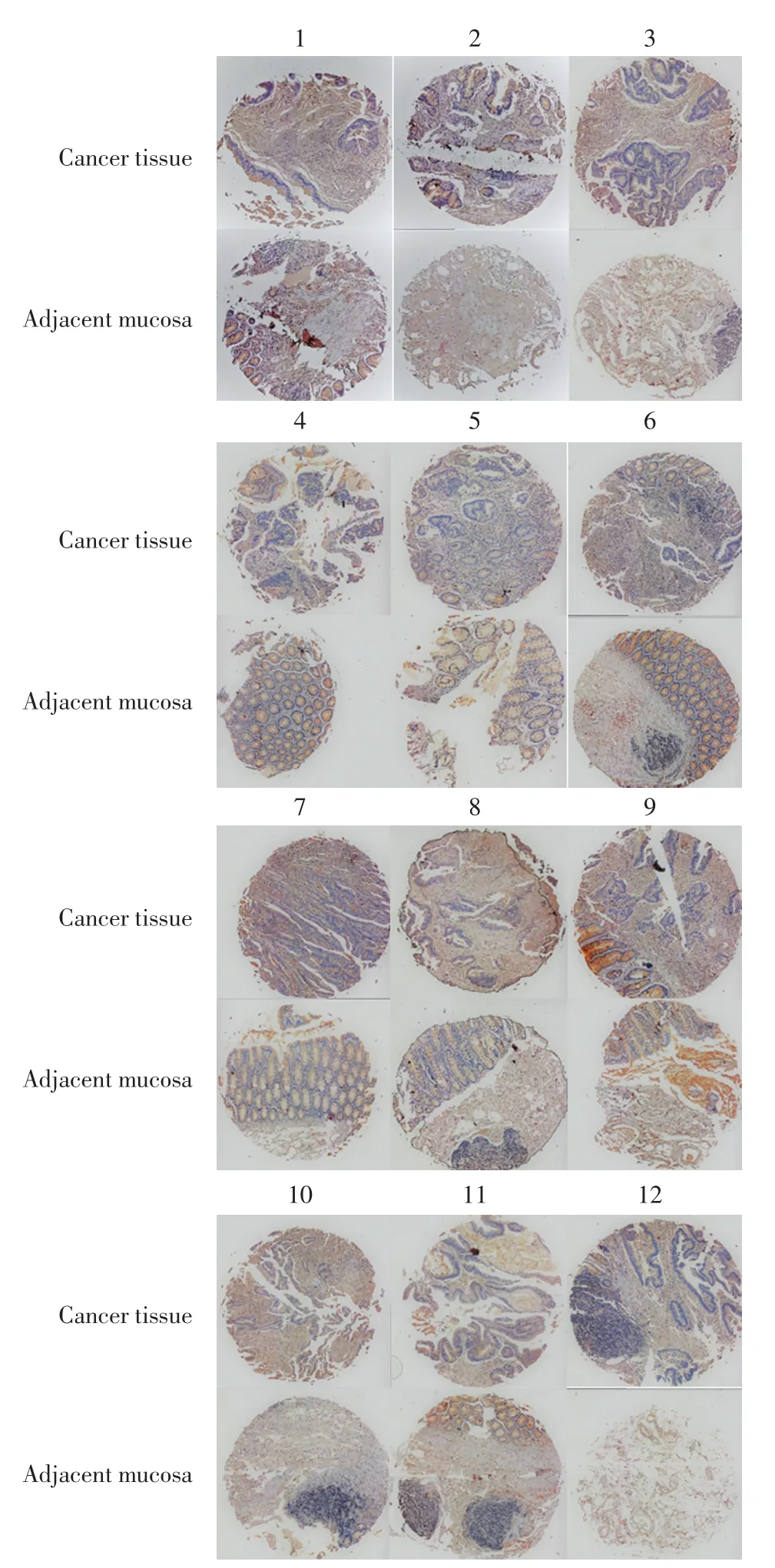
图4 免疫组织化学染色检测RRP15在结肠癌中的表达Fig.4 Detection of RRP15 expression in colon cancer tissues using immunohistochemical staining
由图4可以看出,在12例患者中,1号、2号、3号、5号、6号、8号、9号、10号、12号为阳性,4号、7号、11号为阴性.该种检测方法中,3号、7号、9号、11号的检测结果均与Real-time PCR的检测结果不一致.
3 讨论与结论
为了寻找一种简便快捷、可靠的组织蛋白表达水平检测方法,本研究以结肠癌患者肿瘤组织和正常组织中RRP15 mRNA的表达水平作为参照,比较免疫荧光染色法和免疫组织化学染色在检测组织蛋白表达水平上的优劣.结果显示,石蜡切片免疫组织化学染色法和石蜡切片免疫荧光染色法都能对癌组织中蛋白的表达进行检测,但后者准确率更高,而且通过统计染色后的荧光强度,可将蛋白水平进行量化,更直观地反映出表达情况.
在肿瘤的临床检测与治疗过程中,多种蛋白的表达水平与患者的疾病恶化程度判断、临床治疗手段的选择及预后等直接相关.如NGAL蛋白与免疫炎症反应相关,当炎症或肿瘤发生时组织内的NGAL迅速升高,被认定为评价因炎症或肿瘤形成而导致内皮损伤严重程度的重要标志物[12-13].Survivin蛋白在多种泌尿系肿瘤中有表达,其高表达往往预示患者预后不良以及较高的复发率[14].由此可见,这些与癌症发生发展、预后相关的蛋白在组织中精确的定量检测至关重要.免疫荧光染色法能够对组织中的目的蛋白进行荧光标记,通过激光共聚焦显微镜对荧光标记的组织标本进行共聚焦荧光定量分析,或者通过采集图像信息统计其荧光强度进行定量分析.而免疫组织化学染色法只能进行半定量的分析研究,而且其结果判断主观性较强,因此免疫组化法难以对某一蛋白进行精确的定量分析.
除此之外,石蜡切片免疫荧光双重染色法既有冰冻切片免疫荧光染色抗原特异性高、敏感性强、能同时显示表达于同一部位的2种抗原的特点,又具有石蜡切片免疫组化染色组织细胞结构清晰、抗原定位准确的优点,这对于某些癌症中需要精确检测目的蛋白的表达水平具有重要临床意义.而免疫组化方法虽然具有特异性强、灵敏度高、方法简单易行、图像直观、结果便于评价等优点,但却有很大的局限,例如一次只能检测一个抗原、用多底物显色系统标记后结果不容易区分、特别是表达在相同位置的2个抗原容易出现重叠因此结果不好判断等.该方法也会受到分辨率的影响,在明场下,底物颜色和切片厚度都能影响到最终结果.另外,由于显色底物是酶促反应,很容易出现底物饱和的现象,因而限制了半定量分析[15].
综上所述,免疫荧光染色检测法是检测组织中蛋白表达水平的首选方法,免疫组化染色可作为一种辅助方法.对于某些组织只需要检测目的蛋白表达的有无或者表达的高低可以选择方法更加简便快捷的免疫组化,但对于需要准确定量分析蛋白表达水平,或者探究蛋白表达水平与某种疾病之间的关系,免疫荧光染色是必不可少的检测手段.
