拉莫三嗪治疗原发性三叉神经痛患者疗效及其对疼痛因子的影响
2019-03-25张红梅杜坚李燕宏刘爱东
张红梅,杜坚,李燕宏,刘爱东
原发性三叉神经痛(primary trigeminal neuralgia,PTN)为三叉神经支配区阵发性、短暂性、发作性剧痛,因其发病机制尚不清晰,目前尚无确切性治疗方法[1]。对于PTN的治疗,临床多选择手术及药物治疗,手术治疗尽管可解除患者疼痛,但常易发生切口感染、面神经功能失常、脑脊液漏等并发症,而安慰剂及普通镇痛药物治疗PTN也收效甚微,难以达到缓解患者疼痛的目的[2]。研究证明,抗癫痫类药物可缓解PTN患者疼痛,但因PTN常反复发作,长期使用抗癫痫药物极易对患者产生不良影响[3]。故选择疗效显著、安全性高的药物对于PTN的治疗无疑具有重要意义。 现观察拉莫三嗪治疗PTN疗效及其对β-内啡肽(β-endorphin,β-Ep)、血管活性肠肽(vasoactive intestinal peptide,VIP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)的影响,报道如下。
1 资料与方法
1.1 临床资料 收集2014年7月—2018年6月成都医学院第一附属医院神经内科治疗PTN患者118例,男51例,女67例;年龄39~72(55.65±6.48)岁;体质量指数(BMI)24.77~30.85(27.68±2.85)kg/m2;病程4个月~8年(5.17±0.54)年;病变部位:左侧65例,右侧53例;发病支数1~3(1.60±0.18)支;合并症:糖尿病30例,高血压38例,冠心病25例。118例患者依照随机数字表法分为对照组与拉莫三嗪组各59例,2组一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院伦理委员会审批通过,全部患者均知情同意并签署知情同意书。

表1 2组患者一般资料比较
1.2 选择标准 (1)纳入标准:符合“三叉神经痛诊疗中国专家共识”[4];2周内未使用本研究药物患者;肝肾功能及血尿常规正常患者。(2)排除标准:其他颅内病变患者;对本研究药物敏感患者;继发性患者;神经、精神病病史患者;自身免疫性疾病患者;药物依赖患者;血液系统疾病患者;重症心血管疾病患者;妊娠及哺乳期患者。
1.3 治疗方法 2组均给予抗感染、营养神经等常规治疗。在常规治疗基础上,对照组:奥卡西平(Novartis Farma SPA生产,规格0.3 g/片)0.3 g/次睡前口服,第1天;第2天,0.3 g/次早晚各1次;2 d后每隔3 d增加0.3 g/d,直至疼痛缓解后,再继续服用30 d,然后按照0.3 g/7 d逐渐减量,治疗90 d。拉莫三嗪组:拉莫三嗪( GlaxoSmithKline Pharmaceuticals SA生产,规格50 mg/片)起始剂量25 mg/d口服,然后每隔3天增加25 mg/d,直至300 mg/d, 治疗90 d。
1.4 观察指标与方法
1.4.1 焦虑、抑郁及睡眠评分:分别以SAS量表、SDS量表[5]进行焦虑、抑郁评分,量表均包括20项,分别按偶尔或从无、有时、经常、总是(对应1、2、3、4分)进行评分,得分越低说明焦虑、抑郁越轻微;以匹兹堡睡眠指数(PSQL)[6]评价睡眠情况,PSQL包括7个项目18个条目,每个项目0~3个等级,每个等级1分,总分0~21分,得分越高,表示睡眠质量越差。
1.4.2 健康状况评分:以SF-36调查问卷[7]进行,其包括8项,每项0~100分,得分越高,健康状况越好。
1.4.3 疼痛视觉模拟评分(VAS)[8]: 取标有10个刻度的长10 cm直尺,分别代表“0~10分”,0分代表无痛,10分代表剧痛,让患者在直尺上标出能代表自己疼痛程度的位置,由医生进行评分。
1.4.4 血清疼痛因子检测: 分别于治疗前后抽取空腹肘静脉血5 ml,以Microfuge 20型离心机(贝克曼库尔特生产)离心,取血清保存于冰箱(-20℃)待测,以放免法检测血清β-Ep、VIP,以ELISA检测血清TNF-α、IL-1β,试剂盒购自于上海酶联生物研究所。
1.5 疗效评价标准[9]显效:睡眠无影响,VAS评分等于0;好转:睡眠无影响,VAS评分降低>2/3;缓解:睡眠略受影响,VAS评分降低1/2~2/3;轻度缓解:睡眠较受影响,VAS评分降低1/4~<1/2;无效:严重影响睡眠,VAS评分未见降低或增加。总有效=(显效+好转+缓解)/总例数×100%。

2 结 果
2.1 临床疗效比较 拉莫三嗪组总有效率为89.83%,显著高于对照组的69.49%(P<0.01),见表2。
2.2 SAS、SDS、PSQL评分比较 治疗前,2组 SAS、SDS、PSQL评分比较差异无统计学意义(P>0.05);治疗后,2组SAS、SDS、PSQL评分均降低,拉莫三嗪组较对照组降低更明显(P<0.01),见表3。
2.3 健康状况评分比较 治疗前,2组健康状况各维度评分比较差异无统计学意义(P>0.05);治疗后,2组健康状况各维度评分均高于治疗前,拉莫三嗪组均高于对照组(P<0.01),见表4。
2.4 VAS 评分比较 治疗前,拉莫三嗪组与对照组VAS评分比较差异无统计学意义(8.78±0.91 vs. 8.75±0.89,P>0.05);治疗后,2组VAS评分分别为(2.79±0.30)分和(1.75±0.19)分,与治疗前比较均降低(t/P=48.018/0.000、59.082/0.000),拉莫三嗪组降低较对照组更明显(t/P=22.496/0.000)。
2.5 血清疼痛因子比较 治疗前,2组血清β-Ep、VIP、TNF-α、IL-1β水平比较差异均无统计学意义(P>0.05);治疗后,2组β-Ep水平均高于治疗前,VIP、TNF-α、IL-1β水平均低于治疗前,拉莫三嗪组变化幅度均大于对照组(P<0.01),见表5。
2.6 不良反应比较 拉莫三嗪组不良反应发生率为22.03%(13/59),对照组为5.08%(3/59),2组比较差异有统计学意义(χ2=7.169,P<0.01),见表6。

表2 2组患者临床疗效比较 [例(%)]
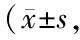
表3 2组患者SAS及SDS评分比较分)
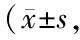
表4 2组患者健康状况评分比较分)

表5 2组患者血清疼痛因子比较

表6 2组患者不良反应率比较 [例(%)]
3 讨 论
作为神经性疼痛,PTN反复发作的剧痛常易使患者产生强烈的心理应激,引发患者焦虑、抑郁等负性情绪,促进生成儿茶酚、皮质醇等应激激素,导致神经损伤,加重疼痛,提高发作频率[10]。解除疼痛可缓解患者心理应激,抑制分泌儿茶酚、皮质醇等应激激素,避免神经损伤,缓解患者疼痛,促进良性循环[11]。此外,解除疼痛还可经多种激素及神经介质路径抑制嗜酸性粒细胞等细胞功能,提高中性粒细胞活性,在减少分泌炎性因子的同时促进清除炎性因子,避免神经炎性损伤[12]。
在本研究中,治疗后拉莫三嗪组患者VAS、SAS、SDS、PSQL评分、不良反应发生率低于对照组,健康状况评分、总有效率高于对照组,提示拉莫三嗪有助于缓解患者焦虑、抑郁心理,改善睡眠,提高治疗效果,且较为安全,有利于改善患者生命质量。奥卡西平可阻断钠通道,降低神经细胞膜及突触的活性,避免神经异常放电,解除患者疼痛[13];但因奥卡西平常易产生嗜睡、头晕等并发症,不宜长期应用于PTN的治疗[14]。拉莫三嗪为Na+通道阻滞剂,研究表明,可经减少电压差的路径阻滞Na+通道,抑制Na+传递,拮抗三叉神经反复持续异常放电[15];同时,其可抑制机体病理性分泌谷氨酸,阻滞谷氨酸导致的动作电位爆发[16]。拉莫三嗪半衰期约为24~35h,其代谢产物多以葡萄糖醛酸结合物的形式经尿液排出,故其作用持久,不易发生不良反应。本研究结果还显示,治疗后2组血清β-Ep、VIP、TNF-α、IL-1β等疼痛因子显著降低,且拉莫三嗪组低于对照组,表明拉莫三嗪可抑制疼痛因子生成,缓解患者疼痛,这与拉莫三嗪具有抑制生成疼痛因子的作用直接相关。国内学者周圣军等[17]的相关也研究显示,与奥卡西平比较,拉莫三嗪治疗原发性三叉神经痛能获得更佳的疗效且不良反应少,可降低患者的疼痛程度。疼痛因子是导致PTN的重要因素,β-Ep、VIP、TNF-α、IL-1β等均为疼痛因子,在引发并推动PTN进展中具有重要作用[18]。作为内源性阿片肽,β-Ep可调控疼痛信息,抑制疼痛信息经疼痛通道传递[19]。β-Ep可抑制释放P物质,避免P物质间接或直接促进释放氨基酸,抑制痛觉传递,缓解疼痛[20]。VIP为μ-阿片受体激动剂,可特异性作用于μ-阿片受体引发疼痛。VIP可促进血管扩张,促进释放并募集炎性因子,导致神经源性炎性反应[21]。TNF-α可促进小型胶质细胞分泌HMGB1蛋白,并促进其mRNA的表达。HMGB1蛋白为晚期炎性因子,可导致神经细胞损伤[22]。研究证明,低水平TNF-α即可作用于伤害性神经细胞膜,促进Na+、Ca2+内流,导致该类细胞异常放电,导致疼痛,若TNF-α水平升高则可导致显著的痛觉过敏[23]。IL-1β可诱发星形胶质细胞及成纤维细胞增殖,促进释放多种炎性因子,导致神经损伤[24];诱导机体合成组胺及前列腺素,导致神经炎性反应[25];IL-1β还可激活神经细胞NMDA受体,引发神经病理性疼痛[26]。
综上所述,拉莫三嗪治疗PTN可抑制疼痛因子生成,缓解或解除患者疼痛,疗效显著,作用持久,安全可靠,可应用于PTN患者的临床治疗。
利益冲突:无
作者贡献声明
张红梅、杜坚:提出研究思路,设计研究方案,实施研究过程,论文撰写与修改;李燕宏、刘爱东:收集并分析试验数据,进行统计学分析,论文审核
