小鼠皮肤切创愈合过程中膜联蛋白A1的表达
2019-03-22金馨赵建新姚艺黄俊杰范琰琰喻林升
金馨 ,赵建新 ,姚艺 ,黄俊杰 ,范琰琰 ,喻林升
(1.温州医科大学法医学系,浙江 温州325035;2.温州医科大学司法鉴定中心,浙江 温州325035;3.温州医科大学司法鉴定科学技术研究所,浙江 温州325035)
膜联蛋白是起源于钙依赖性磷脂结合蛋白的超家族,其在结构上均具有由四个重复的60~70个氨基酸组成的保守中心结构域和承担独特功能的N端结构域[1]。膜联蛋白 A1(annexin A1,ANXA1),又称为依钙蛋白、磷脂酶A2抑制蛋白,是该家族中第一个被发现的成员,在机体多数器官、组织中广泛存在。有研究[2-4]表明,ANXA1存在于单核细胞、中性粒细胞等炎症相关细胞中,在体内具有抗炎症作用,参与炎症过程的调控。ANXA1可以诱导抗炎因子产生,抑制磷脂酶A2活性,以及环氧合酶-2(cyclooxygenase-2,COX-2)和一氧化氮合酶的形成,阻止花生四烯酸等炎症介质的合成和释放,抑制中性粒细胞的活性和游出等[5]。ANXA1也能促进凋亡细胞的清除,避免凋亡细胞转化成坏死细胞引发炎症反应[6]。此外,ANXA1也是血管内皮生长因子(vascular endothelial growth factor,VEGF)介导的内皮细胞迁移和血管生成的重要调节剂[7]。
皮肤创口愈合是一个复杂的过程,涉及炎症反应、成纤维细胞增殖和组织重塑[8],而愈合过程中相关生物学指标的改变可以为推断损伤时间提供良好的参考依据。本研究检测ANXA1在小鼠皮肤创口模型中的时序性表达和分布特征,旨在探讨ANXA1在创口愈合中的作用及其在创口形成时间推断中的参考价值。
1 材料与方法
1.1 样本
清洁级健康雄性C57BL/KsJ小鼠45只,年龄8~10周,体质量30~35g,由南京生物医药研究院提供。
本实验经温州医科大学伦理委员会审核通过,符合《实验动物 福利伦理审查指南》[9]要求,尽量减少使用的动物数量和可能遇到的任何痛苦。
1.2 试剂
抗ANXA1抗体(ab137745,美国Abcam公司),兔二步法试剂盒(兔聚合物法检测系统,PV-6001,北京中杉金桥生物技术有限公司),辣根过氧化物酶标记山羊抗兔IgG(H+L)(orb229657,英国Biorbyt公司),Immobilon-P卷膜(IPVH00010,德国Merk Millipore公司),RIPA裂解液(强)(P0013B)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF) 100 mmol/L(ST506)、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶配置试剂盒(P0012A)及聚氰基丙烯酸正丁酯(butyleyanoacrylate,BCA)蛋白浓度测定试剂盒(P0010)均购自上海碧云天生物技术有限公司。
1.3 损伤模型制作
40只小鼠(实验组)背部剃毛,75%乙醇溶液消毒后,在乙醚麻醉下于背部中央做皮肤全层纵行切口,长度为1cm,不包扎及用药。切创后分笼饲养,自由进食和饮水,光照12h/d,保证环境清洁,防止创口感染。分别于切创后6h、12h、1d、3d、5d、7d、10d、14d随机选5只小鼠脱颈椎处死,以创口为中心,取创口及周边处2.0cm×1.5cm大小的皮肤。5只小鼠(对照组)不做切创处理,脱颈椎处死后直接取相同部位同等大小皮肤。沿垂直创口方向将每组样本平均分成三份,分别用于制作石蜡切片、蛋白质印迹分析、冰箱中备用(-80℃)[10]。
1.4 切片制备及染色观察
将小鼠皮肤放入由磷酸盐缓冲液(phosphate buffer saline,PBS)配制的4%多聚甲醛(paraformaldehyde,PFA)溶液中固定12 h后,经大量清水冲洗,乙醇脱水,二甲苯透明,石蜡包埋,制成5mm厚度连续切片,烘干后放于冰箱4℃保存。
1.4.1 常规苏木素-伊红染色
切片65℃烤片,二甲苯脱蜡,梯度乙醇水化,苏木素染色5min,1%盐酸-乙醇分化3s后自来水返蓝30min,1%伊红染色,梯度乙醇脱水,二甲苯透明,中性树胶封片。在光学显微镜下观察创口的组织学形态。
1.4.2 免疫组织化学染色
切片常规脱蜡水化,3%H2O2孵育10min去除内源性过氧化物酶,微波热修复法修复抗原,使用5%小牛血清在37℃烘箱内孵育30 min,抗ANXA1抗体(1∶1000)作为一抗4℃过夜,使用兔二步法试剂盒在37℃烘箱内孵育30min,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素染核。以PBS代替一抗作空白对照。在显微镜下观察,ANXA1阳性染色显示为棕黄色,每张切片在创口及其周边区内随机选择10个视野,计算其中ANXA1阳性染色细胞数与募集细胞总数的比值。
1.5 蛋白质印迹分析
将各时间段的皮肤样本分别剪碎,加VRIPA∶VPMSF=50∶1的混合液300 μL,组织匀浆,全程冰上操作。于冰上静置20 min后,在4℃下以离心半径10 cm,12000r/min,离心10min,吸取上清液,重复离心2次,用BCA法测量蛋白浓度后将样品置于-80℃保存。于提取的蛋白样本内加入5×蛋白上样缓冲液,金属浴100℃变性10 min,上样总蛋白量为30 μg。用10%SDS-PAGE分离蛋白,再将蛋白转印到Immobilon-P卷膜上,转膜条件为250mA、50min。含有吐温的Tris缓冲盐溶液(Tris-buffered saline tween,TBST)洗涤3次,用5%脱脂牛奶封闭2 h,用抗ANXA1抗体(1∶5 000)孵育4℃过夜。TBST洗涤3次,辣根过氧化物酶标记山羊抗兔IgG使用TBST稀释(VIgG∶VTBST=1∶5000)室温孵育2h,TBST洗涤3次后,用电化学发光免疫测定法(electrochemiluminescence immunoassay,ECLIA)显现蛋白条带。用Scion Image 4.0软件(美国Scion公司)分析各时间段条带的光密度值,以β微管蛋白(β-tubulin)作为内参,计算各组ANXA1蛋白的相对表达量。
1.6 统计学分析
所有数据采用SPSS 19.0进行统计学分析,蛋白表达相对水平采用±s表示,细胞阳性率用百分率表示。ANXA1表达量的组间比较采用单因素方差分析,检验水准α=0.05。
2 结 果
2.1 苏木素-伊红染色和免疫组织化学染色
与对照组(图1A)相比:中性粒细胞于伤后6h开始出现在创口的周围,伤后12h增多(图1B),于伤后3 d开始减少。单核细胞于伤后1 d聚集于伤口的边缘,其数量于伤后3 d达到峰值(图1C)。成纤维细胞于伤后3 d开始出现在伤口底部,于伤后5 d增多(图1D),伤后7d达到峰值。肉芽组织形成于伤后5~10 d,其内可见成纤维细胞和丰富的新生毛细血管(图1E);在伤后10~14d,表皮完全覆盖创口,肉芽组织开始向瘢痕组织转变,可见新生毛细血管和成纤维细胞数量减少,间质增多(图1F)。
在免疫组织化学染色中,对照组皮肤的表皮、毛囊(图2A)、皮脂腺、血管内皮表现出ANXA1阳性染色,未见假阳性染色。在实验组的皮肤切创及周边区,ANXA1的阳性染色在伤后6~12 h主要出现在中性粒细胞和少量单核细胞中,在伤后1~3d主要出现在单核细胞中(图2B),而在伤后5~10d,其阳性表达主要出现在新生毛细血管内皮、成纤维细胞和少量单核细胞中(图2C~D)。伤后14 d,新生的表皮及少量成纤维细胞仍有ANXA1阳性表达。
从ANXA1阳性细胞数与所募集到的细胞总数的比值上看:在伤后6h~7d,与对照组相比,实验组的阳性细胞率显著增加(P<0.05);在伤后6h~3d,ANXA1阳性细胞数与细胞总数的比值超过了40%,且在1 d时达到峰值,超过了60%(表1)。
表1 ANXA1在对照组和实验组中的阳性细胞率(n=5,±s,%)
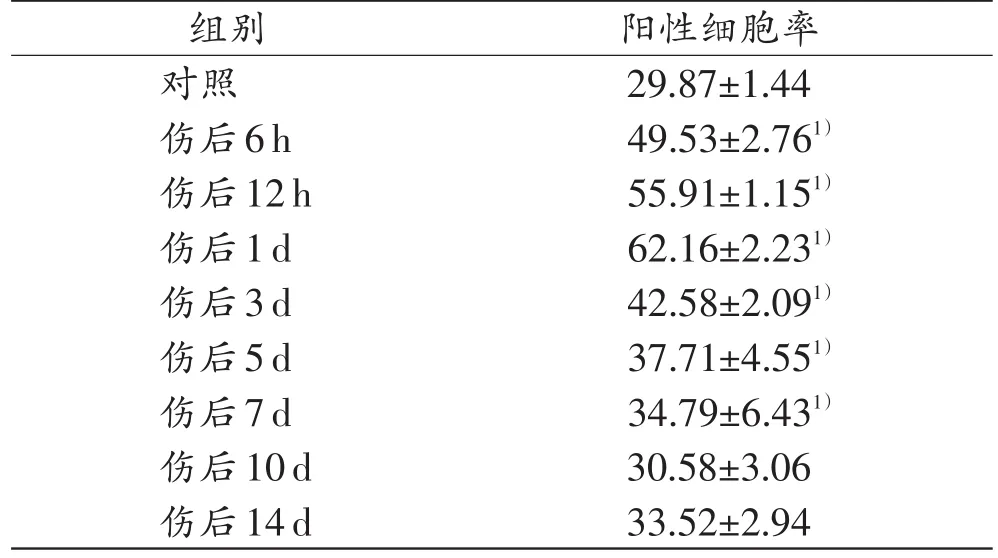
表1 ANXA1在对照组和实验组中的阳性细胞率(n=5,±s,%)
注:1)与对照组比较,P<0.05
阳性细胞率29.87±1.44 49.53±2.761)55.91±1.151)62.16±2.231)42.58±2.091)37.71±4.551)34.79±6.431)30.58±3.06 33.52±2.94组别对照伤后6h伤后12h伤后1d伤后3d伤后5d伤后7d伤后10d伤后14d
2.2 蛋白质印迹结果
图3和表2结果表明,在对照组和实验组均有ANXA1条带,于损伤后6h开始上升,在1d时达到高峰,之后逐渐下降。实验组与对照组的相对值单因素方差分析显示,实验组ANXA1在6h~3d的表达与对照组相比差异有统计学意义(P<0.05)。另外,ANXA1相对于β-tubulin的表达强度,在伤后6 h时,与对照组相比数值明显上升(P<0.05),在1d时达到峰值,超过了1.0,在其他时间段内,蛋白相对表达强度均低于1.0。
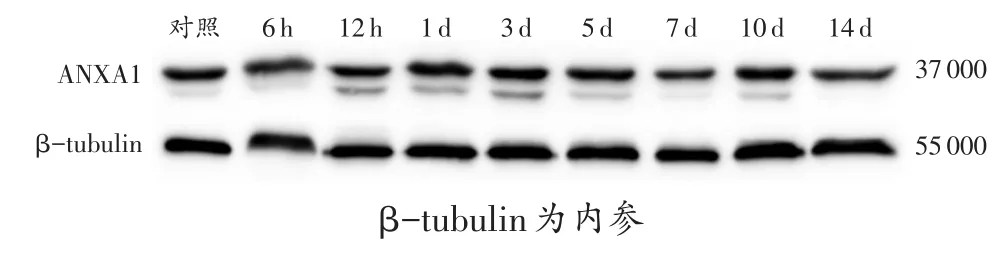
图3 各时间段ANXA1的蛋白质印迹结果
表2 ANXA1在对照组和实验组中的蛋白相对表达量(n=5,±s)
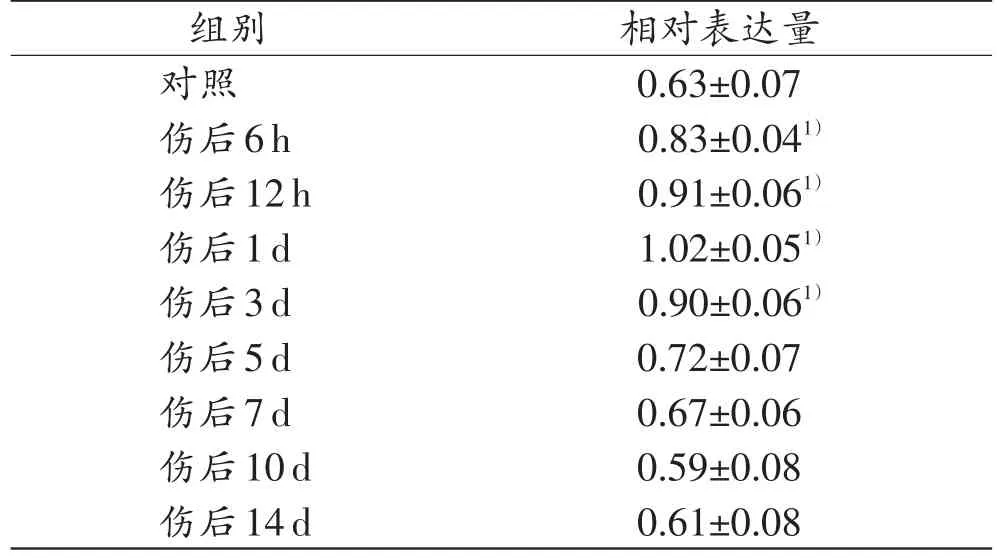
表2 ANXA1在对照组和实验组中的蛋白相对表达量(n=5,±s)
注:1)与对照组比较,P<0.05
相对表达量0.63±0.07 0.83±0.041)0.91±0.061)1.02±0.051)0.90±0.061)0.72±0.07 0.67±0.06 0.59±0.08 0.61±0.08组别对照伤后6h伤后12h伤后1d伤后3d伤后5d伤后7d伤后10d伤后14d
3 讨 论
ANXA1是位于细胞质的钙和磷脂结合蛋白,由348个氨基酸组成,其N端结构域具有酪氨酸和丝氨酸激酶的磷酸化位点以及糖基化和转谷氨酰胺位点。当细胞活化后,ANXA1可以通过自分泌和旁分泌机制分泌到胞外[11]。ANXA1是糖皮质激素抗炎症作用中的重要介质,糖皮质激素可以通过上调ANXA1的表达来抑制细胞的黏附作用及中性粒细胞的迁移[2,12-13],同时ANXA1也是参与内源性抗炎症途径的重要调节分子。ANXA1的抗炎症作用主要通过甲酰基肽受体(formyl peptide receptor,FPR)信号通路实现调控。ANXA1及其N端活性片段Ac2-26可以作为激动剂来激活FPR2,调节丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和T细胞受体信号通路,抑制激活蛋白1(activator protein 1,AP1)、核因子-κB(nuclear factor-kappa B,NF-κB)和活化T细胞的核因子(nuclear factor of activated T cell,NFAT)等的活性,从而抑制促炎性细胞因子的作用以及增加抗炎症因子合成[2]。
本研究免疫组织化学染色结果显示,ANXA1在各组样本的表皮、毛囊、皮脂腺、血管内皮均表现出阳性,与SAITO等[14]的实验结果一致,提示ANXA1可能参与了皮肤稳态的调节。各实验组和对照组相比,ANXA1的细胞阳性率显著增高,于伤后1d达到峰值。伤后6 h~1 d,ANXA1在浸润的中性粒细胞和单核细胞呈现较高的阳性率。MORAND等[15]通过流式细胞术研究了人类白细胞亚群中ANXA1的存在,发现在单核细胞和中性粒细胞中ANXA1含量最高,在淋巴细胞含量最低。PERRETTI等[2,16]研究发现,在人和小鼠的中性粒细胞、单核细胞和巨噬细胞的细胞质中含有高水平的ANXA1。本实验结果与以上研究一致,表明ANXA1在中性粒细胞和单核细胞中高表达。既往研究结果[17]显示,炎症开始后,中性粒细胞和单核细胞相继进入炎症区域,释放促炎性细胞因子并激活抗炎症反应。因此,综上研究结果提示,ANXA1可能参与到皮肤创口愈合炎症反应的调控。
此外,本研究结果显示,ANXA1的细胞阳性率于伤后3d开始下降。伤后3d的损伤周围仍可见较多单核细胞表达ANXA1,伤后5~14d的损伤周围ANXA1主要表达于成纤维细胞。从法医病理学应用的角度,ANXA1在创口愈合中的表达呈现一定的时间规律性,可用于损伤时间的推断。伤后6h~3d,细胞阳性率大于40%;伤后12 h~1 d,细胞阳性率大于55%;伤后1d,细胞阳性率大于60%。为了进一步明确ANXA1表达的时序性变化,本研究使用蛋白质印迹法检测了其蛋白表达的相对水平。ANXA1蛋白表达水平与其细胞阳性率变化趋势基本一致,于伤后1 d达到峰值。本研究提示,ANXA1表达的时间规律性可为皮肤创口形成时间的推断提供参考依据,有望成为一种用于推断创口形成时间的生物学指标。
在法医学鉴定实践中,损伤时间的准确推断可以为判断案情提供线索和依据。近年来,寻找与损伤时间具有良好相关性的指标成为法医学研究的热点。经研究[18]证实,参与皮肤创口愈合的一些细胞因子可用于创口形成时间的推断。如白细胞介素(interleukin,IL)1a的细胞阳性率大于30%提示损伤时间为4h~1d,IL-8的细胞阳性率大于50%提示损伤时间为1~4d,人单核细胞趋化蛋白-1(human monocyte chemoattractant protein-1,MCP-1)的细胞阳性率大于30%提示损伤时间为1~7 d,巨噬细胞炎性蛋白1α(macrophage inflammatory protein 1α,MIP-1α)的细胞阳性率大于40%提示损伤时间为1~9d,VEGF的细胞阳性率大于50%提示损伤时间为7~14 d,氧调节蛋白150(oxygen regulated protein-150,ORP-150)的细胞阳性率大于40%提示损伤时间为7~21d。此外,基质金属蛋白酶2(matrix metalloprotein 2,MMP2)和MMP9、CC趋化因子配体2(CC chemokine ligand 2,CCL2)和CCL3、IL-1b和IL-6以及肿瘤坏死因子(tumor necrosis factor α,TNFα)的mRNA水平的时序性变化也有助于损伤时间的推断[19]。本研究发现,ANXA1在皮肤损伤后的炎症阶段广泛表达于中性粒细胞和单核细胞,适合于创伤早期的创口形成时间的推断,尤其是1d左右的创口损伤时间的推断。因此,综合检测多种细胞因子及ANXA1的表达,可以进一步增加皮肤创口形成时间推断的精确性,缩小损伤时间推断的误差。但本研究结果基于易受控制的动物实验,仅提供了ANXA1可用于创口形成时间推断的实验依据。后续还应在实际检案中搜集不同时间的创口样本,检测ANXA1的表达,以探究ANXA1在实际检案中的适用性。
