外源SA对葡萄叶片抗氧化酶活性的影响
2019-03-22,,,*
,,,*
(1.山西省农科院果树研究所,山西 太谷 030815; 2.山西农业大学园艺学院,山西 太谷 030801)
水杨酸(Salicylic acid,SA),即邻羟基苯甲酸,是一种植物体内产生的简单酚类化合物。研究表明,SA可诱导植物体内病程相关蛋白基因的表达及系统抗病性的获得[1],是植物抗病反应的信号分子和诱导植物对非生物逆境反应的抗逆信号分子[2],而且在植物生长、发育、成熟、衰老调控及抗逆诱导等方面,也具有广泛的生理作用。
在逆境条件下,植物体内代谢失调,活性氧和自由基含量升高[3],而超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等是植物体内清除活性氧重要的保护酶,避免了自由基对有机体的攻击和伤害,尤其是生物膜[4]。丙二醛(MDA)是膜脂过氧化作用的终产物之一,其含量的高低是反映脂质过氧化作用强弱的一个重要指标。此外,MDA还可与膜上的蛋白质、酶等结合,引起蛋白质分子内和分子间的交联,使之失活,破坏生物膜的结构和功能,从而使生物表现出伤害状态[5]。SOD、POD、CAT能够抑制逆境引发的丙二醛(MDA)积累[6],从而维持细胞的稳定和完整,提高对逆境的适应性。因此,保护酶活性的高低及MDA的含量在一定程度上反映植物的耐逆境的能力[7]。
黄爱霞和佘小平[8]发现,SA能够提高SOD、POD的活性减缓膜脂中过氧化产物MDA积累,从而提高了黄瓜幼苗的抗低温能力。宋士清等[9]研究表明,外源SA能够显著增强SOD、POD和CAT等保护酶活性,降低黄瓜的盐害指数,MDA含量和电解质渗漏率,从而诱导黄瓜幼苗的抗盐能力。王伟英等[10]研究SA处理能够提高水仙叶片中SOD和CAT的活力,对衰老过程中产生的活性氧起到有效的清除作用。王丽等[11]研究外源SA能明显提高葡萄幼苗在抗寒锻炼期间根、茎中SOD,POD活性,降低质膜相对透性和MDA含量,增强了幼苗的抗寒性,且1.00 mmol/L SA处理表现最为明显。詹妍妮等[12]研究认为:外源SA和热锻炼都能显著降低膜脂过氧化水平,在喷施100 μmol/L SA后,叶肉细胞的MDA和O2-含量显著降低,膜脂相对透性减小,保护酶系SOD、CAT活性都明显升高。上述研究表明,SA能够诱导SOD、POD、CAT活性的增强,抑制MDA积累,从而诱导植物抗逆性的产生。
本试验通过外源喷施SA,阐明SA对葡萄叶片SOD、CAT活性及MDA含量的影响,为采用SA提高植物抗逆性提供理论依据。
1 材料与方法
1.1 试验材料
试材为长势良好、土壤和管理条件一致的15株赤霞珠葡萄,分为5组,选择植株中上部位成熟叶片进行标记,对植株进行SA处理,浓度分别为0.00 mmol/L、0.50 mmol/L、1.00 mmol/L、2.50 mmol/L、5.00 mmol/L,喷施时间为上午8时,在叶片表面不再湿润时开始计时,分别在30 min,60 min,90 min,120 min采样。
1.2 试验试剂与用具
试验试剂主要有:三氯乙酸(TCA)、硫代巴比妥酸、磷酸氢二钠、磷酸二氢钾、甲硫氨酸、氮蓝四唑(NBT)、核黄素、EDTA、聚乙烯吡咯烷酮、磷酸二氢钠、 三羟甲基氨基甲烷(Tris)、浓盐酸、30%H2O2。
试验用具主要有:TV-1810紫外可见分光光度计、数显恒温水浴锅、离心机、制冰机、天平、研钵、试管、容量瓶、量筒、烧杯、玻璃棒、移液管、洗耳球、石英比色皿、温度计、离心管、移液枪、试管架、剪刀、镊子等。
1.3 试验方法
1.3.1 SOD活性测定 采用NBT光还原法,以抑制NBT光化学还原50%的酶量为1个酶活力单位。剪取0.1 g葡萄叶片,置于研钵中,加入1 mL 50 mM pH 7.8磷酸缓冲液,加少量石英砂,冰上研磨,做3份重复,分别转入1.5 ml离心管,12 000 rpm冷冻4℃离心15 min,取上清液供酶活测定。取17支大试管,各加入5 mL NBT反应液,从15份酶液中各取10 μL分别加入15支中,摇匀。另外2支为对照,1支对照管保存于暗处,作为参比;另1支对照管和15支样品管在25 ℃下光照20 min后,在560 nm波长下比色。样品酶活单位=[(照光对照管的吸光值-样品管的吸光值)×酶液提取液总体积]÷(1/2×照光对照管的吸光值×样品鲜重×测定时所用的酶液体积),样品酶活单位表示:SOD酶活单位/g FW。
1.3.2 CAT活性测定 采用紫外分光光度计法测定。称取葡萄叶片1.00 g 置于预冷的研钵中,加入5 ml(分两次加入)预冷的 pH 7.0 磷酸缓冲液和少量石英砂,冰浴研磨成匀浆后,转入 10 ml离心管中,在4 ℃、15 000 rpm下离心15 min,上清液即为过氧化氢酶粗提液。取4支10 ml试管,分别加 2 ml酶提取液于沸水浴中加热煮死,冷却备用。再取4支10 ml试管,3支为测定(3个重复),1支为对照,按要求加入试剂[Tris-HCl 1.0 ml,酶液 0.025 ml(对照组为煮死酶液),蒸馏水 1.7 ml]。然后将上述4支试管于25 ℃水浴中预热3 min,逐管加入 0.2 ml 200 mM 的 H202溶液,每加1管立即在紫外分光光度计上测定A240(蒸馏水调零),每隔30 s读数1次,共测3 min,记录4支试管的测定值。结果计算:以1 min内A240降低0.1(3支测定管的平均值)为1个酶活性单位(U),先求出3支测定管各自1 min内A240降低值,按下式计算CAT活性。CAT活性(U·g-1FW·min-1)=(ΔA240×Vt)÷(0.1×Vs×t×FW) 式中ΔA240=As0-(As1+As2+As3)÷3;As0:煮死酶液对照管吸光度;As1、As2、As3:样品测定管吸光度;Vt:酶提取液总体积(mL);FW:样品鲜重(g)。
1.3.3 丙二醛含量测定 称取0.4 g鲜重的叶片,加入少许石英砂和2 mL 0.1%三氯乙酸(TCA),充分研磨成匀浆后移到试管中,再用3 mL 0.1%三氯乙酸(TCA)分两次冲洗研钵,合并提取液,每个样作2个重复;在提取液中加入5 mL 0.5%的硫代巴比妥酸溶液,摇匀;将试管放入沸水浴中显色反应15 min,到时间后立即取出并放入冰浴中冷却至室温;冷却后转入10 mL离心管中3 000 rpm离心15 min,取上清液,测定其体积,以0.5%的硫代巴比妥酸溶液为参比,测532 nm和600 nm波长下的吸光值。结果计算:MDA含量(m mol/g FW)=[(532 nm吸光值-600 nm吸光值)×上清液总体积]÷[155×称取植物材料的鲜重]。
1.4 数据处理
采用Excel2003分析实验数据及绘制折线图、利用SAS进行方差数据分析。
2 结果与分析
2.1 外源SA对葡萄叶片SOD活性的影响
由图1可以看出,外源SA对叶片超氧化物歧化酶SOD影响比较明显,在处理后30 min到60 min时,各浓度处理都成上升趋势,尤其是0.50 mmol/L处理时增长趋势较好,且高于其他浓度的处理,60 min后低浓度处理组仍成上升趋势,高浓度2.5 mmol/L和5.00 mmol/L开始下降,在90 min后各处理组的叶片SOD活性都为下降趋势,说明外源SA对葡萄叶片SOD活性的影响先成上升然后下降的趋势,又由表1可知处理为0.50 mmol/L在60 min时对葡萄叶片SOD活性影响显著。

图1 外源SA对葡萄叶片SOD活性的影响
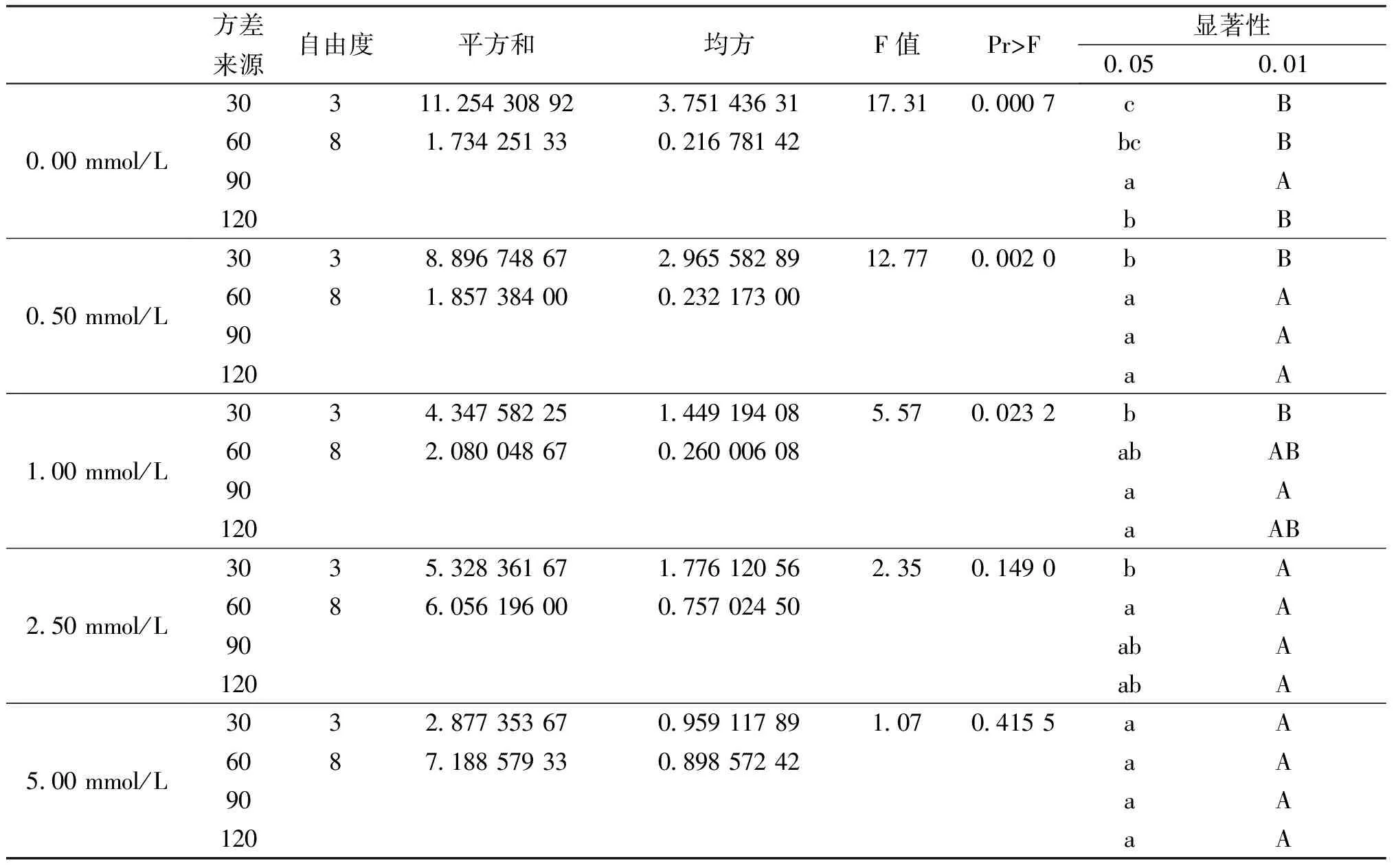
表1 SOD方差分析表Tab1. The analysis of variance of SOD
2.2 外源SA对葡萄叶片CAT活性的影响
由图2可以看出,外源SA处理后对葡萄叶片CAT活性呈现上升趋势,促进了活性氧自由基的清除,而且在较低浓度的SA处理对CAT的活性影响较大,增长较快,浓度过高时作用不明显,但在90 min后都有上升。在表2中可知0.50 mmol/L和1.00 mmol/L处理在120 min与对照相比差异显著。

图2 外源SA对葡萄叶片CAT活性的影响
2.3 外源SA对葡萄叶片丙二醛含量的影响
由图3可知外源SA处理叶片后对膜质过氧化产物MDA含量有一定的影响,呈现出下降的趋势,与对照组相比0.50 mmol/L处理组的MDA含量下降趋势较大,在处理后120 min时达到最低值。在表3中可以看出0.50 mmol/L处理组与对照组相比差异显著。
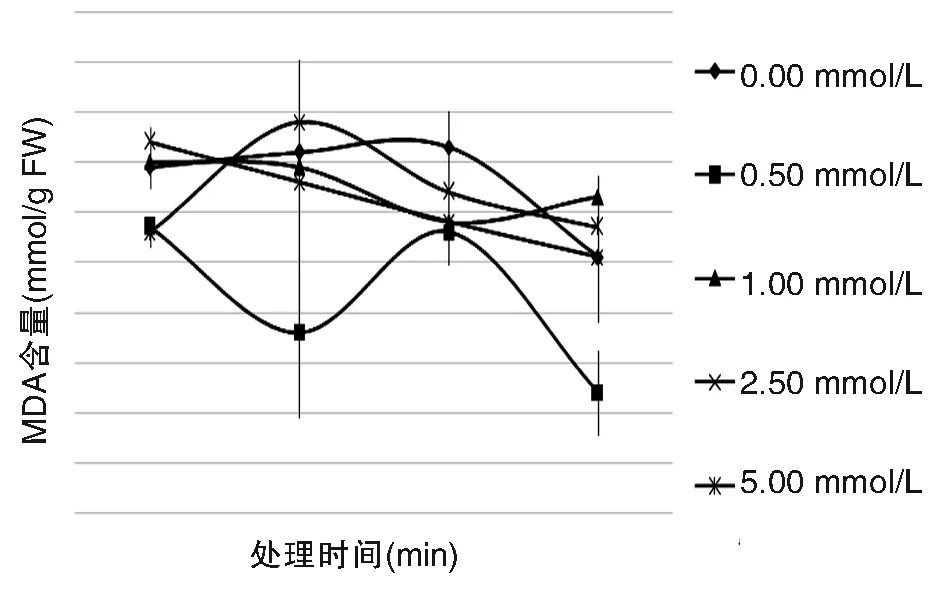
图3 外源SA对葡萄叶片MDA含量的影响
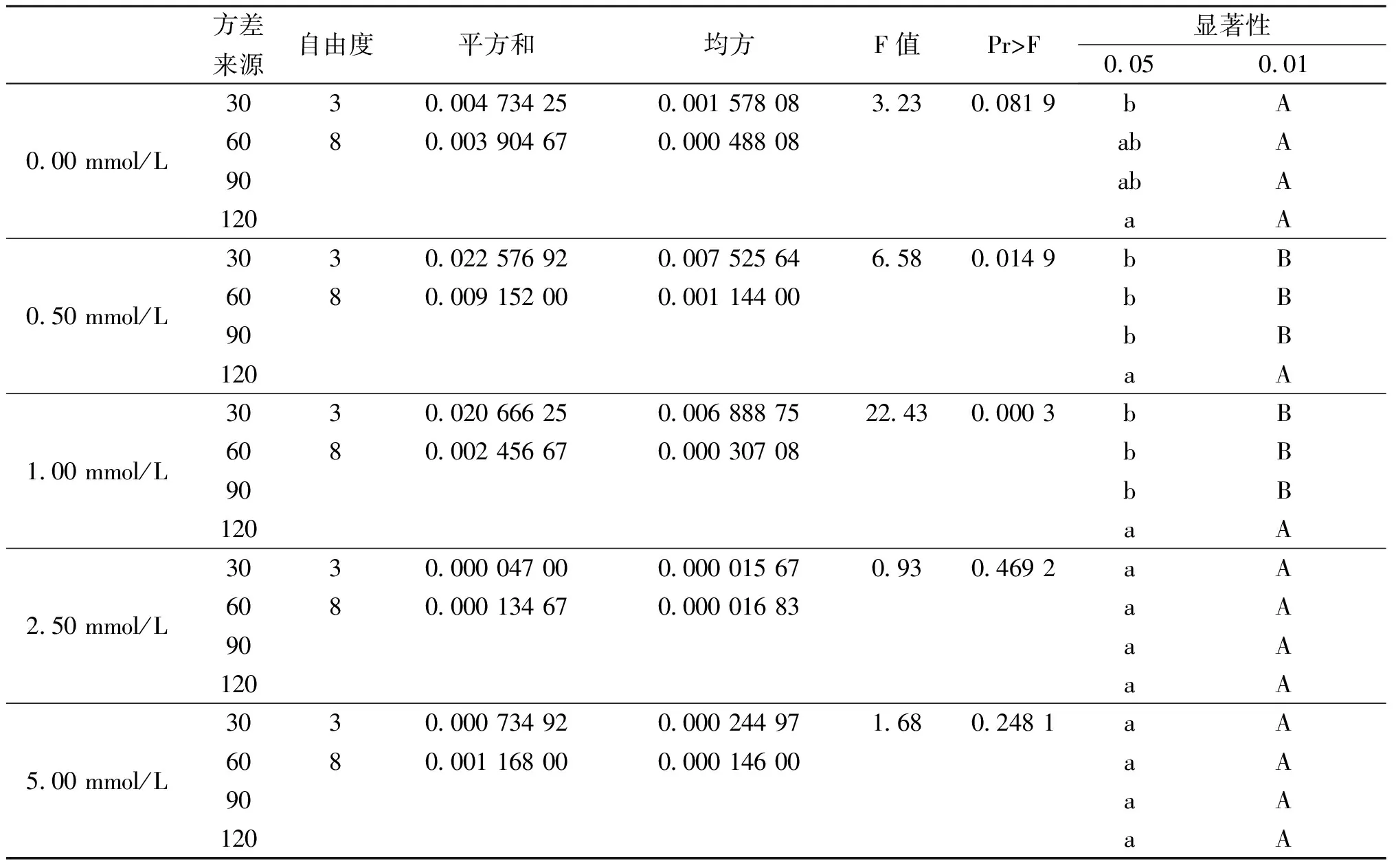
表2 CAT方差分析表Tab.2 The analysis of variance of CAT
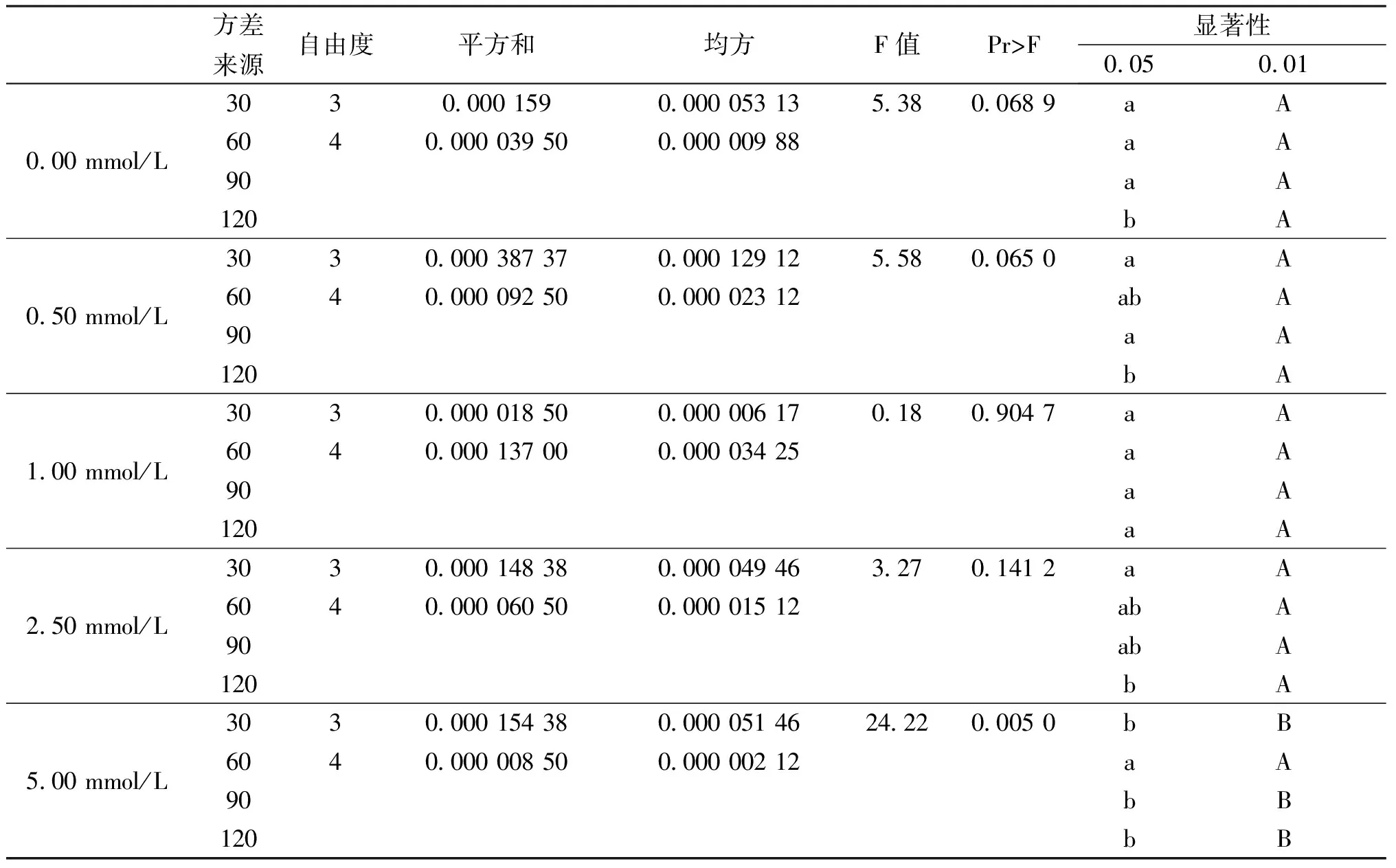
表3 MDA方差分析表
3 结论与讨论
本文通过外源喷施SA,以赤霞珠葡萄(VitisviniferaL.cv.Cabernet Sauvignon)为试材,对不同浓度SA处理后葡萄叶片SOD、CAT、MDA的变化情况进行了初步研究,得出以下结论:
1)外源喷施SA后,葡萄叶片SOD活性先增强,在处理后90 min开始下降,而且SA浓度在0.50 mmol/L时SOD活性变化比较显著。
2)外源喷施SA后,葡萄叶片CAT活性呈上升趋势,0.50 mmol/L和1.00 mmol/L处理后上升效果显著。
3)外源喷施SA后,葡萄叶片MDA含量变化有下降的趋势,且在0.50 mmol/L处理组下降幅度明显。
在正常条件下,植物体内活性氧的产生和清除处于动态平衡,而当处于逆境胁迫时,这一平衡被破坏而产生过多的自由基,植物为了适应进而继续生存逐渐进化出一套适应机制和策略,使自身免受逆境伤害,随即产生两种系统防止活性氧的危害:酶系统和非酶系统。植物的酶促防御系统包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)等,都具有清除自由基的能力,减轻膜质过氧化程度。前人研究[13-15]表明,外源SA可提高植物体内SOD活性,但SA对CAT活性的影响尚有争议,Dat等[16]报告,外源水杨酸培养烟草植株降低了CAT活性,此结果在拟南芥[17]马铃薯微植体[18]和葡萄[19]中得到证实。但Rao等[13]和李兆亮等[14]研究认为,SA对CAT活性无显著抑制作用;而何亚丽等[15]研究表明,0.5 mmol/L的水杨酸有提高高羊茅幼苗CAT活性的作用。詹妍妮等[12]用1年生赤霞珠葡萄幼苗喷施100 μmol/L的SA后,其叶肉细胞的CAT活性明显升高。在本实验中,对赤霞珠葡萄成熟叶片喷施0.50 mmol/L的SA后,其叶肉细胞的CAT活性也明显升高,进一步说明SA对CAT有促进作用。王利军等[20]研究表明,葡萄幼苗叶片喷施SA 1 h后,MDA含量就有显著降低,之后虽有增高,但直到喷后24 h,仍比未喷施的低,这与本实验结果相符。
