用于蛋白质组分析的两种马铃薯块茎蛋白质提取方法的比较
2019-03-22王润润王东霞张小微杨巧玲崔丹丹张俊莲程李香
王润润,王东霞,张小微,杨巧玲,崔丹丹,张俊莲,程李香
(1.甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070;2.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;3.甘肃农业大学农学院,甘肃 兰州 730070;4.甘肃农业大学园艺学院,甘肃 兰州 730070)
蛋白质组用于各种细胞、组织中蛋白质的研究.高分辨率的双向凝胶电泳(2-DE)技术已经普遍用于各种植物组织蛋白质的分离、分析以及鉴定.蛋白质的提取是2-DE分析和鉴定的关键步骤.植物组织中通常含有厚细胞壁、高浓度有机酸的液泡以及大量的次生代谢物如色素、酚复合物,这些物质严重干扰蛋白质的提取和分离.因此,从植物组织中制备高质量的蛋白质样品是一个巨大的挑战[1-2].最近研究结果表明,以苯酚提取法和TCA丙酮为基础改善后的蛋白质提取法能够有效地提高富含多糖、脂质和酚醛树脂复合物以及高纤维的植物组织中2-DE的分别率、清除非蛋白质的复合物、降低条纹的干扰[3-6].Lau等[7]采用苯酚/SDS结合醇酸铵沉淀法、 苯酚结合TCA/丙酮沉淀法和TCA/丙酮法提取植株叶绿体可溶性蛋白质,结果表明苯酚/SDS结合醇酸铵沉淀法提取的蛋白质产量最高,2-DE图谱的蛋白质点数目最多.Al-Obaidi等[8]利用酚提取法、三氯乙酸/丙酮沉淀与乙酸铵/甲醇沉淀相结合的方法提取灵芝防御相关蛋白质,结果表明酚提取法是最适的灵芝属蛋白质提取方法.此外,融入二甲基亚砜或者尿素缓冲液的TCA/丙酮提取玉米根的蛋白质较传统的TCA/丙酮沉淀法明显改善了2-DE图谱分辨率、增加了蛋白点数目[10-11].因此,改善蛋白质提取方法有利于植物蛋白质携带信息的获取.
马铃薯(SolanumtuberosumL.)块茎作为储藏器官具有细胞组织倍性一致的特点,是储藏器官蛋白质组研究的良好材料[12].但马铃薯块茎细胞中含有大量的多酚、醌类和糖类等次生代谢物质,用常规的蛋白质提取方法不易去除干净,不能有效提纯和分离块茎蛋白质,蛋白质样品的制备体系还不完善,双向电泳效果差,干扰大.为了深入研究马铃薯块茎蛋白质组,选择合适的马铃薯块茎总蛋白质提取方法是后续获得高质量的2-DE图谱的关键.本试验根据马铃薯块茎的特点,采用酚提取法和三氯乙酸/丙酮沉淀与乙酸铵/甲醇沉淀相结合的两步沉淀法提取马铃薯块茎蛋白质,进行2-DE分离,对差异表达蛋白质进行MALDI-TOF-MS质谱鉴定,探索适合马铃薯块茎蛋白质样品制备的最佳方法.
1 材料和方法
1.1 试验材料
马铃薯普通栽培种‘大西洋’的成熟块茎,采集于甘肃农业大学试验田,液氮速冻,于-80 ℃冰箱贮存备用.
1.2 主要试剂
IPG干胶条(Immobiline drystrip,pH3-10,17 cm)为Bio-Rad公司产品;丙烯酰胺(Acr)、过硫酸铵(APS)、甲叉双丙烯酰胺(Bis)、考马斯亮蓝G-250(CBB G-250)、二硫苏糖醇(DTT)、乙二胺四乙酸(EDTA)、甘氨酸(Glycine)、碘乙酰胺(IAA)、硫脲(Thiourea)、尿素(Urea)、三羟甲基氨基甲烷(Tris)、十二烷基磺酸钠(SDS)、低熔点琼脂糖、甘油、β-巯基乙醇、丙酮、醋酸铵、甲醇、溴酚蓝为Amresco公司产品;Tris-饱和酚为Solarbio公司产品.所有溶液和缓冲液均为Milli-Q水配制.
1.3 样品制备
1.3.1 粗蛋白提取 方法一:酚提取法 参照Al-Obaidi等[8]的方法略有改动.称取2 g马铃薯块茎,液氮研磨后,加入12 mL提取缓冲液(0.7 mol/L Sucrose,500 mmol/L Tris,30 mmol/L HCl,100 mmol/L KCl,50 mmol/L Ascorbic acid,2 mmol/L PMSF,pH 8.0),冰浴30 min,4 ℃下12 000g离心15 min.取上清,加入15 mL Tris平衡酚,涡旋10 min,4 ℃下6 000g离心15 min.收集酚相加入5倍体积的0.1 mmol/L乙酸铵/甲醇溶液,-20 ℃沉淀过夜.4 ℃下12 000g离心10 min.沉淀加1 mL水悬浮,再加6 mL乙醇,-20 ℃沉淀过夜.沉淀加5 mL还原缓冲液 (8 mmol/L Urea,200 mmol/L Tris,2 mmol/L EDTA,20 mmmol/L DTT,pH 8.0),溶解1 h后加入250 μL 0.5 mmol/L Tris,黑暗静置30 min后加6倍体积的乙醇,4 ℃下12 000g离心10 min,沉淀经真空干燥,得到的粗蛋白质粉末进行称质量后,于-80 ℃保存备用.
方法二:两步沉淀法 第一步沉淀为三氯乙酸/丙酮沉淀,根据Karppinen等[13]和Wang等[14]的方法略有改动.称取2 g马铃薯块茎,液氮研磨后,加入10 mL提取缓冲液(50 mmol/L Tris-HCl,25 mmol/L EDTA,500 mmol/L Thiourea,2 mmol/L PMSF,0.07% β-巯基乙醇,pH 8.0),冰浴30 min,4 ℃下12 000g离心15 min.收集上清液,加入5倍体积预冷丙酮.涡旋振荡后,-20 ℃沉淀过夜.4 ℃下12 000g离心20 min,沉淀重悬于等体积预冷丙酮溶液2次.4 ℃下12 000g离心15 min.第二步沉淀为乙酸铵/甲醇沉淀,根据Koistinen等[15]的方法略有改动.第一步沉淀样品加6 mL 0.1 mmol/L Tris-HCl提取缓冲液 (pH8.0),涡旋后4 ℃静置20 min,加入等体积的水饱和酚,轻摇10 min.15 ℃下12 000g离心15 min,收集酚层溶液,加入12 mL 0.1 mmol/L乙酸铵/甲醇溶液.-20 ℃沉淀过夜.4 ℃下12 000g离心10 min.沉淀加入10 mL预冷丙酮溶液,涡旋振荡后-20 ℃下静置20 min.4 ℃下12 000g离心5 min,重复该步骤2遍.沉淀经真空干燥,得到的粗蛋白质粉末进行称质量后,于-80 ℃保存备用.
1.3.2 蛋白质提取 称取粗蛋白质干粉10 mg,以1∶20(mg/μL)加入样品裂解液.涡旋振荡后于30 ℃水浴2 h.4 ℃下12 000g离心15 min,上清液即为待分析的蛋白质溶液,于-80 ℃保存用于双向电泳分析.
1.4 蛋白质定量
以牛血清白蛋白质为标准蛋白绘制标准曲线.取待分析上清液与蛋白试剂反应5 min,595 nm波长下测定吸光值,计算蛋白质浓度.
1.5 双向凝胶电泳及2-DE图谱分析
取含950 μg蛋白质的上清液,用水化上样缓冲液[7 ∶ Urea,2 ∶ Thioure,0.3% (w/v) DTT,2% (w/v) CHAPS,2% (v/v) Triton X-114,0.5% (v/v) IPG缓冲液,0.002% (w/v)溴酚蓝]补至350 μL,充分混匀,4 ℃下12 000g离心10 min,进行IEF上样.将聚焦完成的胶条取出,置于含1% DTT或4%碘乙酰胺的平衡缓冲液[6 ∶ Urea,1.5 ∶ Tris-HCl,2% (w/v) SDS,20% (v/v)甘油,pH 8.8]各5 mL分别平衡15 min.待其平衡后,采用12%分离胶进行第二向SDS-PAGE电泳.电泳结束后,CBB染色液染色20 h,去离子水浸泡脱色至背景清晰.凝胶采用UMAX Magicscan扫描仪扫描,光学分辨率300 dpi(Dot per inch),保存为数字图像.采用PDQuest 8.0.1软件,对酚提取法和三氯乙酸/丙酮沉淀与乙酸铵/甲醇沉淀相结合的两步沉淀法提取得到的蛋白质凝胶图像进行匹配分析.标记并切取差异表达的蛋白质点进行MALDI-TOF/TOF-MS分析.
1.6 数据处理
运用SPSS 19.0软件对试验数据进行统计分析.
2 结果与分析
2.1 蛋白质获得量及纯度的比较
采用两种提取方法对马铃薯块茎所获得的粗蛋白质干质量、纯蛋白质获得量以及蛋白质纯度等进行比较(表1).酚提取法获得的粗蛋白质量达到91.33 mg,是两步沉淀法提取的3.71倍,而且纯蛋白质的获得量也显著高于两步沉淀法,但是酚提取法获得蛋白质的纯度和浓度却明显低于两步沉淀法.
2.2 电泳结果的比较
2.2.1 双向SDS-PAGE结果 利用酚提取法和两步沉淀法提取的马铃薯块茎总蛋白质在17 cm pH 3~10非线性胶条进行等点聚焦,然后用12%SDS-PAGE分离后获得2-DE图谱(图1).两步沉淀法所得双向电泳图谱(图1-B)较酚提取法所得电泳图谱(图1-A)横向纹理较少、蛋白质斑点数多且清晰可见,主要分布在pH值4~7范围内,没有拖尾现象,分离效果比较理想,在pH 7~10的碱性区亦有较多显著的蛋白质点.而酚提取法2-DE电泳图谱上在碱性区几乎没有清晰且呈椭圆的蛋白质点的分布.采用PDQuest 8.0.1软件分析电泳图谱,两步沉淀法和酚提取法提取的马铃薯块茎总蛋白质点数目分别为398±46个和870±69个.MALDI-TOF/TOF-MS鉴定了8个差异表达蛋白质点(表2),分别是70 kU热激相关蛋白质,叶绿体、假定的线粒体NAD依赖的苹果酸脱氢酶、烯醇酶类似物、脱氢抗坏血酸还原酶、蛋白酶抑制剂II前体类型B、成熟酶 K、酸性磷酸酶类似物和蛋白酶抑制剂1.这些被鉴定的蛋白质可分为不同的功能类别,分别为能量和代谢相关蛋白质(37.5%)、贮藏和防御相关蛋白质(25%)、氧化还原相关蛋白质(12.5%)、转录相关蛋白质(12.5%)和翻译相关蛋白质(12.5%)(图2).

表1 两种提取方法获得蛋白质的比较
同列不同小写字母表示在0.05水平上差异显著.
Different small letters within the same column indicate that significant difference at 0.05 level.

图1 酚提取法和两步沉淀法提取的马铃薯块茎蛋白质2-DE图谱Figure 1 2-DE profiles of potato tuber protein extracted with phenol extraction method and two-step precipitation extraction method
进一步对获得的8个差异表达蛋白质丰度进行比较分析(图3),结果表明两步沉淀法中鉴定5种差异表达蛋白质丰度显著高于酚提取法,分别是70 kU 热激相关蛋白,叶绿体、烯醇酶类似物、脱氢抗坏血酸还原酶和成熟酶K.此外,两步沉淀法较酚提取法鉴定到一些新出现的蛋白质包括假定的线粒体NAD依赖的苹果酸脱氢酶、酸性磷酸酶类似物和蛋白酶抑制剂II前体类型B.

图2 两种提取方法下马铃薯块茎差异表达蛋白质的功能分类Figure 2 The functional classification of differentially expressed proteins of potato tuber extracted with two extraction methods
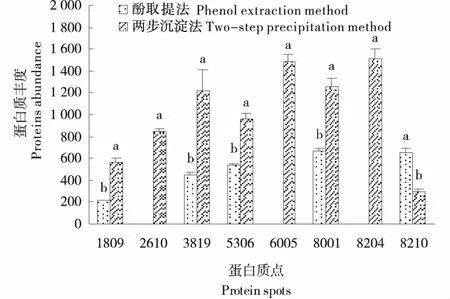
1809、2610、3819、5306、8001、8204、8210和6005分别是70 kU 热激相关蛋白,叶绿体、假定的线粒体NAD依赖的苹果酸脱氢酶、烯醇酶类似物、脱氢抗坏血酸还原酶、蛋白酶抑制剂II前体类型B、成熟酶K、酸性磷酸酶类似物和蛋白酶抑制剂1.图3 两种提取方法下马铃薯块茎差异表达蛋白质丰度比较Figure 3 The comparison of differentially expressed proteins abundance of potato tuber extracted with two extraction methods
3 讨论
蛋白质组学已经被广泛用于分析植物体各种生理生化机制[16].蛋白质样品的制备是2-DE的关键环节,直接影响2-DE的分辨率和分离效果.目前,国际上普遍采用的一种蛋白质提取方法是三氯乙酸/丙酮沉淀法,乙酸铵/甲醇沉淀法和酚提取法,单独的每种方法操作简便并且已经广泛应用于烟草(Nicotianatabacum)花粉[17]、水稻(Oryzasativa)根[18-19]、拟南芥(Arabidopsisthaliana)叶片[20]和葡萄(Vitisvinifera)叶和根[21]、香蕉(Musaspp)和苹果(Malusdomestica)[22]等组织的蛋白质提取.但是,对于富含酚类、色素类、脂类以及有机酸等次生代谢物质的材料,蛋白质提取效果却并不理想.三氯乙酸/丙酮沉淀法具有降低次生代谢物质脂肪和色素的干扰、减少蛋白质降解等优点[23],乙酸铵/甲醇沉淀法可有效去除样品中的可溶性杂质[13].本试验将三氯乙酸/丙酮沉淀和乙酸铵/甲醇沉淀结合在一起的两步沉淀法提取的蛋白质和酚提取法提取的蛋白质比较,两步沉淀法提取的蛋白质的含量较低,但其蛋白质纯度和浓度显著增加,说明三氯乙酸/丙酮沉淀与乙酸铵/甲醇沉淀相结合的两步沉淀法比酚提取法提取马铃薯块茎蛋白质更有效,除杂效果更彻底.用酚提取法提取蛋白质时,由于只收集酚相,大量的沉淀物被丢弃,导致蛋白质的损失较多[24].经质谱分析两步沉淀法和酚提取法表达量在2.5倍以上的差异表达蛋白质,主要富集在碱性区(pH 7~10),包括酸性磷酸酶类似物、成熟酶、烯醇酶类似物、假定的线粒体NAD依赖的苹果酸脱氢酶,与Delaplace等[25]采用酚提取法提取马铃薯块茎蛋白质经2-DE分离后蛋白质主要富集在酸性区(pH 4~7)相比,两步沉淀法大大提高了马铃薯块茎碱性区蛋白质的收集,改善了酚提取法碱性区蛋白质损失多的特性.
4 结论
采用酚提取法和三氯乙酸/丙酮沉淀与乙酸铵/甲醇沉淀相结合的两步沉淀法提取马铃薯块茎蛋白质,经过2-DE图谱分析发现两步沉淀法提取马铃薯块茎蛋白质点数量增加且蛋白质点分离效果好.该方法具有更好的除杂效果和高效富集碱性区域蛋白质的作用,是提取马铃薯块茎蛋白质的最佳方法,为研究马铃薯块茎蛋白质组学提供了更完善的技术支撑.
