非小细胞肺癌甲醛固定石蜡包埋切片DNA再利用的可行性研究
2019-03-22叶胜兵章如松马恒辉
魏 雪,叶胜兵,王 璇,吴 楠,章如松,马恒辉,饶 秋
0 引 言
肺癌的发病率和病死率逐年攀升,现已跃居恶性肿瘤之首。肺癌患者中80%以上为非小细胞肺癌(non⁃small cell lung cancer,NSCLC),且确诊时约60%为晚期患者[1]。尽管在化疗、放疗等综合治疗手段上有很大改进,但总体疗效已达瓶颈,5年生存率仍低于20%[2-4]。近年来针对EGFR的靶向药物已经成功应用于NSCLC治疗,很大程度上延长了患者的生存时间和改善生活质量。部分肺癌晚期患者由于获取标本较为困难,有限的标本大多被用于前期常规染色及免疫组化染色,而无法进行相关分子检测,进而影响患者的药物治疗。甲醛固定石蜡包埋(formalin⁃fixed paraff⁃nembedded,FFPE)是病理科普遍采用的组织处理和保存方法。该操作由于流程简单,易于掌握,可实现高度自动化处理,且代价低廉,目前广泛应用于病理科的常规工作中。免疫组化染色是临床病理诊断中最普遍且不可替代的辅助诊断技术。对于再利用免疫组化染色后的切片重新提取DNA并用于后续基因相关检测的可行性研究国内鲜有报道。本文通过对NSCLC患者FFPE标本经免疫组化染色后的DNA进行质量评估并进行后续分子检测,以期探讨标本回收利用的可行性。
1 资料与方法
1.1 实验材料采用完全随机法选取2017年6月至2017年12月于我院就诊且病理诊断为NSCLC的FFPE标本50份。每份标本分别切片12张,厚度3μm。随机抽取其中6张切片作为对照组直接进行DNA提取;剩余切片纳入实验组进行免疫组化染色后进行DNA提取,并对所有提取DNA进行表皮生长因子受体(epidermal growth factor receptor,EGFR)基因、鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)基因以及鼠类肉瘤滤过性毒菌致癌基因同源体B1(V⁃raf murine sarcoma viral oncogene homolog B,BRAF)基因突变检测。
1.2 仪器及试剂免疫组化染色试剂(TTF⁃1、P63、NapsinA、CK5/6、Syn、P40)均购自北京中杉金桥生物技术有限公司;DNA提取试剂盒为QlAamp DNA FFPE Tissue Kit(QIAGEN);ARMS法EGFR、KRAS、BRAF检测试剂盒由厦门艾德公司提供;ARMS法扩增采用ABI7500荧光PCR仪。
1.3 免疫组化染色免疫组化采用EnVision两步法染色,DAB显色,苏木精对比染色,梯度乙醇脱水,二甲苯透明,中性树胶封固。阳性结果判断严格按照组织学检测相同的定位、定性要求进行。
1.4 切片处理及DNA抽提严格按照Qlamp DNA FFPE Tissue Kit操作说明进行提取。①脱蜡:实验组的FFPE切片浸入二甲苯中直至盖玻片自然脱落(室温约2d),无水乙醇漂洗,室温风干,刮片收集组织;对照组FFPE切片直接以二甲苯脱蜡无水乙醇漂洗,风干后进行刮片收集组织。将玻片进行二甲苯脱蜡,再以无水乙醇漂洗,风干后刮取1.5mL装入EP管中。②酶解:加入200μL消化液及20μL蛋白酶K混匀,56℃酶解过夜。③结合:加入200μL结合液混匀,再加入200μL无水乙醇混匀,将混合液转移至吸附柱中,以8000×g离心力离心1min,弃废液。④洗涤:分别用预先配制的洗涤液洗涤,弃废液,将吸附柱转移后以12 000×g离心力离心5 min。⑤洗脱:将吸附柱转移到1.5 mL的EP管中,加入100μL的洗脱液,室温静置1min,以12 000×g离心力离心1min,将收集的洗脱液(即DNA提取液)进行浓度和纯度测定,-80℃保存待用。
1.5 DNA测定严格按照标本质量控制试剂盒操作说明进行PCR扩增。PCR扩增EGFR第18、19、20、2l外显子,KRAS第 12、13密码子和BRAF第600密码子。所得到的PCR产物取1μL加入 0.5μL GenesScan 500 LIZ Size Strand,再加入10μL的 Hi-Di Fromamide,以 6000×g离心力离心30s。在PCR仪上进行变性(95°C变性 5min,4℃5min),基因分析仪上进行毛细管电泳,标本应在100、200、300、395bp位置收集到 ROX 荧光信号,则表示标本为合格。
1.6 ARMS法检测严格按照试剂盒说明书进行操作。将提取的DNA稀释为2ng/μL,按42.3μL稀释的DNA模板加2.7μLTaq酶液混合,每反应5μL分装到预先分装的8联管反应液中,以6000×g离心力离心30s,用ABI 7500荧光定量PCR仪进行检测。反应条件:95℃预变性 5min;95℃ 25s,64℃ 20s,72℃ 20 s,共 15 个循环;93℃ 25s,60℃ 35s,72℃20s,共31个循环;后31个循环60℃收集FAM和VIC信号并数据分析。
1.7 统计学分析采用SPSS 17.0进行分析。采用配对t检验比较DNA浓度及纯度差异;应用四个表一致性检验分析组间EGFR、KRAS、BRAF基因突变检测结果。以P≤0.05为差异有统计学意义。
2 结 果
2.1 DNA浓度及纯度实验组提取DNA浓度(80.84±35.13)及纯度(1.90±0.08)分别与对照组[(85.03±36.64)和(1.92±0.06)]比较,差异均无统计学意义(P>0.05),见图 1。
2.2 ARMS法检测结果实验组标本中检测到EGFR基因突变20例(40%)。其中第18号外显子突变2例(10%)、第19号外显子突变15例(75%)、第20号外显子突变1例(5%)、第21号外显子突变2例(15%)。EGFR基因突变主要集中在19号外显子缺失和21号外显子点突变(L858R),见图2;实验组共检测到KRAS基因突变8例(16%)。其中第12密码子突变7例(87.5%)、第 13密码子突变 1例(12.5%),见图3;实验组共检测到BRAF基因V600E点突变5例(10%),见图4。对照组NSCLC FFPE切片中,33份分别检测出相应的EGFR、KRAS和BRAF基因突变;另外17份同样检测出阴性结果。实验组和对照组检测结果具有高度的一致性,结果相比符合率达 100%(P=0.000)。
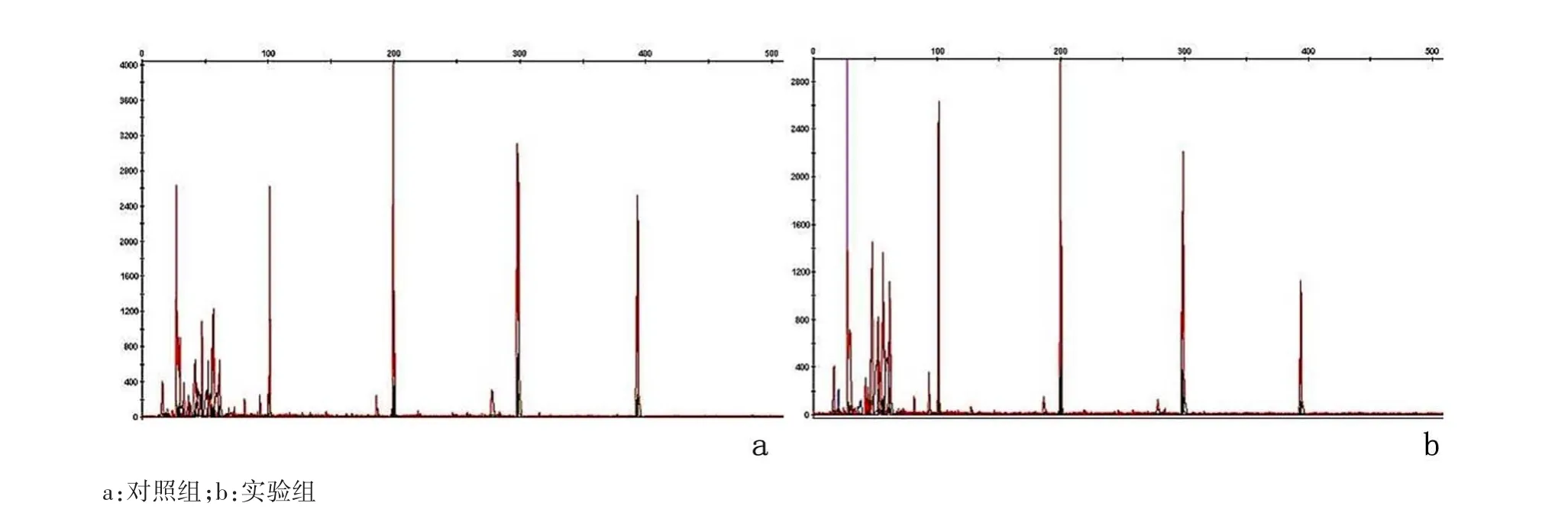
图1 DNA抽提结果Figure 1 Results of DNA extraction from the FFPE specimens of NSCLC
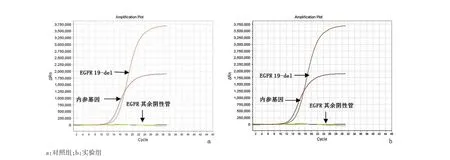
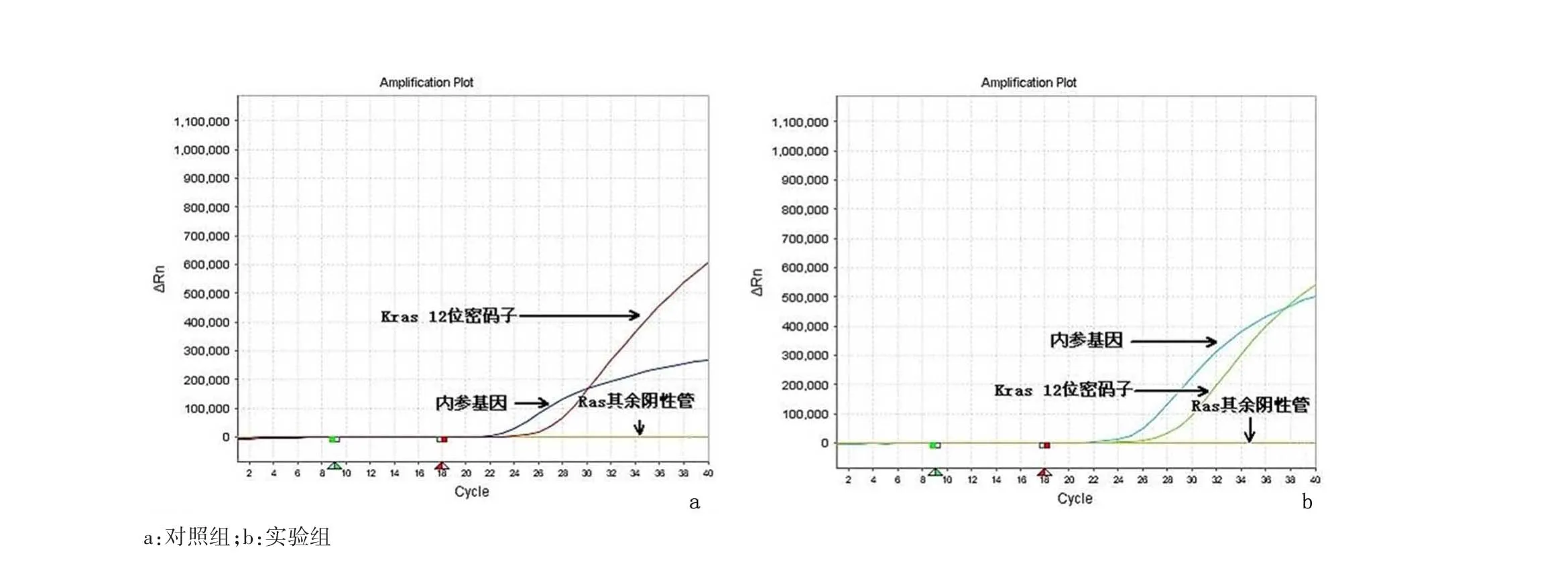
图3 KRAS检测结果示KRAS 12位密码子突变Figure 3 Mutation of KRAS in the FFPE specimens of NSCLC
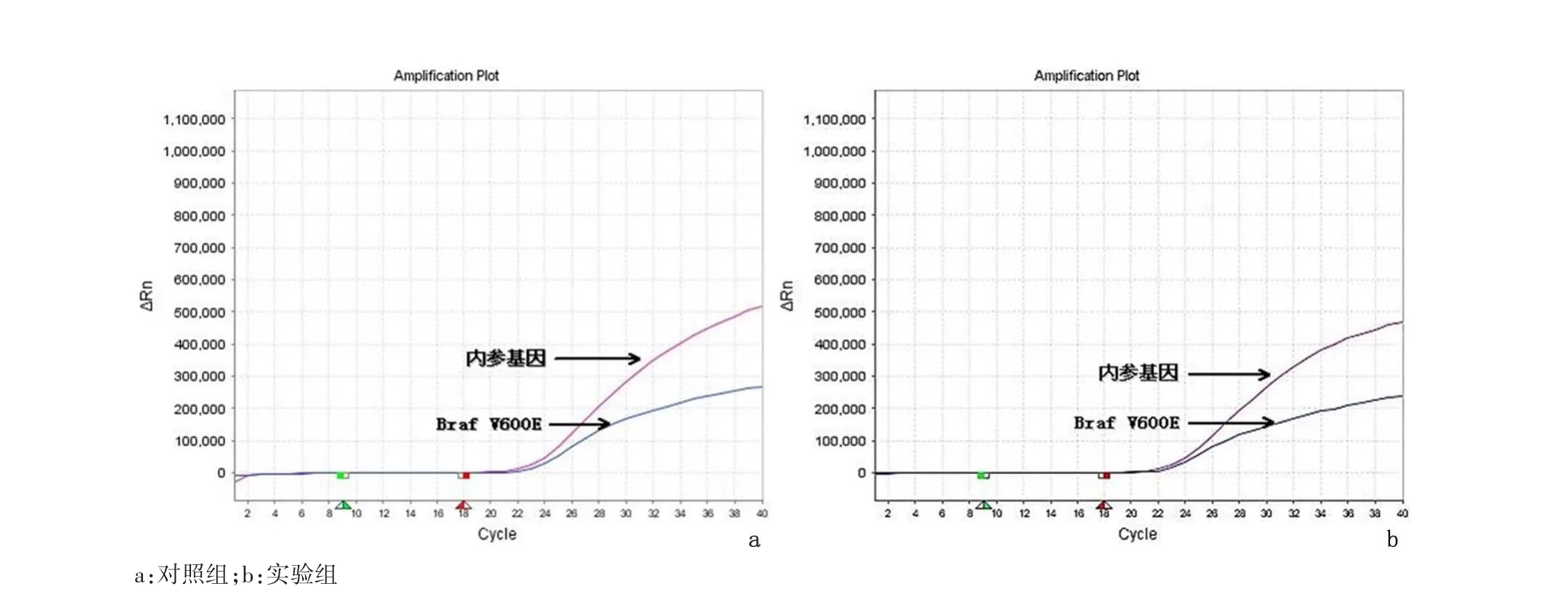
图4BRAF检测结果示BRAF阳性Figure 4 Mutation of KRAS in the FFPE specimens of NSCLC
3 讨 论
肺癌相关的死亡仍然是全球癌症病死率最高的疾病之一[5]。其中NSCLC占肺癌死亡的80%~85%。近年来随着分子生物学和人类基因组学的发展,人们对肺癌病变与侵袭转移的分子机理以及生物信号传导通路的认识有了进一步的加深,从而为肺癌的早期诊断和开发新的治疗方法提供了机会。分子标志物检测是个体化治疗的前提,目前肺癌分子靶向治疗常用的治疗靶点包括细胞受体、信号传导和抗血管生成等。近年来出现的EGFR酪氨酸激酶抑制剂(如吉非替尼)备受关注。KRAS基因突变与非小细胞肺癌患者对EGFR⁃TKI靶向药物的原发性耐药有关[6]。BRAF基因作为一种原癌基因编码丝/苏氨酸特异性激酶,是RAS/RAF/MEK/ERK/MAPK通路重要的转导因子[7]。研究发现,吉非替尼对存在EGFR基因突变的患者有较好的疗效,但存在KRAS和BARF基因突变的患者对吉非替尼表现出耐药现象。因此,EGFR、KRAS、BRAF基因检测是NSCLC患者最常用的检测指标。
免疫组化利用抗原抗体的特异性结合反应来检测和定位组织或细胞中的某种化学物质,主要定位一些蛋白质或多肽类物质的存在。ARMS法检测是一项在PCR基础上发展起来的新方法,利用特异引物对突变靶序列进行高精准PCR扩增放大,在实时荧光定量PCR平台上实现对样品DNA中稀有突变的检测,以达到对基因突变检测的高特异性和灵敏度。与ARMS法比较,免疫组化使用抗体的检测对象为抗原,机制是抗原-抗体的特异性结合,是蛋白质表达水平的检测;ARMS法使用的是荧光探针,利用探针对扩增产物进行检测,是DNA水平的检测。本研究发现,免疫组化后再进行后续基因检测并不影响其检测仍可以获得高质量的结果,检测成功结果满意,符合率可达100%,满足病理诊断的需求。
部分肺癌晚期患者由于获取标本比较困难,穿刺标本比较微小,蜡块上的组织已所剩无几,难以再行切片。或者部分会诊患者带来的白片数量有限,前期常规及免疫组化检测已经用完,而返回原就诊医院重新制片既不方便,又延误患者的及时诊治,并增加经济负担。
本研究旨在探索一种标本回收利用的新方法,通过有效利用仅存的切片进行后续辅助检查。将病理切片图像信息通过全玻片数字扫描技术实现全数字化,形成数字切片,保存了现有的病理图像的同时,重利用免疫组化染色过的切片进行分子检测,满足诊断需求,为患者提供预后信息和精准的药物治疗指导,促进向精准医疗的发展。近年来,癌症的发病率明显增多,严重威胁人类健康,肿瘤的研究也成为全球的热点。尽管肿瘤的研究方法和研究角度在不断更新,但人体肿瘤组织标本是肿瘤研究不可或缺的重要对象。如不及时保存,将会丢失重要的临床科研资源。应用这种标本回收再利用的新方法,在保存了现有的病理图像的同时,重新利用组织切片进行后续检测,为病理医师和临床医师开展临床科研工作提供了基础。
FFPE技术已经被认为是保存组织形态学的标准[8]。虽然,人们普遍认为组织固定、处理、包埋、染色等步骤会破坏生物分子的完整性;但多项研究表明FFPE标本中仍具有有价值的信息[9-10]。随着靶向治疗药物的不断涌现,为肿瘤患者的治愈或缓解带来更多的希望,肿瘤靶点的个体化分子检测越来越受到临床的重视,肿瘤标本的珍贵性显而易见[11-12]。本研究发现,NSCLC FFPE标本经免疫组化染色后能够提取高质量的DNA,并且可以用于靶基因的下游分子分析,是值得推广的技术方法。
