程序性细胞死亡配体1状态与乳腺癌放疗敏感性的关系
2019-03-22满忠松汤在祥张海涛
满忠松,汤在祥,周 进,赵 鑫,张海涛
0 引 言
乳腺癌是常见的恶性肿瘤,也是女性癌症死亡的主要原因。放疗在降低乳腺癌术后复发和改善临床预后中起重要作用。近年来随着放疗学的发展和技术改进,放疗患者总体生存率得到明显改善。但由于肿瘤在分子基因水平上存在高度异质性,对于同一临床病理特征且接受相同放疗方案的患者,放疗效果却存在差异[1]。因此,在基因组水平上探索放射敏感性标记物,发现放疗受益患者引起学者广泛关注。
免疫疗法是一种实体癌症治疗措施,其主要方式是阻断PD⁃1/PD⁃L1信号通路,从而提高T细胞对肿瘤的反应[2]。针对靶向PD⁃1/PD⁃L1通路的药物在晚期癌症(如黑色素瘤、非小细胞型肺癌和肾细胞癌)表现出良好的临床效果。放疗本身被认为是免疫抑制,不仅对肿瘤细胞DNA造成损伤,而且也存在免疫介导的细胞凋亡[3⁃4]。为逃避宿主的免疫反应,癌细胞经常发展为程序性PD⁃L1,并随后诱导T细胞凋亡[5]。PD⁃L1与恶性肿瘤的关系在多种肿瘤中已被证实,其高表达提示患者预后不良[6]。但关于PD⁃L1在乳腺癌发生、发展以及患者预后过程中发挥的作用仍存在争议。有研究表明,高表达PD⁃L1的乳腺癌具有更强的侵袭性[7];但矛盾的是,也有研究结果显示高状态的PD⁃L1改善乳腺癌患者预后[8]。尽管乳腺癌被认为是低免疫原性癌症,但近期大量研究数据表明PD⁃L1通路在乳腺癌中存在活性[9⁃11]。因此,联合应用放疗和免疫治疗的方式可能会为乳腺癌治疗提供新的治疗方案。
本研究采用癌症基因图谱(The Cancer Genome Atlas,TCGA)数据库,分析PD⁃L1在乳腺癌中的表达特点及与临床病理相关性,并依据CD274mRNA在样本中表达情况对患者进行分组,探讨PD⁃L1与放疗敏感性的关系。
1 资料与方法
1.1 数据资料收集和筛选利用TCGA⁃Assembler(https://omictools.com/tcga⁃assembler⁃tool)工具下载TCGA 数据库(https://cancergenome.nih.gov/)浸润性乳腺癌临床和RNA seq V2数据集。截止TCGA数据更新到2017年7月下载的样本数为1224例。首先,对样本资料预处理,剔除正常乳腺组织样本(113例);其次,对下载的临床资料预处理,删除男性、不明性别、缺失随访记录(存活时间及状态)的患者。最终获得1007例患者的临床数据集。临床资料包括生存时间、存活状态、患病及死亡年龄、外科术式、术后组织边缘状况和治疗资料;病理资料包括组织学分型、激素状态、TNM分期、T、N、M期等。最后,根据TCGA库中患者编号将样本RNA seq数据和临床资料合并。
1.2 临床病理参数分析及乳腺癌分子分型样本资料中包含正常乳腺组织113例,乳腺癌组织样本1101例。根据mRNA测序结果,正常乳腺组织中CD274(PD⁃L1)表达量为 1.98~163.39,中位表达值为26.59;乳腺癌组织中表达量为0~772.59,中位表达值为19.77。根据TNM分期,Ⅰ期167例、Ⅱ期570例、Ⅲ期233例、Ⅳ期18例。1007例患者中剔除雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子2(human epidermal growth factor 2,HER2)缺失及状态不明患者,按其免疫组化结果分为:Luminal A型(ER或PR+,HER2⁃)405例(61.93%)、Luminal B型(ER或PR+,HER2+)113例(17.28%)、HER2型(ER和PR⁃,HER2+)32例(4.89%)、Basal型(ER⁃,PR⁃,HER2⁃)104例(15.90%)。
1.3 统计学分析本研究以总样本中CD274 mRNA中位表达值作为PD⁃L1高、低状态组划分依据。首先对样本中临床病理、治疗资料和PD⁃L1状态信息进行数字化赋值。采用χ2检验推断PD⁃L1表达状态与临床病理参数关系。采用Kaplan⁃Meier单因素和Cox回归多因素进行生存分析。所有数据分析均在“R”3.4.0(http://www.r⁃project.org)软件完成,检验水准α=0.05。
2 结 果
2.1 PD⁃L1状态和临床病理资料与预后关系1007例乳腺癌患者临床预后特点见表1。患者平均年 龄(58.1±13.0)岁 ,术 后 平 均 生 存 时 间 为(41.9±34.6)个月。单因素分析结果显示,年龄(P=0.001)、TNM 分 期 、术 后 边 缘 状 态(P=0.006)、化疗(P=0.001)、放疗(P=0.007)和 PD⁃L1状态(P=0.047)有统计学意义;多因素分析结果显示TNM分期和化疗(P=0.002)具有统计学意义。单因素分析结果显示,高状态的PD⁃L1相比低状态的 PD⁃L1改善患者预后(HR=0.682,95%CI 0.467~0.994,P=0.047),故推测 PD⁃L1 可能为乳腺癌抑制基因。

表1 本组1007例乳腺癌患者特征分析Table 1 Characteristics of 1007 patients with breast cancer
2.2 PD⁃L1状态对放疗生存率影响PD⁃L1高低状态组患者临床病理与患者预后关系见表2。高状态组单因素分析提示,患病年龄、TNM分期和术后边缘状态对患者总生存率影响差异有统计学意义(P<0.05);多因素分析结果显示,TNM分期对患者总生存率有统计学意义。PD⁃L1低状态组TNM分期和放疗在单因素和多因素分析中均有统计学意义(P<0.05)。PD⁃L1高状态组患者是否接受放疗总生存率差异无统计学意义(P>0.05)。然而低状态组放疗患者放疗后总生存率得到显著改善(HR=0.550,95%CI 0.335~0.904,P=0.017),多因素分析校正后仍存统计学意义(HR=0.415,95%CI 0.194~0.872,P=0.025)。图1示PD⁃L1高低状态组在同一TNM分期情况下放疗和非放疗患者生存曲线。结果显示在Ⅱ期患者中,PD⁃L1低状态的放疗患者总生存率得到改善;调整患病年龄、组织学分型、外科术式、术后边缘状态后差异仍有统计学意义(P=0.021)。而高状态患者是否放疗总生存率差异无统计学意义。Ⅲ期患者中PD⁃L1低状态放疗患者总生存率显著改善;多因素调整后差异仍有统计学意义(P=0.020)。低状态组患者接受放疗总生存率提高,说明乳腺癌中低状态的PD⁃L1患者存在放疗敏感性。
2.3 PD⁃L1状态与临床病理关系ER状态(χ2=18.44,P<0.001)、HER2 状态(χ2=7.943,P=0.047)和分子分型(χ2=14.52,P=0.006)与PD⁃L1表达存在关联,而年龄、组织学分型、外科处理术式、术后组织边缘状况和PR状态与其表达状态无关联性。
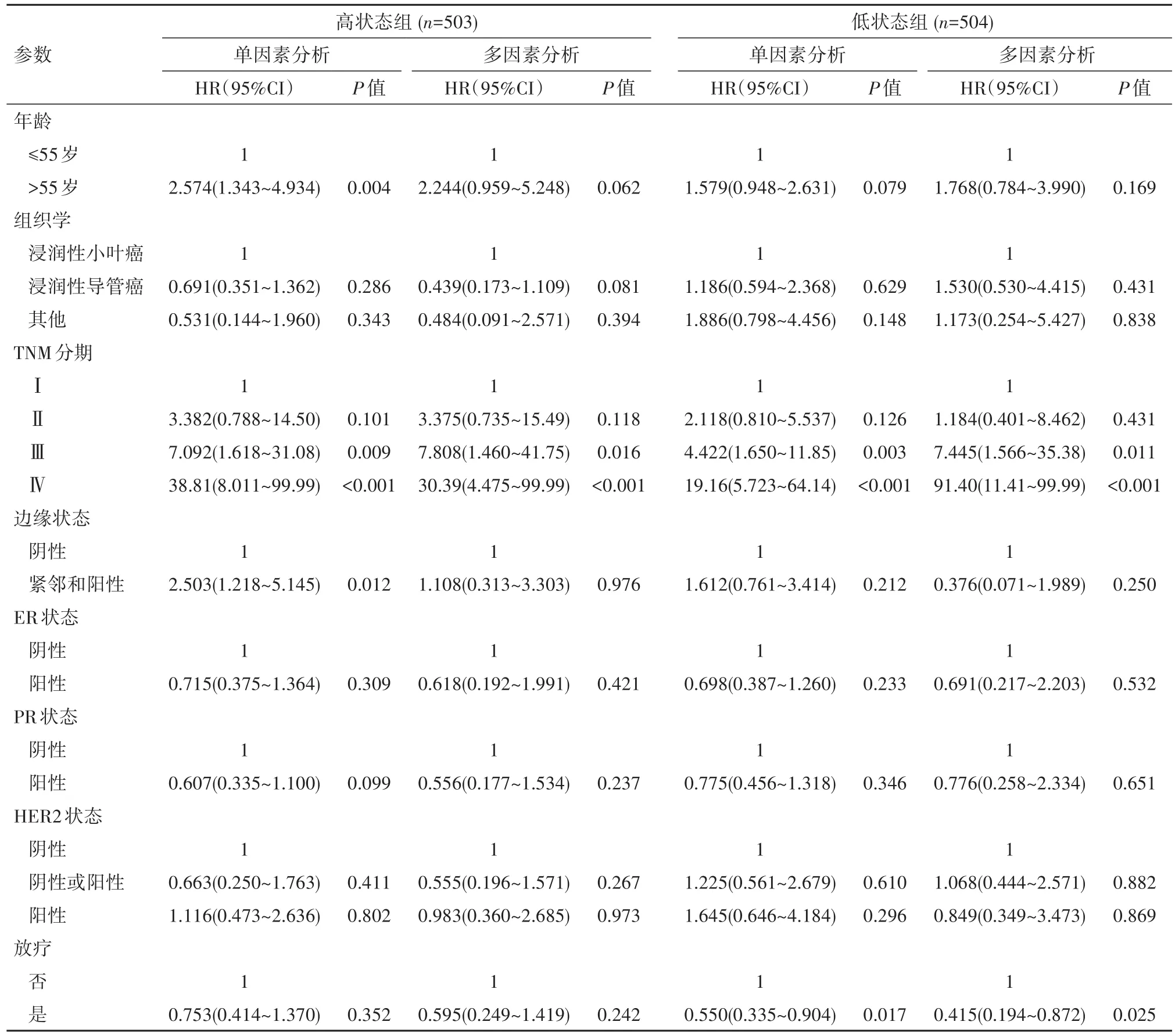
表2 PD⁃L1高、低状态组乳腺癌患者特征分析Table 2 Characteristics of breast cancer patients between the two groups

图1 PD⁃L1高、低状态组放疗患者生存曲线Figure 1 Survival curve of the patients between two groups
3 讨 论
乳腺癌在筛查、治疗和生存方面取得了巨大进展,但如今仍是女性最常见恶性肿瘤和死亡常见原因。随着进入基因测序时代,使得在基因组水平上的精准治疗方案引起学者广泛探索。因此,寻找基因层面的治疗靶点可能为乳腺癌提供新的治疗方案。有研究显示乳腺癌的局部控制和良好预后得益于术后的辅助放疗[12⁃13]。心脏毒性和放射性肺损伤是放疗的重要并发症,且并不是所有患者接受放疗受益。因此,寻找放疗领域的敏感性标记物尤为重要。
本研究利用TCGA乳腺癌数据库首先分析了PD⁃L1表达状态与乳腺癌临床病理特征及预后关系.结果显示高状态的PD⁃L1改善患者预后,其状态与ER状态、HER2状态和分子分型存在关联性。该结果与既往多项研究描述的高状态PD⁃L1改善乳腺癌患者预后,且表达状态与分子分型密切相关的结论相符[8,10,14];与 Zhang等[7]和 Tao等[15]研究结果提示的高状态的PD⁃L1增加乳腺癌侵袭性存在一定差异。其次,本研究验证了PD⁃L1状态与患者放疗敏感性关系。单因素和多因素分析结果显示,PD⁃L1低状态组放疗患者总生存率得到改善;高状态组,患者是否放疗总生存率差异无统计学意义。本研究结果显示,高状态的PD⁃L1改善患者总预后,但在PD⁃L1高状态组中患者是否放疗生存率差异无统计学意义,但在PD⁃L1低状态患者中接受放疗生存率改善,提示PD⁃L1可能为乳腺癌放疗敏感性基因。
随着对肿瘤微环境研究的深入,PD⁃L1引起学者们的广泛兴趣,大量数据表明PD⁃L1通路可能是多种癌症的一种活跃的免疫检查点[16]。PD⁃L1是9q24编码的40kDa跨膜蛋白,与活化的细胞毒性T细胞表面表达的PD⁃1受体结合。PD⁃1/PD⁃L1相互作用可作为抗原和自身免疫的调节核查站。PD⁃L/PD⁃L1结合后阻止T细胞活化的下游信号,抑制CD3/CD28介导的T细胞转录作用,使肿瘤细胞逃避T淋巴细胞的杀伤作用[17]。然而,该过程中发生了磷脂酰肌醇激酶的磷酸化、蛋白激酶B的激活、葡萄糖代谢等系列生化反应[18]。有研究显示,放疗过程中的细胞代谢通路广泛参与免疫识别和凋亡细胞的清除[19]。此过程中PD⁃1和PD⁃L1结合率是影响放疗疗效的重要因素,因此,PD⁃L1表达状态可能对放射疗效产生一定影响。
放疗过程中的NDA修复是放疗抵抗的重要因素之一。放疗造成不同类型的DNA损伤,同时引发DNA的损伤修复反应以克服细胞损伤和基因的不稳定性;而P53基因的表达是该修复过程中重要环节[20⁃21]。Yang等[22]研究发现乳腺癌患者中PD⁃L1的表达与P53阳性表达呈正相关。通过本研究PD⁃L1低状态患者存在较好的放疗敏感性可能与低表达的P53抑制放疗过程中的细胞损伤修复密切联系。
放疗通过诱导肿瘤微环境中的干扰素⁃γ并激活T细胞而引发免疫应答,产生疗效[23]。有报道显示,放射后肿瘤细胞中PD⁃L1水平升高,抑制CD8+T细胞功能[24]。因此,放疗过程中阻断PD⁃L1表达,在一定程度上克服PD⁃L1表达升高引起的放疗抵抗。然而,既往研究主要集中在单一的免疫抑制剂研究或放射治疗后PD⁃L1表达状态探索;本研究则是利用TCGA数据库中乳腺癌患者放疗前肿瘤组织中PD⁃L1的表达水平,在基础条件下研究PD⁃L1表达状态与放疗敏感性关系。免疫治疗成为肿瘤治疗的重要手段,其联合免疫抑制剂的靶向放疗可能为乳腺癌治疗提供新可能和研究思路。
本研究采用TCGA数据库中乳腺癌临床资料和mRNA二代测序数据进行探讨PD⁃L1状态如乳腺癌放疗敏感性关系。基于PD⁃L1在乳腺癌中的表达及其微环境的治疗策略有着巨大的发展潜力,后续还需要进一步的试验来验证PD⁃L1放疗敏感性生物标记的价值。
