低辐射剂量CT扫描技术行肝3D建模打印的可行性
2019-03-22刘文源曹志强曹东兵邹明宇
李 冠,黄 伟,刘文源,曹志强,曹东兵,邹明宇
0 引 言
随着3D打印技术在医疗领域中的广泛应用,肝3D打印为肝占位性病变的诊治提供了新的手段。肝3D打印有利于术前制定手术方案、模拟手术操作、指导临床教学以及加强医患沟通,对减轻术前焦虑具有重要作用[1-2]。通过对肝分段3D打印,可明确病灶具体的解剖位置,为手术精准分段切除提供保障;同时可大大缩短手术时间,减少术后并发症的发生[3]。此外,肝3D打印可清楚显示病灶与肝内血管的关系,为介入治疗的实施提供依据[4]。
目前,肝3D打印前常采用CT扫描生成的医学数字成像和通信(Digital Imaging and Communica⁃tions in Medicine,DICOM)格式作为基础数据,并将其转化为计算机辅助设计(computer aided design,CAD)模型,从而将传统的二维空间结构演变为三维立体成像结构[5]。研究表明,肝三期增强CT扫描患者所受的辐射剂量位列所有影像学检查之首[6]。过高的CT辐射剂量可导致性腺、甲状腺及晶状体等部位的损伤,甚至可诱发某些恶性肿瘤的发生[7-8]。因此,本文旨在探讨保证肝3D打印质量的同时,降低CT辐射剂量的可行性。
1 资料与方法
1.1 一般资料回顾性分析我院自2016年1月-2018年6月间临床拟行肝3D建模打印的患者40例。其中男28例、女12例,年龄32~79岁,平均(55.53±12.83)岁。低剂量组患者20例,采用管电压100 kVp,自动管电流调制技术(峰值600 mA)及自适应统计迭代重建(adaptive statistical iterative re⁃construction,ASiR)算法;常规剂量组患者20例,采用管电压120 kVp,250 mA及滤波反投影重建(filter back projection,FBP)算法。两组对比剂均采用碘海醇(Iohexol 300 mgI/mL)。所有患者均排除增强CT扫描禁忌证。
1.2 CT扫描仪器及参数采用美国GE Discovery CT750 HD(GE Health care,Milwaukee,USA)扫描仪,首先进行上腹部定位相扫描,扫描范围从膈上1.0 cm至肝脏最下缘。采用吸气后屏气扫描,检查前对患者进行屏气训练。扫描层厚0.625 mm,机架旋转时间 0.6 s/r,螺距 0.984,准直宽度 64×0.625 mm,FOV 350~450 mm。低剂量组采用管电压为100 kVp,自动管电流调制技术(50~600 mA),噪声指数(noise index,NI)为12;常规剂量组采用管电压120 kVp,管电流250 mA。2组患者均选用双筒高压注射器经外周静脉注射对比剂300 mgI/mL,用量为1.0 mL/kg(70~90 mL),注射速率为3.5~5.0 mL/s,注射对比剂后追加等渗盐水30 mL。在腹主动脉腹腔干层面设定为感兴趣区(region of interest,ROI),采用自动跟踪智能触发技术进行动态追踪扫描。当ROI达到150 HU时行动脉期扫描,延迟30、120 s分别行门脉期、延迟期扫描。低剂量组采用ASiR算法,迭代权重选择60%;常规剂量组采用FBP算法,完成图像重建。
1.3 3D打印设备及软件条件将两组获取的CT DICOM数据传至3D打印设备,进行肝3D建模打印。采用美国MakerBot Replicator 2 3D打印;3D打印软件为Makerware;Dell M6800移动工作站。操作系统为 Windows 764 bit;Mimics 15.0(Materialise公司,Belgium)。
1.4 肝3D建模打印质量主观评分由2名资深3D打印工程师对3D建模打印结果进行盲态评分。采用4分法进行评价。4分:质量好,结构完整,解剖细节显示清晰,血管无伪影,模型边缘光整、锐利,可完全满足临床需求;3分:质量较好,结构完整,解剖细节显示尚可,血管无伪影,模型边缘欠光整,基本满足临床需求;2分:质量差,结构部分缺如,解剖细节显示欠佳,血管显示模糊,模型边缘粗糙,无法满足临床需求;1分:质量极差,结构大部分缺如,解剖细节显示不清,血管未见完整显示,模型边缘粗陋,无法满足临床需要。认为3分及以上3D模型为符合临床要求。最终评分值取两位工程师评分的平均值。
1.5 肝3D建模打印图像质量客观评价ROI的选取:①肝动脉期,腹主动脉腹腔干层面的ROI;②肝门脉期、延迟期,左、右门静脉汇合处门静脉的ROI;③同一层面肝S2、S7、S8段的ROI;④右侧竖脊肌的ROI。ROI选取面积大小为1.0 cm2。测量腹部皮下脂肪CT值的标准差(standard deviation,SD)作为图像背景噪声(BN)。对比噪声比 CNR=(ROI肝脏-ROI肌肉)/SD。其中ROI肝脏为肝实质CT值均值;ROI肌肉为右侧竖脊肌CT值均值。
1.6 CT扫描剂量的记录与测量方法记录由扫描仪提供的容积CT剂量指数(CT dose index,CTDI)及剂量长度乘积(dose⁃length product,DLP)。根据公式计算有效辐射剂量(effective dose,ED)=DLP×K,其中K为转换因子,采用欧盟委员会CT质量标准指南[9]。本研究中K=0.015 mSv/(mGy·cm)。
1.7 统计学分析使用SPSS 19.0软件进行统计学分析。患者辐射剂量和3D打印建模图像客观评价指标均采用均值±标准差(±s)表示。图像质量主观评价应用非参数Mann⁃Whiteney U检验;客观评价应用两独立样本t检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 基线资料对比2组患者年龄、身高、体重及体重指数差异均无统计学意义(P<0.05),见表1。
表1 行肝3D建模打印患者一般资料比较(±s)Table 1 General data on the two groups of patients(±s)

表1 行肝3D建模打印患者一般资料比较(±s)Table 1 General data on the two groups of patients(±s)
组别低剂量组常规剂量组t值P值n 20 20年龄(岁)54.42 ± 11.46 57.94 ± 10.18 1.611 0.116身高(cm)172.35 ± 7.11 168.74 ± 6.37 1.691 0.099体重(kg)72.33 ± 7.54 70.61 ± 8.12 0.694 0.492体重指数(kg/m2)26.35 ± 1.43 25.94 ± 1.72 0.820 0.418
2.2 肝血管及肝实质Ⅲ期动态增强ROI结果对比 2组患者腹主动脉、门静脉及肝实质三期动态增强ROI测量结果比较,差异无统计学意义(P<0.05),见表2。

表2 行肝3D建模打印患者腹部血管、肝实质Ⅲ期增强扫描ROI对比结果(xˉ±s,HU)Table 2 Comparison of the values of three⁃phase enhanced CT scanning of the abdominal aorta,portal vein and liver pa⁃renchyma between the two groups of patients(xˉ±s,HU)
2.3 肝CT DICOM数据客观评价结果2组患者BN、CNR组间比较差异无统计学意义(P<0.05),见表3。2组患者CTDI、DLP及ED差异均有统计学意义(P<0.05);且低剂量组ED值[(2.58 ± 0.79)mSv]较常规剂量组[(4.02 ± 0.26)mSv]明显降低,ED下降约35.8%,差异有统计学意义(P<0.05),见表4。
2.4 肝3D建模打印质量对比2组间模型质量主观评分均≥3分,可完全满足临床诊断需求,模型质量主观评分差异无统计学意义(P=0.687),见表5。
表3 行肝3D建模打印患者的背景噪声与对比噪声比结果比较(±s)Table 3 Comparison of background noise and contrast noise ratio between the two groups of patients(±s)

表3 行肝3D建模打印患者的背景噪声与对比噪声比结果比较(±s)Table 3 Comparison of background noise and contrast noise ratio between the two groups of patients(±s)
组别低剂量组常规剂量组t值P值n 20 20背景噪声动脉期11.45 ± 2.35 12.78 ± 2.19 1.852 0.072门脉期12.64 ± 1.75 13.78 ± 3.77 1.227 0.231延迟期11.35 ± 1.59 12.72 ± 2.93 1.838 0.076对比噪声比动脉期0.19 ± 0.15 0.17 ± 0.13 0.451 0.655门脉期0.49 ± 0.16 0.46 ± 0.62 0.210 0.836延迟期0.45 ± 0.22 0.34 ± 0.17 1.769 0.086
表4 行肝3D建模打印患者辐射剂量对比(±s)Table 4 Comparison of the radiation doses between the two groups of patients(±s)

表4 行肝3D建模打印患者辐射剂量对比(±s)Table 4 Comparison of the radiation doses between the two groups of patients(±s)
组别低剂量组常规剂量组t值P值n 20 20 CTDI(mGy)7.07 ± 1.79 8.54 ± 0.31 3.619 0.002 DLP(mGy•cm)187.12 ± 56.81 265.21 ± 0.18 6.147<0.001 ED(mSv)2.58 ± 0.79 4.02 ± 0.26 7.743<0.001
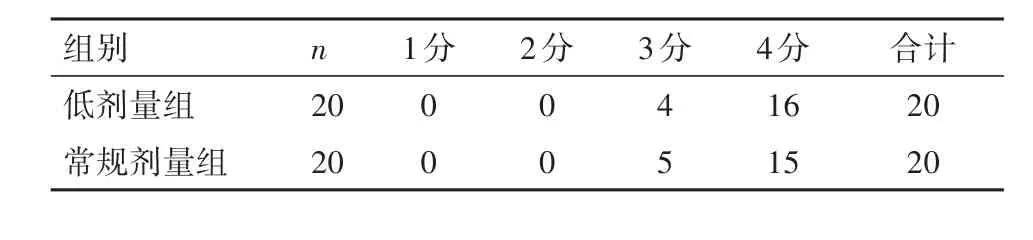
表5 行肝3D建模打印患者肝3D建模打印质量主观评分(n)Table 5 Comparison of the scores in the assessment of the 3D modeling printing between the two groups of patients(n)
3 讨 论
3D打印技术可用于打印三维物体,将人体的实质器官、血管、周围组织结构及病变较真实地表达出来,所提供的信息比传统医学影像资料更加直观,解剖信息更加真实。3D建模打印是3D实物打印前的最后环节,3D建模打印结果直接反映了肝3D实物打印质量[10]。因此,本研究着眼于3D建模打印,既避免了3D实物打印材料的浪费,又保证了多次重复实验的可行性。
目前,减少CT辐射剂量的方法主要有降低管电压、降低管电流、减少曝光时间及应用迭代算法等[11-13]。由于辐射剂量与管电压2.5倍的平方呈正比,降低管电压可较大幅度的降低患者所接受的CT辐射剂量[13]。自动管电流调制技术(automated tube current modulation,ATCM)是根据检查者不同部位的组织厚度以及预先设置的图像噪声水平来自动调节管电流的大小,从而减少患者所受的辐射剂量[14]。该技术可根据计算机系统参照CT定位相所检测到的受检部位及器官的厚度与密度,并结合预先设定的图像噪声指数估算出扫描各层面所需要的管电流值,智能调节管电流,进而获得较低且适宜的毫安值进行扫描[15]。这与当下流行的人工智能技术似有相似之处,可减少操作者重复摸索最佳扫描条件的步骤,并大大缩短了检查时间,是未来影像技术发展的一个趋势。
由于降低管电压后,图像的CT值、背景噪声及CNR均会发生相应的变化;而本研究结果却显示低剂量组与常规剂量组患者ROI、BN及CNR值差异均无统计学意义。推测原因在于ASiR算法的应用。由于在完成CT DICOM数据重建时,加入了适当权重的迭代算法(本研究选用了60%ASiR),可有效弥补降低管电压后ROI、BN及CNR值的变化。相关研究表明,ASiR算法在降低图像噪声而不损坏图像质量的同时可有效降低CT辐射剂量25%~50%[16]。本研究选用60%ASiR进行图像重建,发现低剂量组较常规剂量组辐射剂量下降约35.8%,而最终两组3D建模打印图像质量主观评分无显著差异,完全可满足临床诊治的需求。
本研究尚存在一些不足之处:①由于3D打印价格不菲,打印时间较长,因此样本量相对较少;②尚未考虑低浓度对比剂的应用及对比剂用药个体化的问题;③尚缺少不同迭代权重下,行肝3D建模打印质量的对比,从而得出最适迭代权重下肝3D建模打印的结果;④本研究采用的是目前最常用、最成熟的ASiR算法,尚缺乏GE Healthcare公司推出的最新第 3代迭代算法Weo 3.0的应用研究,Weo 3.0可否进一步降低3D打印的辐射剂量。这些问题将在今后的研究中进一步讨论。
综上所述,使用低辐射剂量CT扫描方案(100 kVp,ATCM及60%ASiR)行肝3D建模打印可较大幅度降低患者所受CT辐射剂量,且不影响最终肝3D建模打印的质量。
