磁性BiPO4-Fe2 O3异质结催化剂的制备及其光催化特性研究
2019-03-22方艳芬曹新强唐长存黄应平
焦 磊 方艳芬 曹新强 唐长存 黄应平
(1.三峡大学生物与制药学院,湖北宜昌 443002;2.三峡大学三峡库区生态环境教育部工程研究中心,湖北 宜昌 443002;3.三峡大学三峡地区地质灾害与生态环境湖北省协同创新中心,湖北宜昌 443002)
BiPO4是一种在紫外光照射下具有很高催化活性的新型半导体光催化剂[1-2].然而BiPO4光催化剂仍存在着难以回收再利用、光生电子-空穴对容易复合等问题[3].近期研究发现,异质结结构可以有效抑制光生电子-空穴对的复合,Zhu[4]等使用超声煅烧法制备出了BiPO4/Bi2WO6复合光催化剂,BiPO4产生的电子通过异质结结构转移到Bi2WO6的导带,Bi2WO6上产生的空穴则转移到BiPO4的价带,从而实现对光生电子-空穴对复合的有效抑制,复合催化剂对亚甲基蓝(Methylene Blue, MB)的降解率约是纯BiPO4的25.4倍.Lv[5]通过一锅法合成MoS2/Bi-PO4复合材料,MoS2作为电子受体,捕获BiPO4上产生的电子,从而抑制电荷复合,使BiPO4产生的空穴更容易参与氧化过程,提高了对罗丹明B的降解活性.Tan[6]等采用超声波法合成了C3N4/BiPO4异质结构光催化剂,对RhB的催化活性比纯的BiPO4提高了约4.2倍.
Fe2O3作为一种半导体材料,具有磁性以及合适的禁带宽度[7],将其作为光催化剂的复合对象有助于催化剂的回收和催化活性的提高.Chang[8]通过原位沉积法合成了α-Fe2O3/Bi12O17Cl2,利用选区电子衍射和透射电子显微镜观察到了两种半导体之间形成的异质结结构,其在可见光下对甲基橙和2,4-二氯苯酚的活性都相对于Bi12O17Cl2都得到了增强.Wang[9]等通过水热法合成了一种磁性g-C3N4/α-Fe2O3/Fe3O4催化剂,在提高了活性的同时实现了催化剂的回收.Mahajan[10]将Fe2O3包覆在TiO2催化剂表面,在TiO2上形成了一层均匀的α-Fe2O3外壳,两者组装成了磁载光催化剂,既保持了对RhB良好地光催化活性,又可多次回收利用.
本文通过醇热法制备BiPO4-Fe2O3,并采用物理手段表征催化剂结构和光化学性质,以RhB作为目标污染物在紫外光下进行光催化性能实验,研究BiPO4-Fe2O3光催化特性,并通过对光催化反应过程中活性物种的跟踪测定,探讨光催化降解机理,采用循环和磁力回收实验考察催化剂的稳定性与可回收性,为催化剂的实际应用提供依据.
1 实验部分
1.1 主要实验试剂
5.00×10-4mol/L的Rh B水溶液;1.00×10-3mol/L的苯甲酸水溶液;1.00 g/L的辣根过氧化物酶(POD)水溶液;10.0 g/L的N,N-二乙基对苯二胺(DPD)水溶液;实验所用其它试剂纯度均为分析纯;所用水为二次蒸馏水.
1.2 实验部分
1.2.1 Fe2O3空心微球的制备
称取4 mmol的蔗糖(C12H22O11)和2 mmol的FeCl3·6H2O,同时溶入80 m L水中,搅拌至完全溶解后,再加入5 mmol的碳酰胺(CO(NH2)2),继续搅拌15 min,再将溶液转移至100 m L的反应釜中,160℃反应12 h,待冷却后,用水多次洗涤,放入80℃烘箱中干燥4 h,得到Fe2O3前驱体.再将其放入马弗炉中,500℃煅烧4 h,冷却,研磨,得到Fe2O3空心微球备用.
将Fe2O3空心微球加入60 m L的乙二醇溶液中超声30 min作为A液,称取0.97 g Bi(NO3)3·5H2O溶于少量稀硝酸中作为B液,A液加入B液,超声混合,再将3 mmol Na H2PO4·2H2O溶于少量水中,加入A、B混合溶液中,搅拌30 min后在180℃条件下反应24 h,冷却后用水和乙醇交替清洗3次,抽滤后后放入60℃烘箱中干燥24 h备用.
1.2.2 催化剂表征
采用Ultima IV型X射线衍射仪(XRD,Rigaku公司)对样品进行物相鉴定,其检测条件:扫描范围5~90°,扫描速度8°/min,步长0.02°连续扫描;对样品采用表面喷碳处理后,用JSM-7500F型扫描电子显微镜(SEM,Jeol公司)对样品进行表面形貌观察.
1.2.3 紫外光条件下光催化活性研究
取2.0 m L浓度为5.00×10-4mol/L的RhB溶液于光反应管(材质为石英玻璃)中用水稀释至2.50×10-5mol/L,加入20 mg BiPO4-Fe2O3,在暗箱中搅拌60 min达到吸附-脱附平衡后,紫外光下(λ=253.7 nm)进行光催化反应,每间隔20 min取样3 m L于5 m L EP管中,用8 000 r/min的转数离心10 min,取上清液使用紫外-可见分光光度计(Perkin Elmer,美国)在554 nm下测定上清液的吸光度值.1.2.4 反应过程中H2O2含量变化的测定[11]
取0.15 m L浓度为1.00%的DPD溶液和0.03 m L浓度为0.10%的POD溶液,加入到10 m L的具塞比色管中,再加入1.0 m L的Na H2PO4-NaOH缓冲溶液(p H值为6.80)稳定p H,震荡均匀;取3 m L不同反应时间的反应溶液,离心,取上清液1 m L加入到之前的具塞比色管中,震荡均匀;在510 nm下测定吸光度.
1.2.5 ·OH的测定[12]
苯甲酸溶液(0.010 mol/L)和相应反应时间上清液各取1 m L加入到10 m L比色管中,定容至5 m L,用F-4500荧光分光光度仪(Hitach,日本)测定荧光强度,测试条件为407 nm的发射波长和306 nm的激发波长,产生·OH的相对含量根据所测的相对荧光强度ΔF确定.
1.2.6 光催化稳定性实验
取2.0 m L浓度为5.00×10-4mol/L的RhB溶液于光反应管中用水稀释至2.50×10-5mol/L,加入20 mg
BiPO4-Fe2O3,在暗箱中搅拌60 min达到吸附-脱附平衡后,紫外光下进行光催化反应,每间隔20 min取样3 m L于5 m L EP管中,用8 000 r/min的转数离心10 min,取上清液在554 nm下测定上清液的吸光度值.测定完成后将下层沉积催化剂倒回光反应管中,待RhB溶液完全褪色后,再加入2 m L 5.00×10-4mol/L的RhB母液,并加入水使溶液体积仍为40 m L,使Rh B溶液仍为2.50×10-4mol/L,重复上述步骤5次.
2 结果与讨论
2.1 XRD分析
图1为BiPO4-Fe2O3的XRD图,由jade 5.0分析可知:BiPO4-Fe2O3复合物与六方相BiPO4(用*表示,JCPDS No.15-0766)[13]的 2θ=20.0°、25.4°、28.9°、45.2°对应的特征衍射峰能匹配,与Fe2O3(用●表示,JCPDS No.39-1346)[14]与2θ=30.2°、35.6°、43.3、57.3°、62.9°处特征峰匹配.可知制备粉末是BiPO4和Fe2O3的复合物.
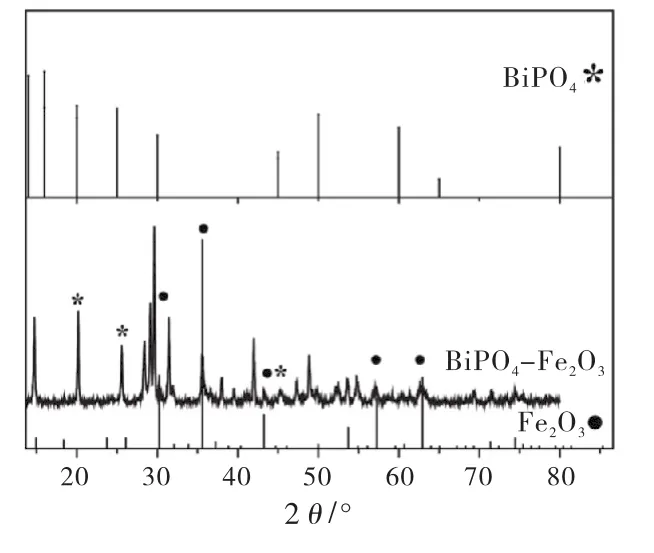
图1 BiPO4负载Fe2 O3的XRD图
2.2 扫描电镜分析
图2为BiPO4-Fe2O3和BiPO4的SEM图,对比发现,单纯的BiPO4结晶度较好,表面光滑,长宽约为为150 nm×50 nm的块状,在负载了Fe2O3后Bi-PO4-Fe2O3催化剂表面有粒状晶体附着.结合XRD图谱可以确定表面附着物为Fe2O3晶体,由于BiPO4块状晶体较大,Fe2O3晶体可以均匀地分散并附着在BiPO4状上,构成良好的BiPO4-Fe2O3异质结结构.

图2 BiPO4-Fe2 O 3与BiPO4的SEM图
2.3 紫外光下光催化活性比较
以BiPO4-Fe2O3、BiPO4和Fe2O3作为光催化剂,以RhB作为探针分子,在紫外光条件下进行光催化降解实验,比较了三者的光催化能力,如图3所示.
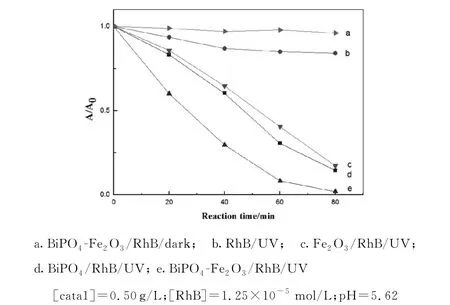
图3 不同催化体系降解RhB的动力学曲线
从图3可知:在暗反应过程中,RhB浓度没有变化,而在光反应过程中,RhB浓度下降显著,说明BiPO4-Fe2O3对Rh B的去除主要是通过降解作用而非吸附作用[15].3种催化剂对Rh B的降解动力学均符合一级动力学曲线,其中BiPO4-Fe2O3的活性最高,降解速率最快(k=0.049 min-1),约为单纯BiPO4的2.00倍(k=0.024 min-1)的和单纯Fe2O3的2.30倍(k=0.021 min-1).这表明BiPO4-Fe2O3在紫外光下相对于单纯的BiPO4和Fe2O3具有更高的光催化活性.这与BiPO4表面负载的Fe2O3所形成的异质结结构有关,异质结能有效抑制光生电子-空穴对的复合,这与其他异质结催化剂报告相一致[4-8].此外,Fe2O3在紫外光下可能与光催化过程中产生的重要中间产物H2O2构成了photo-Fenton反应,进一步加快了反应进程.为了验证这一点,对光催化反应过程中产生的H2O2含量变化进行了测定.
2.4 光催化过程中产生的H2 O2含量
H2O2是光催化过程中产生的一种重要中间产物,其含量变化能反映出光催化反应的反应进程.使用DPD分光光度法[16]对BiPO4-Fe2O3光催化降解RhB过程中产生的H2O2含量进行测定.从图4可以看出BiPO4产生的H2O2随着紫外光的引入呈现上升趋势,前80 min上升较快,到240 min时出现最大值,随后逐渐下降,说明H2O2的生成有一个先累积后消耗的过程.BiPO4-Fe2O3在整个光反应过程中也有H2O2的累积过程,但是其生成的H2O2浓度远低于BiPO4产生的H2O2,可能是BiPO4表面的Fe2O3将生成的H2O2通过photo-Fenton过程迅速分解为羟基自由基(·OH)等其他活性物种[17].
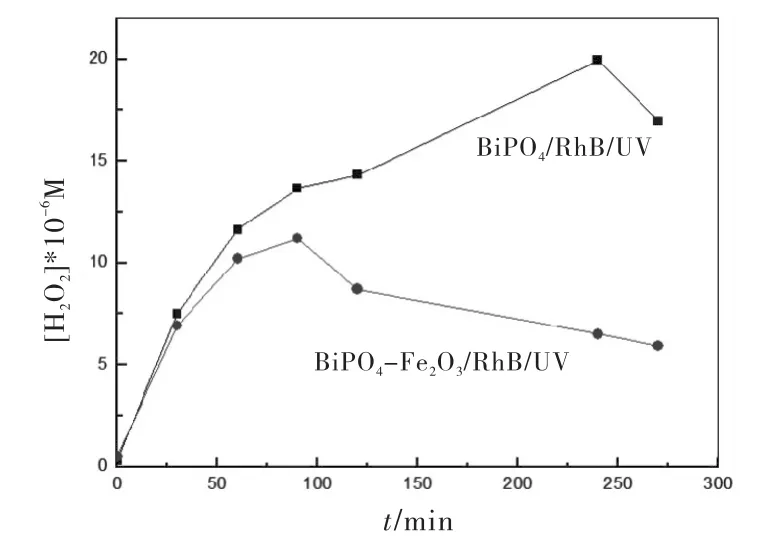
图4 RhB降解过程中的H 2 O 2跟踪测定
2.5 RhB降解过程中·OH的测定
为了确定表面Fe2O3与产生的H2O2构成了photo-Fenton反应,对光催化反应过程中产生的·OH含量变化进行了测定.因此对BiPO4-Fe2O3和单纯的BiPO4光催化降解Rh B过程中产生的·OH含量进行了测定,结果如图5所示.

图5 RhB降解过程中·OH含量的变化
可以发现,在相同条件下UV/BiPO4-Fe2O3/Rh B体系对单纯的UV/BiPO4/RhB体系中·OH含量明显要高.说明与单纯BiPO4体系相比,BiPO4-Fe2O3将反应过程中产生的一部分H2O2迅速转化为·OH,导致其产生H2O2含量与BiPO4相比不升高反降低(如图5所示).因此可以推断,BiPO4表面Fe2O3与产生的H2O2构成Fenton体系,产生了更多的·OH,从而实现对RhB的高效降解.
2.6 BiPO4-Fe2 O3催化剂的稳定性及回收实验
图6为BiPO4-Fe2O3在紫外光下的稳定性实验,经过5次循环实验,其光催化活性几乎没有变化,对RhB的降解率仍维持在98%左右,说明其稳定性良好.由于Fe2O3具有优异的顺磁性,BiPO4-Fe2O3催化剂能够在水中均匀分布,当加入磁力搅拌子后,催化剂能迅速吸附在磁力搅拌子上(如图7所示),水体迅速变得清澈,这表明BiPO4-Fe2O3复合物也具有较好的磁性,这对于BiPO4催化剂的回收再利用具有实际应用价值.
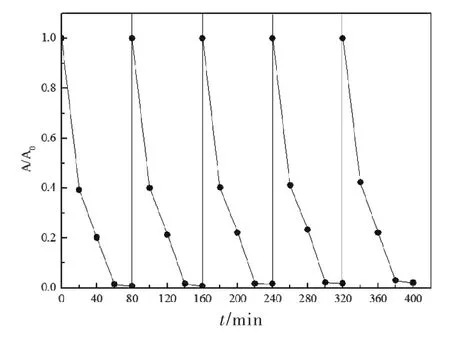
图6 BiPO4-Fe2 O3光催化稳定性实验

图7 BiPO4-Fe2 O3的磁性
2.7 BiPO4-Fe2 O3异质结催化剂的光催化机理
通过BiPO4-Fe2O3复合材料的异质结结构形貌、催化活性及氧化物种等分析测试,对其可能的光催化降解机制提出了猜想(如图8所示).
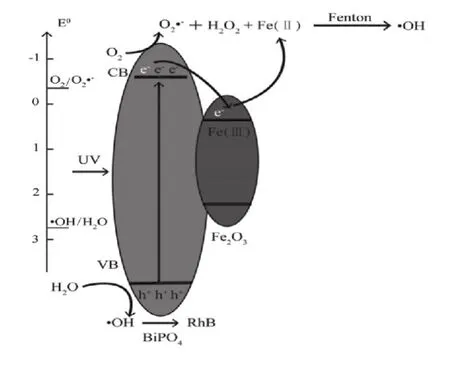
图8 BiPO4-Fe2 O3光催化机理图
由于BiPO4导带电势为-0.40 e V,价带为4.28 e V,分别高于O2/O2.-还原电势(-0.31 e V)和H2O/·OH氧化电势(2.79 eV),表明在紫外光激发下BiPO4导带发生了O2→O2.-→H2O2,价带产生的·OH氧化降解RhB;而Fe2O3导带电势为0.28 e V,价带为2.48 e V,这表明BiPO4导带电子容易转移至Fe2O3导带使其还原为Fe(II),与产生的H2O2形成了Fenton反应,产生更多的·OH,进一步提高光催化活性.
3 结 论
通过溶剂热法制备出Fe2O3空心微球,用溶剂热法制备BiPO4-Fe2O3复合物,对催化剂的光催化活性实验发现,BiPO4-Fe2O3在紫外光下对RhB具有很好的催化活性,光照60 min后,RhB(浓度为2.50×10-5mol/L)的褪色率达到99.8%;通过对降解过程的中间产物测定,发现BiPO4-Fe2O3可以生成大量的H2O2和·OH.对催化剂的回收再利用做了测试,发现其具有磁性,能通过外加磁力的方法进行回收再利用,这为光催化的实际应用提供了保障.
