邻苯二酚和甲醇合成邻苯二甲醚的热力学分析
2019-03-22韩雪娟张晓杰
韩雪娟,张晓杰
(烟台大学 化学化工学院,山东 烟台 264000)
邻苯二甲醚又称1,2-二甲氧基苯,黎芦醚,是有机合成中的重要中间体,在医学方面可用于合成延胡索乙素、异博定等;在农业方面是杀菌剂烯酰吗啉合成中的一个关键中间体,还是检测血液中乳酸,测定甘油的试剂,许多存在于自然界的生物碱都是邻苯二甲醚的衍生物[1-3]。目前制备邻苯二甲醚的方法有邻苯二酚法[4]、愈创木酚法、邻氯苯甲醚法[5]。邻苯二酚法[6]按甲基化的试剂不同可分为:碘甲烷法、磷酸二甲酯法、氯甲烷法和甲醇法。其中碘甲烷法和磷酸二甲酯法收率高,但试剂毒性大、废水处理困难,造成成本偏高。氯甲烷法以水和甲苯作溶剂,使用相转移催化剂促进反应进行,成本高,且甲苯有毒,对人体造成危害,其蒸汽与空气混合易爆炸。
以邻苯二酚为原料,甲醇为甲基化试剂由于其操作简单,价格低廉,绿色环保已成为工业化合成邻苯二甲醚的主要发展方向。但由于反应尚处于研究阶段[7-10],热力学数据的报道尚未见到。只有2014年有关文献[11]对甲醇和邻苯二酚合成邻苯二甲醚的中间产物愈创木酚做了热力学分析,但由于所计算ΔrCp,m的有些错误,因而热力学数据并不准确。热力学分析是化学反应进行的可能性和反应限度的重要判据,其对操作条件的确定,反应装置的设计等生产工艺优化研究[12-13]具有重要的指导意义。基于此,本文研究邻苯二酚和甲醇合成邻苯二甲醚及副产物愈创木酚的ΔrHm、ΔrGm、平衡常数 K随温度的变化,进一步计算反应平衡转化率,从热力学的角度出发,以期为提高主产物减少副产物收率提供理论指导[14]。
1 热力学计算
在固定床反应器上进行邻苯二酚与甲醇气相醚化反应,反应原料先混合溶解,然后进入预热器预热气化,在催化剂床层反应。
1.1 邻苯二酚和甲醇合成反应[15]
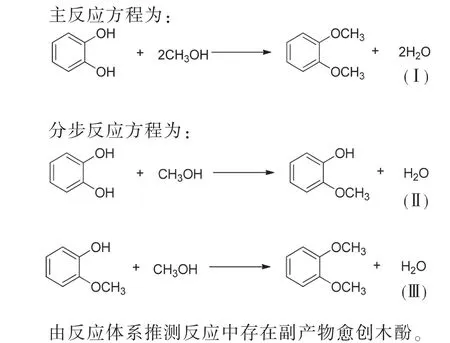
1.2 Benson基团贡献法
Benson基团贡献法以原子或原子团为中心,并考虑以此原子或原子团相连的原子或原子团的不同来划分基团,适用范围广,精确度高。采用Benson基团贡献法[16-17]计算邻苯二酚、邻苯二甲醚和愈创木酚的标准摩尔焓值,熵值和等压热容,甲醇和水的热力学数据可由文献或手册[18]查到。其计算公式如下(1)、(2)、(3)所示:

其中:ni为第i种基团数,δ为分子对称数,η为光学异构体数,各组分的δ和η值见表1,各基团的和 Cp,m贡献值见表 2,计算的各物质的、Cp,m见表 3。

表1 参与反应的各组分的δ和η值

表2 邻苯二甲醚,邻苯二酚,愈创木酚标准热力学基团贡献值

表3 邻二甲醚、愈创木酚、邻苯二酚、甲醇和水的热力学数据
1.3 反应ΔrHm,和ΔrGm平衡常数的计算
由 ΔrCp,m=Δa+ΔbT+ΔcT2、得,反应(Ⅰ)、(Ⅱ)、(Ⅲ)的ΔrGp,m与T的关系式:

根据基尔霍夫 (Krihhoff) 定律:(dΔrHm/dT)p=ΔrCp,m积分后得反应的(Ⅰ)、(Ⅱ)、(Ⅲ)的 ΔrHm与 T 的关系式:

由表3各物质的标准摩尔生成焓,可计算反应在298.15K时的焓变值,即反应(Ⅰ)为-31.3kJ/mol,反应(Ⅱ)、(Ⅲ)为 -15.65kJ/mol代入(7)、(8)、(9)得到ΔrHm与T的关系式:
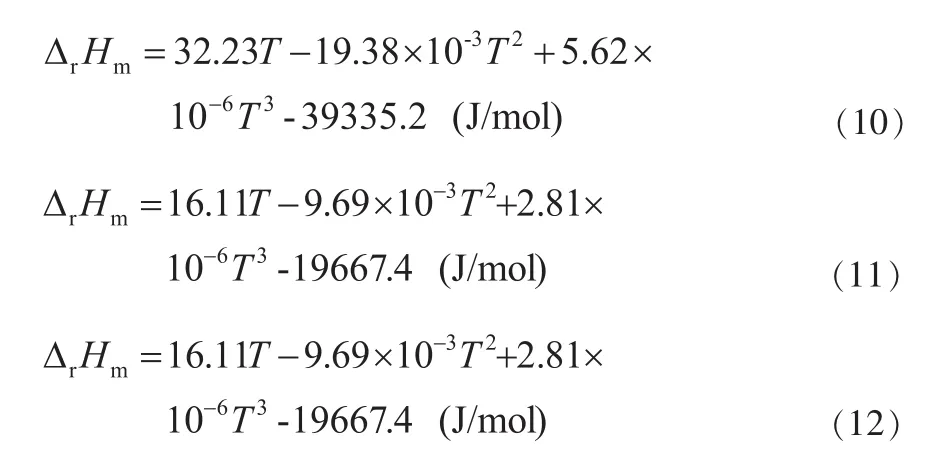
根据,ΔrCm=Δr-T×Δr,[d(ΔrGm/T)/dT]p=ΔrHm/T2得反应(Ⅰ)、(Ⅱ)、(Ⅲ)ΔrGm与 T 之间的关系式:

由ΔrGm=-RTlnK得反应的平衡常数:
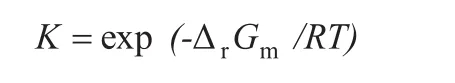
通过不同温度下的平衡常数,可进一步计算反应在相应的配比下的平衡转化率。设转化率为X,甲醇与邻苯二酚的物质的量比为a,则反应 (Ⅰ)、(Ⅱ)、(Ⅲ)平衡常数与平衡转化率之间的关系为:

分别取甲醇和邻苯二酚的物质的量比为2.0、2.4、2.8、3.0,通过式(16)、(17)计算不同温度下的转化率X。
2 结果与讨论
由于反应(Ⅱ)、(Ⅲ)的 ΔrHm、ΔrGm、K 均相同,所以以下仅对反应(Ⅱ)进行分析。
2.1 Benson基团贡献法的验证
2.2 反应温度对焓变的影响
由图1可知在400~800k范围内反应 (Ⅰ)、(Ⅱ)的焓变值均小于零,都是放热反应,所放出的热量均随温度的升高而减小,说明温度对反应(Ⅰ)、(Ⅱ)的热效应均有较大的影响。

图1 ΔrHm随T的变化曲线
2.3 反应温度对自由能变的影响
由图2可知在400~800K范围内反应 (Ⅰ)、(Ⅱ)的自由能变均为负值,反应在热力学上是允许进行的。ΔrGm随着温度的升高而减小,(Ⅰ)的自由能变远大于(Ⅱ),(Ⅰ)的自发进行的趋势更明显。

图2 ΔrGm随T的变化曲线
2.4 平衡常数随温度的变化
由图 3 可知在 400~800K 范围内,反应(Ⅰ)、(Ⅱ)均有较大的平衡常数,由于反应放热,平衡常数随着温度的升高而减小。且反应(Ⅰ)的平衡常数下降速度比较快,表明较低温度对反应有利,更利于主产物邻苯二甲醚的生成。

图3 lnK随T的变化曲线
2.5 邻苯二酚的平衡转化率随温度的变化
图4和图5分别为反应(Ⅰ)、(Ⅱ)邻苯二酚在不同的温度,不同的物质的量比下的平衡转化率,由图可知,随着温度的升高邻苯二酚的转化率逐渐降低,在较低温度下转化率可达到99%以上。转化率随着甲醇和邻苯二酚物质的量比的增大而增加,且生成主产物的增加速度大于副产物,通过比较可发现,甲醇与邻苯二酚的物质的量比增大,对提高邻苯二甲醚的收率更有利,为使原料利用率高,物质的量比取3较为合适。

图4 主反应转化率随温度的变化曲线

图5 副反应转化率随温度的变化曲线
3 结论
采用Benson基团贡献法对邻苯二酚和甲醇合成邻苯二甲醚的热力学进行计算,其结果表明在400~800K 范围内,反应的 ΔrHm<0,ΔrGm<0,为放热反应,可以自发进行。随着温度的升高,反应所放出的热量减少,平衡常数也减小,即低温对反应有利。
探讨了物质的量比对生成邻苯二甲醚和愈创木酚平衡转化率的影响,当甲醇和邻苯二酚物质的量比大于3时,对于提高邻苯二甲醚的收率有利,因此甲醇和邻苯二酚物质的量比取3较为合适。
通过比较发现反应(Ⅰ)较反应(Ⅱ)、(Ⅲ)更易自发进行,而反应(Ⅲ)与(Ⅱ)的 ΔrHm、ΔrGm与 K 随 T 的变化相同,由此可见主产物邻苯二甲醚易于生成。
