南方水稻黑条矮缩病抗性的遗传分析及主效QTL的精细定位
2019-03-22农保选秦碧霞夏秀忠杨行海张宗琼曾宇邓国富蔡健和李战彪刘丕庆李丹婷
农保选 秦碧霞 夏秀忠 杨行海 张宗琼 曾宇 邓国富 蔡健和 李战彪 刘丕庆 李丹婷, *
南方水稻黑条矮缩病抗性的遗传分析及主效QTL的精细定位
农保选1, 2, 3秦碧霞4夏秀忠2, 3杨行海2, 3张宗琼2, 3曾宇2, 3邓国富2, 3蔡健和4李战彪4刘丕庆1, *李丹婷2, 3, *
(1广西大学 农学院, 南宁 530004;2广西农业科学院 水稻研究所, 南宁 530007;3广西水稻遗传育种重点实验室, 南宁 530007;4广西农业科学院 植物保护研究所, 南宁 530007;*通讯联系人, E-mail: liupq@gxu.edu.cn; ricegl@163.com)
【目的】近年来由白背飞虱传播的南方水稻黑条矮缩病给水稻生产造成了巨大损失,开展该病的抗性遗传分析和基因精细定位,将为抗性育种提供材料和理论依据。【方法】分析了抗性材料D4对南方水稻黑条矮缩病的抗性特征,并通过广恢998/D4 F2群体分析该病抗性的遗传规律,利用QTL-seq技术联合遗传连锁分析定位主效抗性QTL。【结果】D4对南方水稻黑条矮缩病的抗性表现为抗病毒性而非抗虫性,且受主效基因和微效基因共同控制。QTL-seq和连锁分析将南方水稻黑条矮缩病主效抗性QTL定位于第9染色体上,命名为。利用代换作图法进一步将定位在102.3 kb的区间内,该区间包含21个预测基因,其中9个基因与赤霉素信号传导相关。【结论】揭示了D4对南方水稻黑条矮缩病的抗性特征及遗传规律,精细定位了南方水稻黑条矮缩病主效抗性QTL。这为该QTL的图位克隆及育种利用奠定了基础。
南方水稻黑条矮缩病;白背飞虱;遗传分析;QTL;精细定位
南方水稻黑条矮缩病是一种以白背飞虱为主要传播介体的病毒性病害[1],2001年首次被中国学者周国辉在广东省阳西县晚稻田中发现[2]。2008年,周国辉等[1]将南方水稻黑条矮缩病毒(, SRBSDV)鉴定为呼肠孤病毒科()斐济病毒属()的一个新种。SRBSDV由传播媒介白背飞虱以持久增殖型方式传播,病毒粒子由白背飞虱的口针吸食进入虫体内,再通过白背飞虱的取食经唾液侵染水稻植株[3]。自21世纪初以来,该病害的发生给中国和越南北部等地区的水稻生产造成了极大的危害,局部地区严重暴发导致绝收[4-7]。水稻发病植株的典型症状为矮缩、叶色浓绿、叶鞘上有乳白色或黑褐色瘤状凸起等[1]。与本病害不同,水稻黑条矮缩病是一种主要由灰飞虱(Fallén)传播的水稻病毒病,虽然其病原与南方水稻黑条矮缩病同属于斐济属病毒,两者在症状、血清学、病毒粒体形态及基因组序列等方面非常相似[1, 2, 8-10],但二者发病症状存在不同之处,“高节位分枝”和“倒生根”在水稻黑条矮缩病中较少出现。除此之外,二者在传毒介体、发病范围、发病规律、品种抗性及防治措施等方面均存在差异[1, 5, 7, 11-16]。目前,水稻生产上主要采取化学药剂杀灭白背飞虱的办法来防治南方水稻黑条矮缩病[5, 7, 13]。
培育抗病新品种,是控制各类病害最经济有效、最环保的措施,而筛选新抗源、发掘抗病新基因是开展抗病育种的前提和基础。当前对南方水稻黑条矮缩病的研究主要集中在病毒检测[17, 18]、生物学特点[3, 19-21]、发生为害及综合治理[22-26]等方面,关于抗性材料筛选的报道较少,筛选到的抗源有限。潘凤英等[27]采用田间自然诱发鉴定方法,从19份水稻雄性不育系材料中筛选出1份高抗、3份中抗材料。刘琳琳[14]采用人工接种方法测定了24个水稻品种的南方水稻黑条矮缩病发病率,仅鉴定出3个中抗品种。秦碧霞等[16]采用人工接种方法对45份广西主栽水稻品种和53份市场销售的水稻品种进行南方水稻黑条矮缩病抗病性鉴定,结果显示高感品种和中感品种分别占测试品种的97.96%和2.04%,未发现抗病品种,与田间实际表现基本吻合。余守武等[28]采用人工接种鉴定方法,从98份水稻中间材料中筛选到6份南方水稻黑条矮缩病抗性较好的光温敏核不育系材料。迄今为止,对南方水稻黑条矮缩病抗性的遗传研究还鲜见报道,尚无关于抗性基因或QTL定位的报道。
本研究分析了普通野生稻高代回交导入系D4的南方水稻黑条矮缩病抗性特征,对其抗性进行遗传分析,并利用QTL-seq技术对南方水稻黑条矮缩病主效抗性QTL进行定位,通过遗传连锁分析验证并精细定位该QTL。研究结果将为南方水稻黑条矮缩病的抗性育种提供新的基因资源,同时为该QTL的图位克隆和功能研究奠定基础。
1 材料与方法
1.1 供试材料
GW118为广西普通野生稻材料,高抗南方水稻黑条矮缩病;广恢998为三系杂交稻恢复系,感南方水稻黑条矮缩病。以广恢998为受体,GW118为供体,构建了包含297个株系的高代回交导入系群体(BC3F4),D4是该导入系群体中的一个高抗南方水稻黑条矮缩病株系。PTB33(抗虫对照)及台中在来一号(TN1)(感虫对照和感病对照)由广西农业科学院植物保护研究所水稻害虫研究课题组提供。以D4(抗病亲本)作为父本,广恢998(感病亲本)作为母本,经过杂交、自交,获得包含5004个F2单株的遗传分离群体。分别提取每个单株的DNA保存备用,同时,分别收获每个F2单株的种子备用。
1.2 白背飞虱抗性鉴定
以排驱性和抗生性测验鉴定水稻材料的白背飞虱抗性,参照Wang等[29]方法并稍加改动。抗虫对照品种为PTB33(具排驱性和抗生性)、感虫对照品种为TN1(无排驱性和抗生性)。将D4、广恢998、TN1及PTB33的种子催芽露白后选取长势均一的种子播于塑料盘(41 cm×34 cm×7 cm),每份材料种植1行,每行10株,株行距为3 cm×8 cm,置于光照培养箱内培养(26℃±1℃,15 h光照/9 h黑暗)。于1.5~2.0叶龄期,按每株苗5头虫的总量接种2~3龄幼虫,24 h后,于每天8:00、16:00两次记录落在每个单株上的虫数,每次调查完成后驱虫,使其尽可能均匀分布。5 d后计算每份材料每个单株上的平均虫数,作为排驱性测验值,植株上虫量越少其排驱性越强。将D4、广恢998、TN1及PTB33的种子催芽露白后,选取生长势均一的种子播于直径12 cm、高15.5 cm,并铺有2 cm厚营养土的玻璃杯中,每份材料5株,置于光照培养箱内培养(26℃±1℃,15 h光照/9 h黑暗)。于1.5~2.0叶龄期,每杯接入20头1~2龄幼虫,纱网封口,于1、3、5、7 d后统计每个杯子剩余的虫数,计算幼虫的存活率,作为抗生性测验值,虫子存活率越低表示品种抗生性越强。
1.3 南方水稻黑条矮缩病的接种鉴定
水稻病株采自广西三江县(E108°99',N25°57'),传毒介体白背飞虱采自广西南宁市西乡塘区石埠镇(E108°22',N22°83')。人工接种参照秦碧霞等[16]方法,稍加改动,把健康低龄白背飞虱转到水稻病株上饲毒2~3 d,再转到健康TN1稻苗上,饲养10~12 d度过循回期后作为接种传毒介体。在广西农业科学院水稻研究所人工气候室内进行接种,温度为26℃~28℃,相对湿度为75%~90%,将待鉴定水稻材料种植在1 L的透明塑料杯中,每杯种植材料35株,于1.5~2.5叶龄期,淘汰弱苗,选取生长一致的30株幼苗进行接种,接虫量为每株苗4头虫,每天8:00和16:00驱虫两次,保证鉴定材料均匀获毒,传毒2 d后将虫转移走,将已接种的水稻苗移植到防虫网室或温室,常规管理。接种20 d后调查每个品种的发病株数,之后每隔7 d调查1次,共调查3次,统计每个品种的发病率。重复3次,感病对照品种为TN1。发病率(%)=发病株数/总株数×100。抗性分级标准如下:0级,发病率为0.0%,免疫(I);1级,发病率为0.1%~5.0%,高抗(HR);2级,发病率为5.1%~30.0%,中抗(MR);3级,发病率为30.1%~60.0%,中感(MS);4级,发病率大于60.0%,高感(HS)。
1.4 全基因组重测序及分析
随机选取357份广恢998和D4衍生的F2:3株系进行人工接种鉴定后,根据鉴定结果,从F2群体中筛选出高抗(发病率不大于5.0%)和高感(大小于60.0%)的植株各50株,分单株提取等量DNA混匀,构建抗、感基因池用于全基因组重测序。文库构建、测序、生物信息学分析参照Yang等[31]方法进行,SNP-index关联分析参照Takagi等[32]方法进行。
1.5 QTL验证及精细定位
以水稻品种日本晴基因组序列为参考序列,利用D4和广恢998的全基因组重测序序列在第9染色体上的InDel信息,开发InDel标记。利用多态性InDel标记对F2群体的单株进行基因型分析,使用Join Map 4.0[33]进行连锁分析,绘制连锁遗传图,使用Map QTL 6.0[34]进行QTL扫描,利用重组单株进行精细定位。
2 结果与分析
2.1 D4对南方水稻黑条矮缩病和传毒介体白背飞虱的抗性表现
人工接种结果显示,D4的南方水稻黑条矮缩病发病率为4.86%,表现高抗;广恢998的发病率为82.23%,表现高感,二者差异极显著(图1)。对白背飞虱的排驱性测验结果显示,抗虫对照品种PTB33单株平均虫量仅为1.2头,明显少于接种量5头,表现出明显的白背飞虱排驱性,而D4、广恢998及TN1单株虫量与接种量无显著差异(图2-A),表明高抗南方水稻黑条矮缩病材料D4、高感材料广恢998及高感对照材料TN1均无排驱性。抗生性测验结果显示,D4、广恢998及TN1接种7 d后植株上白背飞虱存活率约90%,同时三者之间无显著性差异,而高抗品种PTB33植株上白背飞虱存活率显著下降,存活率仅为52.5%(图2-B),表明高抗南方水稻黑条矮缩病材料D4、高感材料广恢998及高感对照材料TN1均无白背飞虱抗生性。综合分析抗病性和抗虫性表现,发现抗病材料D4无白背飞虱排驱性与抗生性,说明其对南方水稻黑条矮缩病的抗性为抗病毒性而非抗虫性。
2.2 D4对南方水稻黑条矮缩病抗性的遗传分析
从广恢998与D4衍生的F2:3株系中随机抽取267份F2:3株系进行人工接种鉴定,结果显示该F2群体的南方水稻黑条矮缩病抗性呈偏正态连续性分布,表型分布部分偏向抗性亲本D4(图3),表明D4的南方水稻黑条矮缩病抗性可能受主基因和微效基因共同控制。

A−D4接种南方水稻黑条矮缩病毒的表型;B−广恢998接种南方水稻黑条矮缩病毒的表型。N−未接种对照;I−接种。
Fig. 1. Phenotype of D4 and Guanghui 998 by artificial inoculation of SRBSDV.

A−D4和广恢998(GH998)及两个对照品种对白背飞虱的排驱性表现;B−白背飞虱在D4和广恢998及两个对照品种中的存活率。数据用平均值±标准误表示, n=3。柱上相同字母表示差异未达0.01显著水平(t测验)。
Fig. 2. Resistance to white-backed planthoppers(WBPH) in D4 and Guanghui 998.
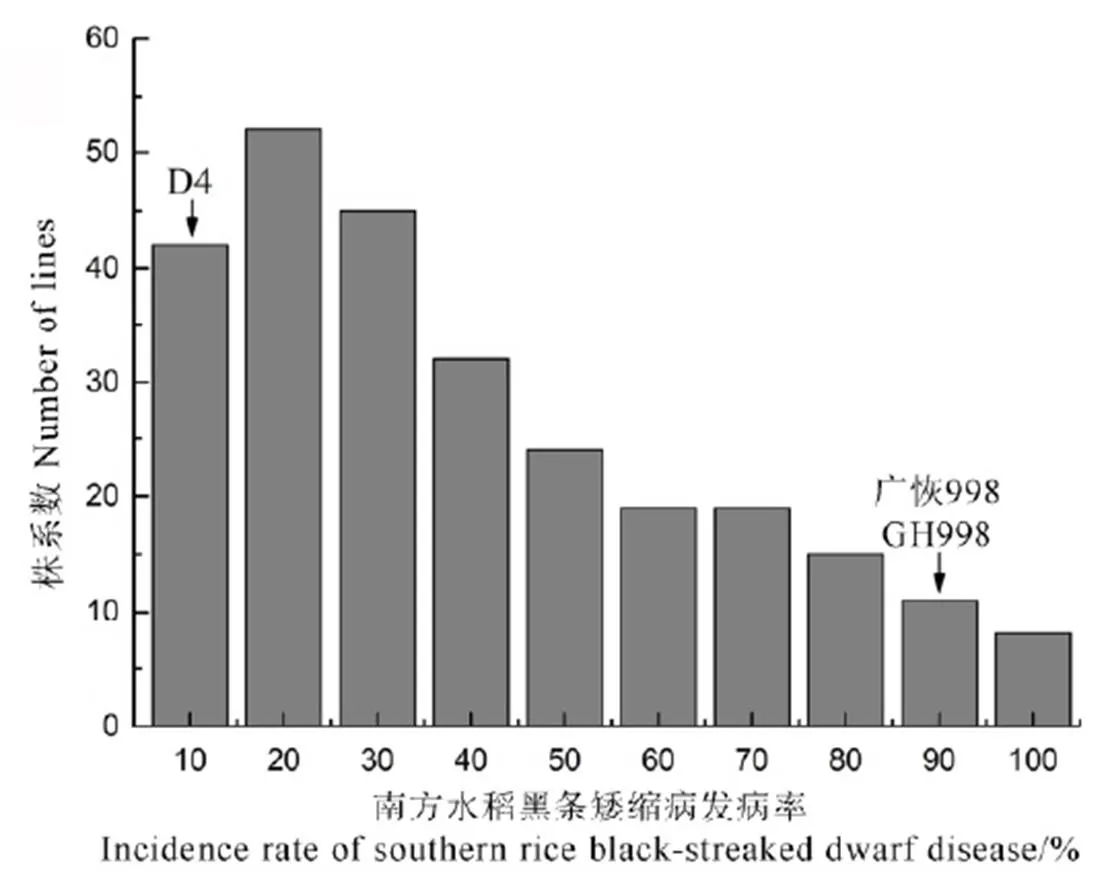
图3 广恢998/D4 F2:3株系接种南方水稻黑条矮缩病后的发病率频率分布
Fig. 3. Frequency distribution of the F2:3lines derived from the cross between Guanghui 998(GH998) and D4 with southern rice black-streaked dwarf disease as determined by artificial inoculation identification.
2.3 重测序数据统计
利用Illumina HiSeq测序系统对D4、广恢998、抗池及感池进行全基因组重测序,共获得110.39 G的测序数据,过滤后,获得了106.05 G的有效数据。将亲本及抗、感池的测序数据与参考基因组日本晴序列(http://rice.plantbiology.msu.edu/pub/data)比对(表1),结果显示D4获得142 913 376条有效测序的reads,覆盖基因组92.66%的序列,平均测序深度为55.88×。广恢998获得195 193 248条有效测序的reads,覆盖基因组93.26%的序列,平均测序深度为76.28×;基于基因分型的结果,分别筛选D4和广恢998中纯合的SNP位点,共获得2 977 061个多态性标记用于下一步的性状相关QTL定位。
2.4 单核苷酸多态性(SNP)分析
以1 Mb为窗口、100 kb为步长计算每个子代池的SNP指数及其增值。对比感池与抗池的SNP指数,在95%置信水平下,大于阈值的窗口作为候选区间。在第9染色体上的16 300 001−17 700 001 bp区间出现了SNP不平衡的状况(图4),表明感池单株在此区段与广恢998含有相同的片段,而抗池单株在同一区域与D4含有相同的片段。以95%置信水平作为筛选阈值,该区域的SNP指数增值大于阈值,因此第9条染色体16 300 001−17 700 001 bp可能存在控制南方水稻黑条矮缩病的主效抗性QTL位点,命名为。
2.5 南方水稻黑条矮缩病主效抗性位点qSRBSDV9的验证与精细定位
利用D4与广恢998杂交、自交产生的F2群体及其衍生的F2:3株系对进行验证及精细定位,对F2:3株系进行南方水稻黑条矮缩病人工接种鉴定,以F2:3的发病率来推测F2群体中各单株的表型和基因型。为了验证定位结果的准确性,在第9染色体上设计了70对InDel引物,选取其中10对在亲本间具有良好多态性的InDel标记(表2),结合表型检测F2群体基因型,结果显示在标记Indel 7和Indel 40之间(物理位置为16.3 Mb−17.7 Mb)检测到一个与南方水稻黑条矮缩病相关的主效抗性QTL,其位置与的位置相同。LOD值为4.8,可以解释34.6%的表型贡献率(图5-A)。
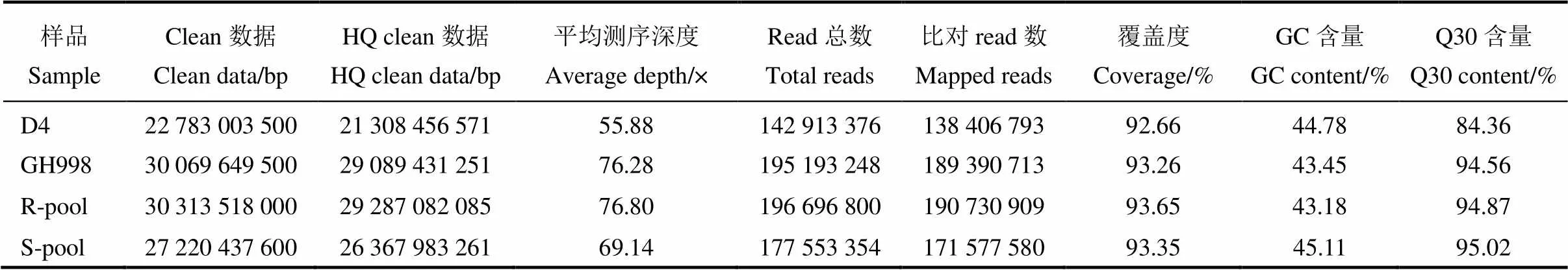
表1 D4、广恢998(GH998)、抗池(R-pool)及感池(S-pool)测序结果数据统计
Clean数据−原始数据量, 测序序列的个数乘以测序序列的长度, 以bp为单位;HQ clean数据−过滤之后的有效数据量, 过滤后测序序列的个数乘以测序序列的长度, 以bp为单位;平均测序深度−比对到参考基因组的碱基总数除以基因组大小;Read总数−有效测序数据的reads总条数;比对read数−比对到参考基因组上的reads条数(包括单端比对和双端比对);覆盖度−测序获得的序列占参考基因组(排除N区)的比例;GC含量−碱基G和C的数量总和占总的碱基数量的百分比;Q30含量−Phred数值大于30的碱基占总体碱基的百分比。
Clean data, Raw data production, the number of sequencing sequences multiplied by the length of the sequencing sequence; HQ clean, Valid data after filtering, the number of filtered sequencing sequences multiplied by the length of the sequencing sequence; Average depth, The total number of bases aligned to the reference genome divided by the genome size; Total reads, The total number of reads of validated data; Mapped reads, The total number of reads compare on the reference; Coverage, The proportion of the sequence obtained by sequencing to the reference genome; GC content, Percentage of the total number of bases G and C as a percentage of the total number of bases; Q30 content, Percentage of bases with Phred value greater than 30 to total bases.
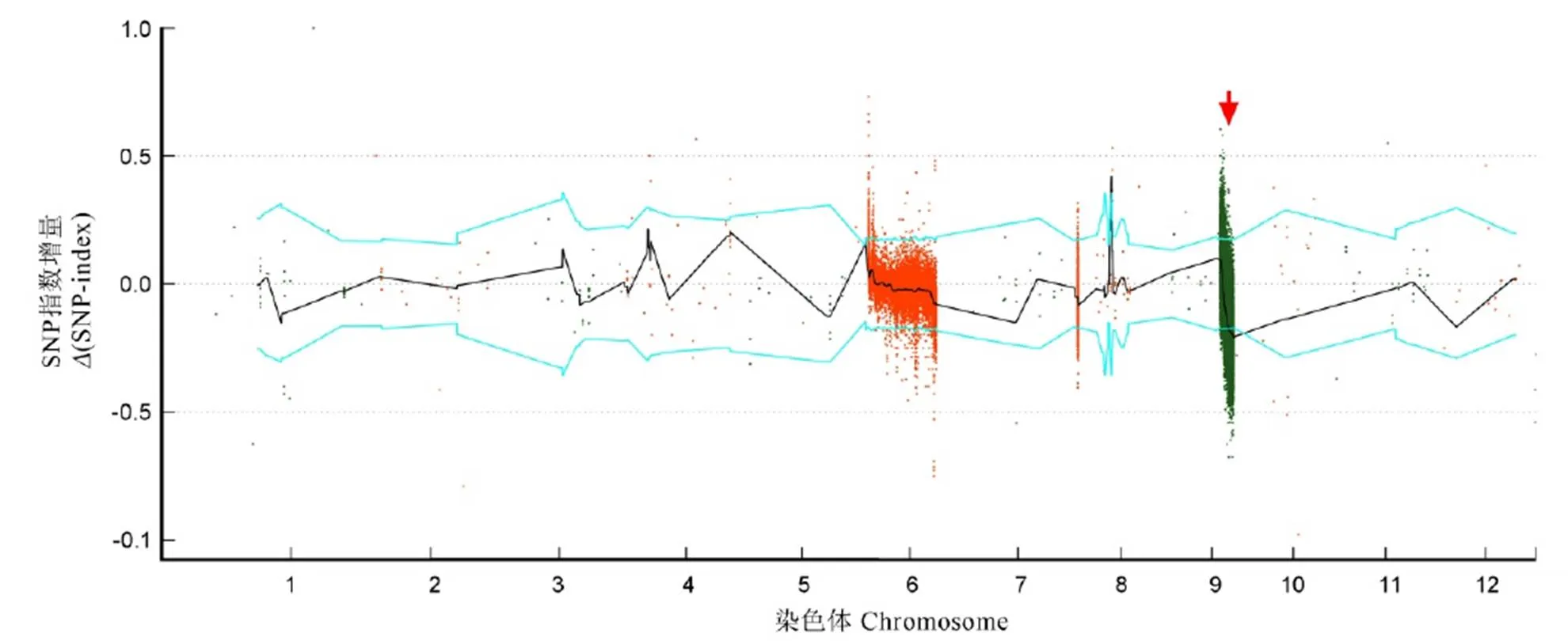
横坐标表示染色体位置, 纵坐标表示SNP指数增量(突变型减去野生型)。图中每个点代表每个SNP指数增量, 相邻的染色体分别用橙色和绿色的点来表示, 黑线代表各个窗口SNP指数的平均值拟合线。蓝线代表95%置信水平的阈值线。
Fig. 4.(SNP-index) value distribution in rice chromosomes.
进一步在定位区间内开发了15对具有良好多态性的InDel标记,并对F2群体各株系进行基因型分析,最终筛选到12株在该区段重组的单株。结合F2:3株系的表型,最终将定位在InDel标记M10和M12之间,物理距离为第9染色体上17 393 019−17 495 354 bp(102.3 kb)区间内(图5-B)。利用水稻基因组注释数据库MSU-RGAP(http://rice.plantbiology.msu.edu/)对候选基因组区域进行基因预测,发现该区段共包含21个基因,其中、、、、、、、及等9个基因编码产物均为赤霉素受体蛋白。
3 讨论
南方水稻黑条矮缩病是由白背飞風传播的病毒病,寄主对其抗性分为抗虫性和抗病性。目前,虽然一些学者鉴定出了一些抗南方水稻黑条矮缩病的材料[14, 27, 28],但是关于不同水稻材料对南方水稻黑条矮缩病抗性特征的研究较少。本研究结果表明普通野生稻高代回交导入系D4对南方水稻黑条矮缩病的抗性主要来自于对病毒本身的抗性而非抗虫性,这与D4在室内和田间抗性鉴定中的稳定高抗表现一致。南方水稻黑条矮缩病抗性的遗传分析结果表明,其表现为数量性状特征,这与水稻黑条矮缩病的抗性遗传特征类似[35, 36]。

表2 本研究中定位qSRBSDV9所用的InDel标记
用常规方法培育抗南方水稻黑条矮缩病水稻品种耗时耗力,对水稻重要农艺性状相关基因进行精细定位,开发与目标基因紧密连锁的标记,可实现基因的直接选择和有效聚合,大幅度提高育种效率,缩短育种年限[37]。然而,目前尚未见与南方水稻黑条矮缩病抗性相关的基因或QTL定位的研究报道。潘存红等[38]利用珍汕97B/明恢63的RIL群体,在第9染色体上SSR标记RM257−RM215间检测到一个黑条矮缩病抗性QTL,与不在同一位点。Chen等[39]在第9染色体上标记RG451−RM245间也检测到抗白背飞虱位点。其中,与在第9染色体上的物理位置重叠,但本研究材料D4对白背飞虱无抗性,说明与不是同一个基因。本研究将来自抗源D4的南方水稻黑条矮缩病主效抗性QTL精细定位在第9染色体17 393 019 −17 495 354 bp区域内,是一个新的与南方水稻黑条矮缩病抗性相关QTL。
在候选基因组区域内有21个预测基因,其中9个基因均编码赤霉素受体蛋白。赤霉素(gibberellin,GA)是调控植物生长发育的一类重要激素,其主要作用为促进植物茎、叶伸长。Russell等[40]研究表明,大麦黄矮病毒(,BYDV)侵染大麦植株后,其体内的GA含量降低导致大麦矮化;Sridhar等[41]研究表明,受水稻东格鲁球状病毒(,RTSV)侵染后,寄主体内的GA同系物含量降低明显,这可能是诱导植株矮化的一个主要原因;Zhu等[42]研究表明水稻矮缩病毒(,RDV)通过降低GA的合成而产生矮缩症状;吴建国等[43]研究也表明,水稻植株受RDV侵染后,染病株体内GA含量显著低于健康株。杨阳[44]研究表明,感染南方水稻黑条矮缩病毒后,水稻植株体内的赤霉素含量显著降低,这可能与南方水稻黑条矮缩病毒对水稻造成生长迟缓、植株矮化等症状有关。Tao等[45]研究发现,水稻黑条矮缩病(,RBSDV)编码的P7-2蛋白与水稻植株的赤霉素代谢蛋白GID2相互作用,RBSDV对GA信号传导途径可能产生影响。在前期研究中,我们发现无论是抗病还是感病材料,感染南方水稻黑条矮缩病毒后,病株体内的赤霉素含量均显著低于健康植株,但抗病植株体内的赤霉素含量比感病植株的含量高[46]。本研究中,在候选基因组区域内有21个预测基因,其中9个基因编码赤霉素受体蛋白。这表明SRBSDV的侵染可能对水稻植株赤霉素信号转导造成影响,进一步减少了赤霉素合成量,最终导致植株矮化。
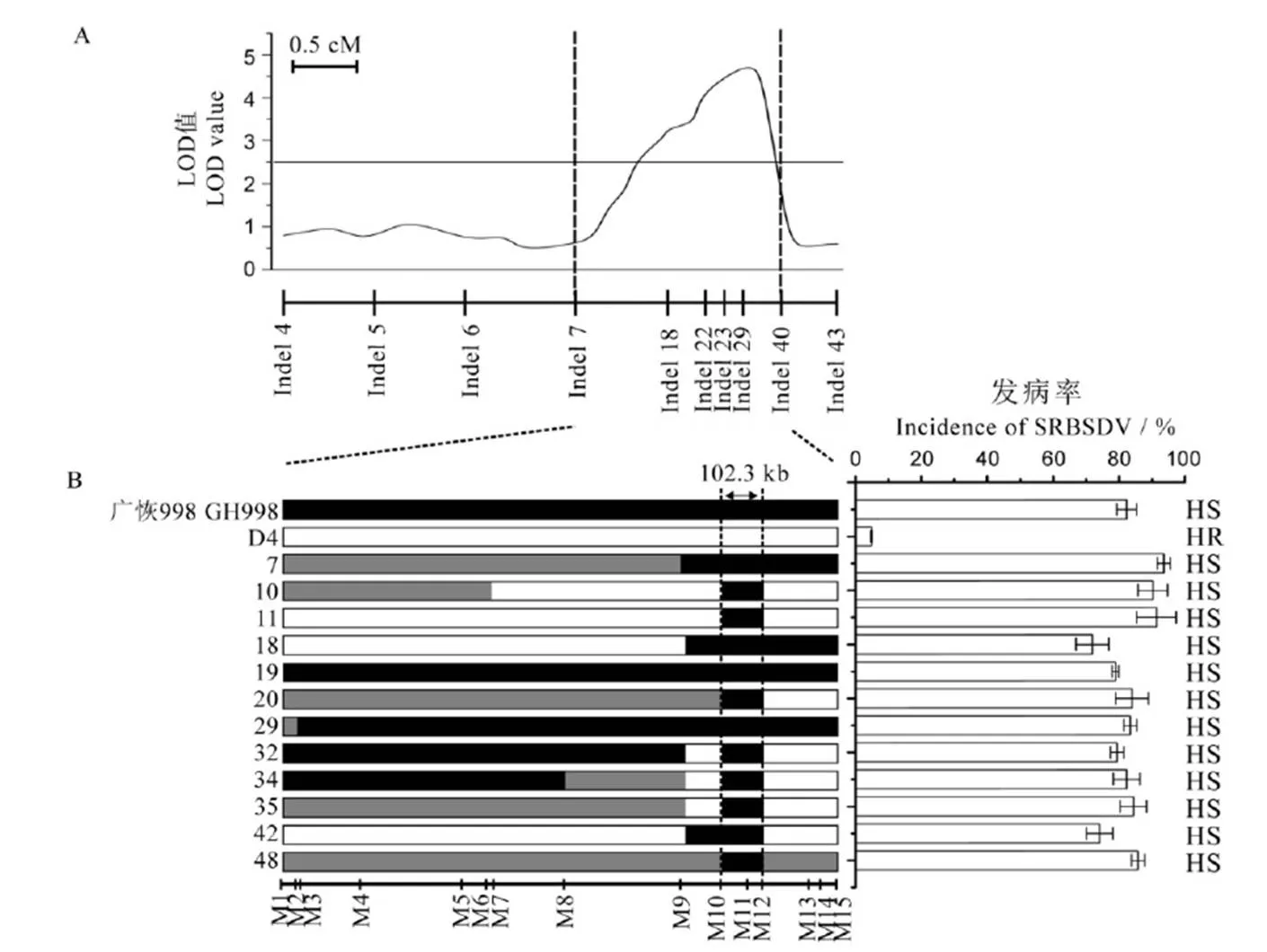
A—连锁分析;B—利用代换作图精细定位qSRBSDV9。代换图中黑色条状区域代表来源于广恢998的导入片段; 空白条状区域代表来源于D4的导入片段;灰色条状区域代表杂合双亲基因的片段。
Fig. 5. Identification and validation ofin rice chromosome 9.
本研究揭示了南方水稻黑条矮缩病的抗性特征及遗传规律,精细定位了南方水稻黑条矮缩病主效抗性QTL,并对定位区间内的候选基因进行了分析和预测。
[1] Zhou G H, Wen J J, Cai D J, Li P, Xu D L, Zhang S G.: A new proposedspecies in the family., 2008, 53(23): 3677-3685.
[2] 周国辉, 许东林, 李华平. 广东发生水稻黑条矮缩病病原分子鉴定//中国植物病理学会2004年学术年会论文集. 北京: 中国农业科学技术出版社, 2004: 201-212.
Zhou G H, Xu D L, Li H P. Identification ofin Guangdong. Chinese Academy of Plant Pathology 2004 Annual Conference, Beijing: China Agricultural Science and Technology Press, 2004: 201-212.
[3] Mar T T, Liu W W, Wang X F. Proteomic analysis of interaction between P7-1 ofand the insect vector reveals diverse insect proteins involved in successful transmission., 2014, 102: 83-97.
[4] Cuong H V, Hai N V, Man V T, Matsumoto M. Rice dwarf disease in north Vietnam in 2009 is caused by(SRBSDV)., 2009, 32: 85-92.
[5] 周国辉, 张曙光, 邹寿发, 许兆伟, 周志强. 水稻新病害南方水稻黑条矮缩病发生特点及危害趋势分析. 植物保护, 2010, 36(1): 144-146.
Zhou G H, Zhang S G, Zou S F, Xu Z W, Zhou Z J. Occurrence and damage analysis of a new rice dwarf disease caused by., 2010, 36(1): 144-146. (in Chinese with English abstract)
[6] Hoang A T, Zhang H M, Yang J, Chen J P, Hébrard E, Zhou G H, Vinh V N, Cheng J A. Identification, characterization, and distribution ofin Vietnam., 2011, 95(9): 1063-1069.
[7] 翟保平, 周国辉, 陶小荣, 陈晓, 沈慧梅. 稻飞虱暴发与南方水稻黑条矮缩病流行的宏观规律和微观机制. 应用昆虫学报, 2011, 48(3): 480-487. Zhai B P, Zhou G H, Tao X R, Chen X, Shen H M. Macroscopic patterns and microscopic mechanisms of the outbreak of rice planthoppers and epidemic SRBSDV., 2011, 48(3): 480-487. (in Chinese with English abstract)
[8] 陈声祥, 张巧艳. 我国水稻黑条矮缩病和玉米粗缩病研究进展. 植物保护学报, 2005(1): 97-103. Chen S X, Zhang Q Y. Advance in researches on rice black-streaked dwarf disease and maize rough dwarf disease in China., 2005(1): 97-103. (in Chinese with English abstract)
[9] Zhang H M, Yang J, Chen J P, Adams M J. A black-streaked-dwarf disease on rice in China is caused by a novel., 2008, 153: 1893-1898.
[10] Xue J, Li J, Ta H A, Zhang H M, Yang J, Lv M F, Meng Y, Li P P, Chen J P. Complete genomic sequence of, a novel, from Vietnam., 2013, 1(3): e00212-13.
[11] 阮义理, 陈声祥, 林瑞芬, 蒋文烈, 金登迪. 水稻黑条矮缩病的研究. 浙江农业科学, 1984(4): 185-187. Ruan Y L, Chen S X, Lin R F, Jiang W L, Jin D D. Studies on., 1984(4): 185-187. (in Chinese)
[12] 王宝祥, 江玲, 陈亮明, 卢百关, 王琦, 黎光泉, 樊继伟, 程遐年, 翟虎渠, 徐大勇, 万建民. 水稻黑条矮缩病抗性资源的筛选和抗性QTL的定位. 作物学报, 2010, 36(8): 1258-1264. Wang B X, Jiang L, Chen L M, Lu B G, Wang Q, Li G Q, Fan J W, Cheng X N, Zhai H Q, Xu D Y, Wan J M. Screening of rice resources againstand mapping of resistant QTL., 2010, 36(8): 1258-1264. (in Chinese with English abstract)
[13] 郭荣, 周国辉, 张曙光. 水稻南方黑条矮缩病发生规律及防控对策初探. 中国植保导刊, 2010, 30(8): 17-20. Guo R, Zhou G H, Zhang S G. Mechanisms and integrated control of the outbreak of southern rice black- streaked dwarf disease., 2010, 30(8): 17-20. (in Chinese)
[14] 刘琳琳. 24个水稻品种对南方水稻黑条矮缩病的抗性研究. 福州: 福建农林大学, 2012. Liu L L. The resistance research of 24 rice varieties to southern black-streaked dwarf disease of rice. Fuzhou: Fujian Agriculture and Forestry University, 2012. (in Chinese with English abstract)
[15] 高瑞珍, 程兆榜, 杨荣明, 朱凤, 季英华, 任春梅, 吴丽莉, 周益军, 范永坚. 江苏省水稻矮缩病的病原鉴定. 华北农学报, 2012(5): 174- 178. Gao R Z, Cheng Z B, Yang R M, Zhu F, Ji Y H, Ren C M, Wu L L, Zhou Y J, Fan Y J. Identification of rice dwarf disease in Jiangsu., 2012(5): 174-178. (in Chinese with English abstract)
[16] 秦碧霞, 蔡健和, 李战彪, 黄所生, 崔丽贤, 黄凤宽, 吴碧球, 高汉亮, 麦接超, 谢慧婷. 广西水稻品种抗水稻南方黑条矮缩病鉴定. 南方农业学报, 2014, 45(1): 38-42.
Qin B X, Cai J H, Li Z B, Huang S S, Cui L X, Huang F K, Wu B Q, Gao H L, Mai J C, Xie H T. Resistance identification of rice cultivars to southern rice black-streaked dwarf disease in Guangxi., 2014, 45(1): 38-42. (in Chinese with English abstract)
[17] Zhang P, Mar T T, Liu W W, Li L, Wang X F. Simultaneous detection and differentiation of(RBSDV) and S(SRBSDV) by duplex real time RT-PCR., 2013, 10: 24.
[18] Zhou T, Du L L, Lan Y, Sun F, Fan Y J, Zhou Y J. Development of SYBR green I-based one-step real time RT-PCR assay for quantifyingin rice., 2014, 162: 26-32.
[19] Li J, Xue J, Zhang H M, Yang J, Lv M F, Xie L, Meng Y, Li P P, Chen J P. Interactions between the P6 and P5-1 proteins of southern rice black-streaked dwarfin yeast and plant cells., 2013, 158: 1649-1659.
[20] [Li Y Q, Xia Z H, Peng J, Zhou T, Fan Z F. Evidence of recombination and genetic diversity in., 2013, 158: 2147-2151.
[21] Li J, Xue J, Zhang H M, Yang J, Xie L, Chen J P. Characterization of homologous and heterologous interactions between viroplasm proteins P6 and P9-1 of the., 2015, 160: 453-457.
[22] Cheng Z B, Li S, Gao R Z, Sun F, Liu W C, Zhou G H, Wu J X, Zhou X P, Zhou Y J. Distribution and genetic diversity ofin China., 2013, 10(1): 307.
[23] 汪涵, 许东林, 周国辉. 南方水稻黑条矮缩病及其防控技术研究进展. 中国植保导刊, 2014, 34(3): 17-20. Wang H, Xu D L, Zhou G H. Research progress on southern rice black-streaked dwarf disease and its controlling techniques., 2014, 34(3): 17-20. (in Chinese with English abstract)
[24] 黄所生, 吴碧球, 秦碧霞, 李战彪, 李成, 孙祖雄, 谢慧婷, 黄凤宽, 蔡健和. 白背飞虱对南方水稻黑条矮缩病传毒效率的影响. 西南农业学报, 2016, 29(12): 2840-2844. Huang S S, Wu B Q, Qin B X, Li Z B, Li C, Sun Z X, Xie H T, Huang F K, Cai J H. Effects of white-backed planthopper,, Horvath on transmission rates of., 2016, 29(12): 2840-2844. (in Chinese with English abstract)
[25] 陈卓, 李向阳, 俞露, 宋宝安. 南方水稻黑条矮缩病防控药剂的创制与应用. 植物保护学报, 2017, 44(6): 905-918. Chen Z, Li X Y, Yu L, Song B A. The development and application of pesticides against the disease caused by., 2017, 44(6): 905-918. (in Chinese with English abstract)
[26] 于文娟, 王建, 钟雪莲, 李红松, 姬红丽, 周雪平, 彭云良. 南方水稻黑条矮缩病综合防治技术研究. 西南农业学报, 2017, 30(12): 2705-2710. Yu W J, Wang J, Zhong X L, Li H S, Ji H L, Zhou X P, Peng Y L. Studies on integrated control of southern rice black-streaked dwarf disease on hybrid rice.2017, 30(12): 2705-2710. (in Chinese with English abstract)
[27] 潘凤英, 廖咏梅, 海博, 周瑞阳. 19个水稻雄性不育系对南方水稻黑条矮缩病的抗性评价. 南方农业学报, 2011, 42(4): 399-402. Pan F Y, Liao Y M, Hai B, Zhou R Y. Evaluation of nineteen rice male sterile lines for resistance to southern rice black-streaked dwarf disease., 2011, 42(4): 399-402. (in Chinese with English abstract)
[28] 余守武, 范天云, 杜龙岗, 黄益峰, 陈珊宇, 葛帅, 麻人方, 洪晓富, 阮关海. 抗南方水稻黑条矮缩病水稻光温敏核不育系的筛选和鉴定. 植物遗传资源学报, 2015, 16(1): 163-167. Yu S W, Fan T Y, Du L G, Huang Y F, Chen S Y, Ge S, Ma R F, Hong X F, Ruan G H. Screening and identification of Photo-thermo-sensitive genic male sterile lines against., 2015, 16(1): 163-167. (in Chinese with English abstract)
[29] Wang Q, Liu Y Q, He J, Zheng X M, Hu J L, Liu Y L, Dai H M, Zhang Y X, Wang B X, Wu W X, Gao H, Zhang Y H, Tao X R, Deng H F, Yuan D Y, Jiang L, Zhang X, Guo X P, Cheng X N, Wu C Y, Wang H Y, Yuan L P, Wan J M. STV11 encodes a sulphotransferase and confers durable resistance to., 2014, 5: 4768.
[30] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA., 1980, 8(19): 4321-4325.
[31] Yang X H, Xia X Z, Zhang Z Q, Nong B X, Zeng Y, Xiong F Q, Wu Y Y, Gao J, Deng G F, Li D T. QTL mapping by whole genome Re-sequencing and analysis of candidate genes for nitrogen use efficiency in rice., 2017, 8: 1634.
[32] Takagi H, Abe A, Yoshida K, Kosugi S, Natsume S, Mitsuoka C, Uemura A, Utsushi H, Tamiru M, Takuno S, Innan H, Cano L M, Kamoun S, Terauchi R. QTL-seq: rapid mapping of quantitative trait loci in rice by whole genome resequencing of DNA from two bulked populations.2013, 74: 174-183
[33] van Ooijen J W. Joinmap 4: Software for the calculation of genetic linkage maps in experimental populations. Wageningen, Netherlands: Kyazma B V, 2006.
[34] van Ooijen J W. MapQTL6: Software for the mapping of quantitative trait loci in experimental populations of diplord species. Wageningen, Netherlands: Kyazma B V, 2009.
[35] Zheng T Q, Yang J, Zhong W G, Zhai H Q, Zhu L H, Fan F J, Ali A J, Yang J H, Wang J, Zhu J Y, Uzokwe V N E, Xu J L, Li Z K. Novel loci for field resistance to black-streaked dwarf and stripe viruses identified in a set of reciprocal introgression lines of rice (L.)., 2012, 29: 925-938.
[36] Zhou T, Du L L, Wang L J, Gao C Y, Lan Y, Sun F, Fan Y J, Wang G L, Zhou Y J. Genetic analysis and molecular mapping of QTLs for resistance to rice black-streaked dwarf disease in rice., 2015, 5: 10509.
[37] Moose S P, Mumm R H. Molecular plant breeding as the foundation for 21st century crop improvement., 2008, 147: 969-977.
[38] 潘存红, 李爱宏, 陈宗祥, 吴林波, 戴正元, 张洪熙, 黄年生, 陈夕军, 张亚芳, 左示敏, 潘学彪. 水稻黑条矮缩病抗性QTL分析. 作物学报, 2009, 35(12): 2213-2217. Pan C H, Li A H, Chen Z X, Wu L B, Dai Z Y, Zhang H X, Huang N S, Chen X J, Zhang Y F, Zuo S M, Pan X B. Detection of QTL for resistance to rice black-streaked dwarf viral disease., 2009, 35(12): 2213-2217. (in Chinese with English abstract)
[39] Chen J, Huang D R, Wang L, Liu G J, Zhuang J Y. Identification of quantitative trait loci for resistance to whitebacked planthopper,, from an interspecific cross×., 2010, 60: 153-159.
[40] Russell S L, Kimmins W C. Growth regulators and the effect of barley yellow dwarf virus on barley., 1971, 35: 1037-1043.
[41] Sridhar R, Mohanty S K, Mohanty S K. Physiology of rice tungro virus disease: Gibberellins in the disease syndrome., 1987, 4: 85-92.
[42] Zhu S F, Gao F, Cao X S, Chen M, Ye G Y, Wei C H, Yi L. The rice dwarf virus P2 protein interacts with-Kaurene oxidases in vivo, leading to reduced biosynthesis of gibberellins and rice dwarf symptoms., 2005, 139: 1935-1945.
[43] 吴建国, 王萍, 谢荔岩, 林奇英, 吴祖建, 谢联辉. 水稻矮缩病毒对3种内源激素含量及代谢相关基因转录水平的影响. 植物病理学报, 2010, 40(2): 151-158. Wu J G, Wang P, Xie L Y, Lin J Y, Wu Z J, Xie L H. Affection of rice dwarf virus on three phytohormones and transcriptional level of related genes in infected rice., 2010, 40(2): 151-158. (in Chinese with English abstract)
[44] 杨阳. 南方水稻黑条矮缩病与水稻激素的关系研究. 长沙: 湖南农业大学, 2015. Yang Y. The relationship betweenand rice hormone. Changsha: Hunan Agricultural University, 2015. (in Chinese with English abstract)
[45] Tao T, Zhou C J, Wang Q, Chen X R, Sun Q, Zhao T Y, Ye J C, Wang Y, Zhang Z Y, Zhang Y L, Guo Z J, Wang X B, Li D W, Yu J L, Han C G.P7-2 forms a SCF complex through binding toSKP1-like proteins, and interacts withinvolved in the gibberellin pathway., 2017, 12(5): e0177518.
[46] 杨行海, 夏秀忠, 农保选, 张宗琼, 曾宇, 李丹婷. 水稻苗期感染SRBSDV后赤霉素相关基因表达量及赤霉素含量的变化. 植物保护学报, 2017, 44(6): 1033-1039. Yang H H, Xia X Z, Nong B X, Zhang Z Q, Zeng Y, Li D T. Analysis of the expression levels of the genes involved in gibberellin biosynthesis and gibberellin contents in rice during seedling stage after being infected by., 2017, 44(6): 1033-1039. (in Chinese with English abstract)
Genetic Analysis and Fine Mapping of a Major QTL for the Resistance to Southern Rice Black-Streaked Dwarf Disease
NONG Baoxuan1, 2, 3, QIN Bixia4, XIA Xiuzhong2, 3, YANG Xinghai2, 3, ZHANG Zongqiong2, 3, ZENG Yu2, 3, DENG Guofu2, 3, CAI Jianhe4, LI Zhanbiao4, LIU Piqing1, *, LI Danting2, 3, *
(Agricultural College,,,;Rice Research Institute, Guangxi Academy of Agricultural Sciences,,;Guangxi Key Laboratory of Rice Genetics and Breeding,,;Plant Protection Research Institute,,,;Corresponding author,:;)
【Objective】(SRBSDV), which is transmitted by white-backed planthopper (Horváth, WBPH), has caused severe yield loss in epidemic years in rice production. We analyzed the resistance mechanism of SRBSDV and identified the related gene locus by fine gene mapping to lay a scientific base for effective prevention and control of SRBSDV. 【Method】The resistance of rice material D4 against white-backed planthoppers were analyzed, and the genetic basis for the resistance to SRBSDV was analyzed by using F2population of Guanghui 998×D4. The major QTL for resistance to SRBSDV was identified using QTL-seq, and further verified by genetic linkage analysis. 【Result】D4 was resistant to SRBSDV but not to WBPH. Genetic analysis showed that the resistance of D4 was controlled by major gene and minor genes. QTL-seq and linkage analysis revealed that the major QTL for resistance to SRBSDV in rice was located within the 1.40 M region on chromosome 9, which was termed as. Thenwas fine mapped on chromosome 9 with a 102.3 kb physical distance by substitution mapping. This region contained 21 predicted genes, nine of which were related to gibberellin signaling. 【Conclusion】The results reveals the characteristics and inheritance of resistance to SRBSDV in D4. The fine mapping oflays a base for map-based cloning and utilization
; white-backed planthopper; genetic analysis; QTL; fine mapping
10.16819/j.1001-7216.2019.8057
S435.111.4+9; S511.034
A
1001-7216(2019)02-0135-09
2018-05-16;
2018-12-20。
国家重点研发计划资助项目(2016YFD0100100);广西科技计划资助项目(桂科AB16380117);水稻生物学国家重点实验室开放课题(160105; 170102);广西农业科学院基本科研业务专项(2015YT15, 桂农科2018YM16)。
