血清CA125、CEA、SCC诊断宫颈癌的价值研究
2019-03-21叶倩翁涨弟陈岩松李筱莉余小龙崔兆磊陈燕
叶倩 翁涨弟 陈岩松 李筱莉 余小龙 崔兆磊 陈燕,2
宫颈癌(cervical cancer,CC)是我国女性中仅次于乳腺癌的第二大常见的恶性肿瘤,我国每年新发病例数约为14万,发病率一直在上升,每年大约30万妇女因患宫颈癌而死亡,且患者具有年轻化的趋势[1]。早期宫颈癌患者缺乏特异的症状和体征,就诊时多数已属中晚期,早期诊断是提高宫颈癌疗效的关键[2-3]。目前宫颈癌临床上除了使用宫颈/阴道细胞学涂片检查、HPV检测、宫颈组织学检查及阴道镜检查等进行诊断以外,血清肿瘤标志物检测也尤为重要,在恶性肿瘤的发生和增殖中,由肿瘤细胞本身所产生的或者由机体对肿瘤细胞反应异常产生和(或)升高的物质,如癌胚抗原(CEA)、糖类抗原(CA125)、鳞状细胞癌抗原(SCC)等肿瘤标志物,对其进行检测可以提示肿瘤的性质,帮助肿瘤的早期诊断及预后判断等[4-5]。本文通过观察宫颈癌患者血清CA125、CEA、SCC的水平,探讨其与宫颈癌临床病理特征的关系以及在宫颈癌患者诊疗方面的应用价值。
1 资料与方法
1.1 一般资料
(1)宫颈癌组:收集120例福建省肿瘤医院2016年4月—2018年4月住院初诊宫颈癌患者治疗前后血清样本,患者年龄为32~75岁,平均年龄为(45.6±11.2)岁,纳入标准为经病理学检查证实为宫颈癌者,未进行药物、手术及放化疗者。依据国际抗癌联盟2015年修订的TMN分期标准,I期7例,II期69例,III期35例,IV期9例;按病理分期I期12例,II期66例,III期32例,IV期10例,其中鳞癌106例,腺癌14例。(2)宫颈癌前病变组(CIN):选取同期40例CIN患者,年龄为27~78岁,平均年龄(42.3±12.9)岁。(3)健康对照组:选取同期在福建省肿瘤医院体检中心肝肾功能正常,排除无肿瘤性病变或其他疾病的健康对照40例,年龄25~70岁,平均年龄(41.2±14.7)岁。
1.2 方法
入组样本分别清晨空腹抽取静脉血,4 h内离心分离血清并进行检测。使用罗氏诊断公司Rohe Cobas E601电化学发光仪和配套试剂检测血清CEA和CA125,使用雅培诊断公司i2000全自动化学发光免疫分析仪和配套试剂检测SCC,使用BIO-RAD公司Liguicheck Tumor Marker control和雅培配套质控进行精密度监控。严格按照仪器操作规范和试剂盒说明书进行操作。CA125、CEA、SCC的正常参考临界值分别为35 U/mL、4.7 ng/mL、1.5 ng/mL,超过临界值即为阳性。
1.3 统计学方法
采用SPSS 13.0统计学软件对所有数据进行处理。计量资料用(±s)表示,两组间比较采用t检验,若方差不齐,两组间采用非参数检验,多组间比较采用方差分析。创建受试者工作特征(ROC)曲线,计算曲线下面积(AUC)及截断值下的诊断效能,P<0.05,差异有统计学意义。
2 结果
2.1 CA125、CEA、SCC在各组间水平的比较
治疗前宫颈癌组血清CA125、CEA、SCC与CIN组比较,差异有统计学意义(t=2.523、2.862、2.641,P均<0.05);治疗前宫颈癌组血清CA125、CEA、SCC与健康对照组比较,差异有统计学意义(t=2.655、2.742、2.341,P均<0.05);CIN组血清CA125、CEA、SCC和健康对照组比较,差异无统计学意义(t=0.562、0.782、0.643,P均>0.05),见表1。
2.2 宫颈癌治疗前后CA125、CEA、SCC血清学水平比较
在120例宫颈癌患者中,有10例患者未进行治疗后检测,在110例患者中CA125、CEA、SCC血清学水平治疗前均高于治疗后,差异有统计学意义(P<0.05),见表2。
2.3 宫颈癌患者临床病理特征三项血清学水平比较
CA125、CEA在宫颈腺癌水平高于宫颈鳞癌,SCC在宫颈鳞癌水平高于宫颈腺癌,差异有统计学意义(P<0.05);CA125、CEA和SCC在宫颈癌临床分期III~IV期水平均高于I~II期,差异有统计学意义(P<0.05);CA125在宫颈癌病理分期I~II期水平高于III~IV期,差异有统计学意义(P<0.05);CA125、CEA和SCC在宫颈癌低中分化组水平高于高分化组,差异有统计学意义(P<0.05);CA125和SCC在宫颈癌组肿块直径≥4.0 cm组水平高于肿块直径<4.0 cm组,差异有统计学意义(P<0.05);CA125、CEA和SCC在宫颈癌有盆腔淋巴结转移组水平均高于未发生盆腔淋巴结转移组,差异有统计学意义(P<0.05);CA125、CEA和SCC在宫颈癌有间质浸润组水平高于未发生间质浸润组,差异有统计学意义(P<0.05),见表3。
2.4 血清三项指标对宫颈癌的检测效能
血清CA125、CEA与SCC水平绘制ROC曲线,结果显示CA125单独检测的ROC曲线下面积为0.716(95%CI为0.618~0.815),最佳截断值为48.6 u/mL,对应的敏感度(SEN)为63.1%,特异度(SPE)为76.2%;CEA单独检测的ROC曲线下面积为0.647(95%CI为0.540~0.754);最佳截断值为8.21 ng/mL时,对应的SEN为60.2%,SPE为65.3%;SCC单独检测的AUC为0.811(95%CI为0.727~0.895);最佳截断值为3.62 ng/mL时,对应的SEN为75.9%,SPE为80.2%,三者联合AUC为0.935(95%CI为0.885~0.985),SEN为91.3%,SPE为88.2%,见图1和表4。
3 讨论
宫颈癌早期症状不明显,多数患者发现时已属中晚期,晚期宫颈癌5年生存率仅为40%,早期发现宫颈癌,提高宫颈癌的诊断敏感性,有助于患者预后,提高患者的生活质量[6]。目前,对宫颈癌相关的肿瘤标志物有广泛的研究[7],CAl25、CEA和CEA肿瘤标志物已证实与宫颈癌的发生、发展和预后密切相关,尽管其作用机制和作用环节不完全相同,但其共同参与宫颈癌的发病,具有一定的联合作用。有研究报道[8],血清CA125在宫颈癌早期可能表现阳性,比临床上检查到肿瘤存在要早4个月左右,对于宫颈癌早期筛查、诊断和鉴别有独立预测价值。CEA是一种可溶性糖蛋白,其单一水平升高难以诊断恶性肿瘤,但其水平与癌细胞的数量有关,由于宫颈癌细胞数量众多,CEA水平可伴随疾病严重程度加深而升高,但是因为CEA的半衰期长,在一段较长时间内浓度变化不明显,所以在监测疗效应用方面用途有限。
表1 血清CA125、CEA、SCC在治疗前宫颈癌组、CIN组和健康对照组间的水平比较(±s)
注:与健康对照组比较,*P<0.05;与宫颈癌前病变组比较,#P<0.05
组别 例数 CA125 (u/ml) CEA(ng/ml) SCC(ng/ml)宫颈癌组 120 43.31±16.84*# 8.21±3.02*# 3.85±1.28*#宫颈癌前病变组 40 15.82±4.11 3.24±1.42 1.08±0.35*健康对照组 40 13.21±3.75 2.58±1.13 0.69±0.30 F值 - 5.142 6.452 4.857 P值 - <0.05 <0.05 <0.05
表2 宫颈癌治疗前后CA125、CEA 、SCC血清学水平比较(±s)

表2 宫颈癌治疗前后CA125、CEA 、SCC血清学水平比较(±s)
注:宫颈癌组治疗前后比较,#P<0.05
治疗前后 例数 CA125(u/mL) CEA(ng/mL) SCC(ng/mL)治疗前 110 46.51±15.93# 8.74±3.21# 3.56±1.62#治疗后 110 25.29±8.75 3.52±1.36 1.16±0.22 t值 - 4.254 5.648 5.573 P值 - <0.05 <0.05 <0.05
表3 血清CA125、CEA、SCC与宫颈癌临床病理特征的分析(±s)
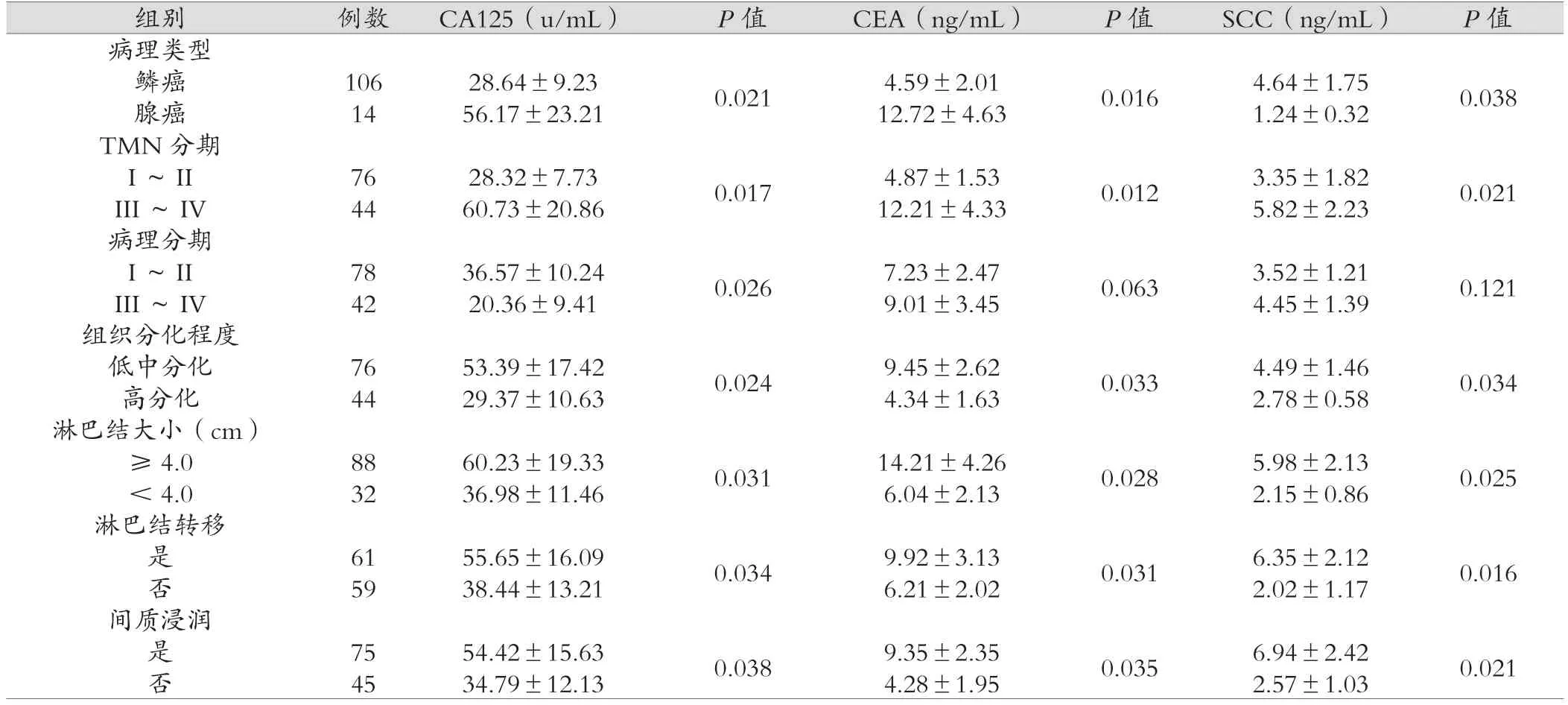
表3 血清CA125、CEA、SCC与宫颈癌临床病理特征的分析(±s)
组别 例数 CA125(u/mL) P值 CEA(ng/mL) P值 SCC(ng/mL) P值病理类型鳞癌 106 28.64±9.23 0.021 4.59±2.01 0.016 4.64±1.75 0.038腺癌 14 56.17±23.21 12.72±4.63 1.24±0.32 TMN分期I~ II 76 28.32±7.73 0.017 4.87±1.53 0.012 3.35±1.82 0.021 III~ IV 44 60.73±20.86 12.21±4.33 5.82±2.23病理分期I~ II 78 36.57±10.24 0.026 7.23±2.47 0.063 3.52±1.21 0.121 III~ IV 42 20.36±9.41 9.01±3.45 4.45±1.39组织分化程度低中分化 76 53.39±17.42 0.024 9.45±2.62 0.033 4.49±1.46 0.034高分化 44 29.37±10.63 4.34±1.63 2.78±0.58淋巴结大小(cm)≥ 4.0 88 60.23±19.33 0.031 14.21±4.26 0.028 5.98±2.13 0.025< 4.0 32 36.98±11.46 6.04±2.13 2.15±0.86淋巴结转移是61 55.65±16.09 0.034 9.92±3.13 0.031 6.35±2.12 0.016否59 38.44±13.21 6.21±2.02 2.02±1.17间质浸润是75 54.42±15.63 0.038 9.35±2.35 0.035 6.94±2.42 0.021否45 34.79±12.13 4.28±1.95 2.57±1.03
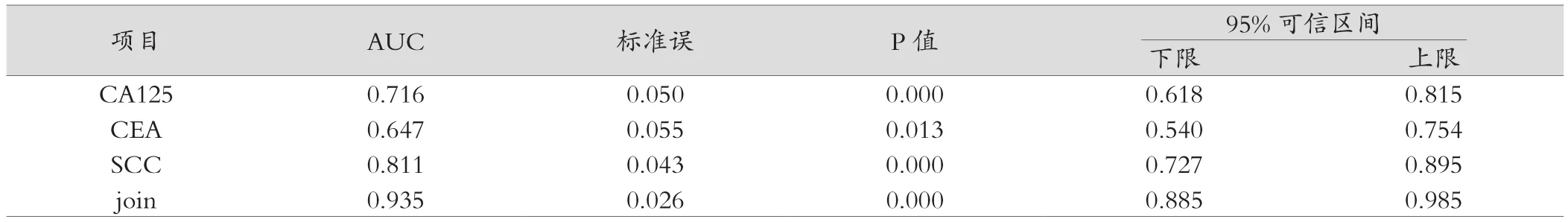
表4 血清CA125、CEA 、SCC的诊断效能
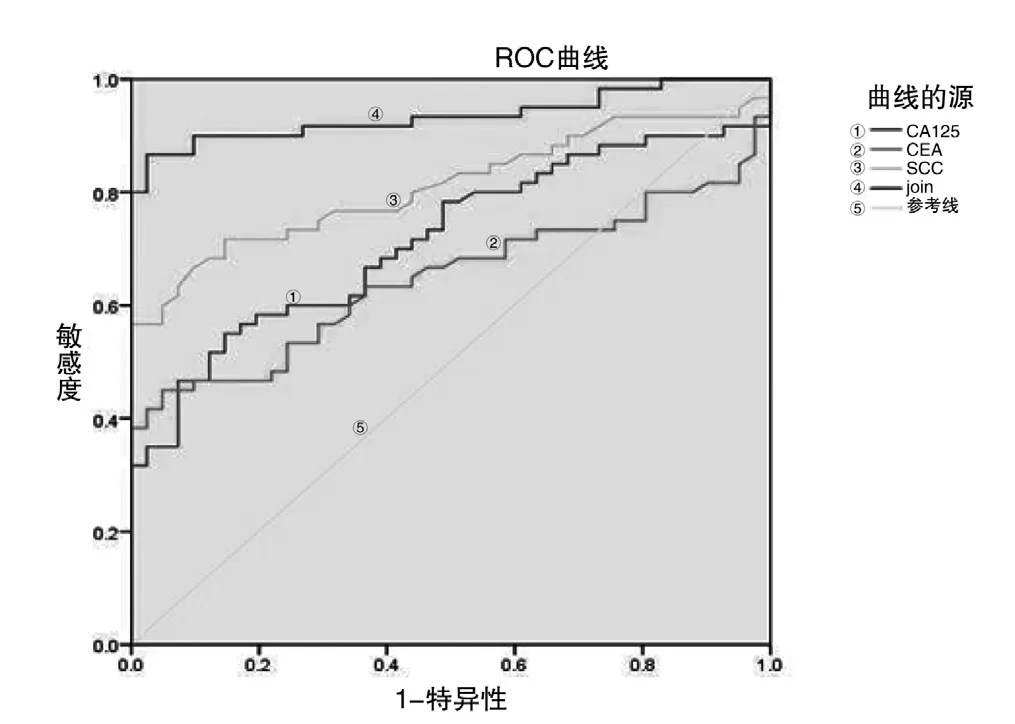
图1 CA125、CEA、SCC单独检测与联合检测的ROC曲线
本文中在宫颈癌组、CIN组和健康对照组中,宫颈癌组血清三者水平显著高于CIN组和健康对照组,有较高的阳性率,与张蕾等[9]研究结果基本一致,可见血清CEA、CA125、SCC可作为宫颈癌临床诊断肿瘤标志物。健康对照组与CIN组三者比较,差异无统计学意义(P>0.05),提示这三种血清学指标在宫颈癌前病变中诊断价值有限,不建议将其用作宫颈癌前病变的早期筛查指标。
宫颈癌组治疗前血清三者水平均高于治疗后,提示治疗过程中及治疗后检测肿瘤标志物并动态观察,可辅助判断宫颈癌的疗效及进展。若治疗后血清三者水平出现持续升高、下降不明显或降而复升,则提示患者对治疗反应性较差、疾病未控制或有复发转移的可能,有助于了解疗效,指导临床治疗和预后判断[10]。
本文宫颈腺癌CA125水平高于宫颈鳞癌,但在宫颈鳞癌中SCC水平高于宫颈腺癌。宫颈癌腺癌占比不高,宫颈癌中约90%为鳞状上皮癌,SCC是从宫颈鳞状细胞分离的抗原TA-4的亚组分,其水平与癌细胞的成熟度有关,在诊断宫颈癌的准确度方面,CAl25要略低于SCC,但两者结合有助于鉴别病理类型[11]。本文宫颈癌的SCC水平升高,且升高程度与肿瘤的分期、大小、浸润程度等相关,宫颈癌患者病情严重程度加深,SCC检测值逐渐升高,连续监测SCC水平有助于临床判断疾病的严重程度,与李群和王静等人研究结果相符合[12-13],其机制可能为肿块越大、淋巴结转移,宫颈癌灶侵犯肌层越深及临床分期越晚时,肿瘤细胞中SCC可通过微血管、淋巴液进入血液循环,致使血清SCC水平升高[14]。
本文宫颈癌临床病理特征分析提示宫颈癌患者临床分期越高、肿瘤分化越差、肿块直径越大、发生间质浸润、淋巴结转移的三者水平较高。宫颈癌扩散的主要途径是直接蔓延和淋巴结转移,而盆腔淋巴结转移是宫颈癌的主要转移途径,提示肿瘤的生长过程中,更多的CA125、CEA、SCC释放入血,与国内部分研究结果相一致[15-16],可以与临床资料相互印证。
本研究结果显示血清CA125、CEA、SCC联合检测曲线下面积(AUC)较单项检测大。任一种肿瘤标志物的单独检测的灵敏度和特异度均低于联合检测。SCC相比其他肿瘤标志物单独检测灵敏度、特异度最高,可将其作为宫颈癌诊断重要指标之一。本文血清CA125、CEA、SCC用于预测宫颈癌的临界值分别为48.6 u/mL、8.21 ng/mL、3.62 ng/mL,高于临界值时提示宫颈癌高风险,各种文献所报道具体数值不同,可能与入组的患者病理分期、病理类型有关,后期可继续收集更多病例,进行大数据分析。
宫颈癌筛查常用宫颈涂片、阴道腔镜、组织活检等,但是因为其多中心性,也存在漏检的可能,血清学检查较为快捷、经济,且可批量检测。在肿瘤发展的早期,血液中的部分肿瘤标志物已有不同程度的升高,血清CA125、CEA和SCC检测具有一定的临床参考价值,有助于疗效评估、病情监测、预后判断,三项指标联合检测提高宫颈癌诊断的特异度与灵敏度,可提高肿瘤检出率,有临床应用价值。
