骨髓间充质干细胞源性外泌体对体外培养的软骨细胞增殖和迁移的调节作用
2019-03-20綦惠刘丹平田大川肖大伟苏永蔚李海乐舒雄
綦惠刘丹平 田大川 肖大伟 苏永蔚 李海乐舒雄
1北京市创伤骨科研究所(北京100035)
2锦州医科大学附属第一医院运动与关节一科(辽宁120000)
3漯河市中心医院创伤骨科(河南462000)
由于软骨细胞是关节软骨内唯一的细胞成分,也是软骨组织工程的种子细胞之一,因此软骨细胞正常生物学行为的维持是关节软骨功能保持的必要条件。近些年来的研究证实,间充质干细胞(mesenchymal stem cells,MSCs)对组织损伤等病理过程的修复作用,更大程度上依赖于其对组织内部微环境和细胞功能的调节,这一作用与其来源的外泌体(exosomes)息息相关[1-3]。外泌体是由细胞分泌的囊泡结构,其结构特点是由脂质双分子层包裹着多种mRNA、miRNA以及蛋白质等小分子。外泌体是细胞与细胞之间进行交流的重要媒介,通过各种信号转导通路,能够发挥类似于MSCs甚至比MSCs本身更为优异的对病变的修复作用[1-3]。研究表明,MSCs能够调控关节腔的微环境,促进关节软骨缺损修复[4-7]。我们既往的研究表明,MSCs与软骨细胞共培养能够促进软骨细胞表型的维持[8],因此我们推断软骨细胞生物学行为的维持很大程度上可能依赖于MSC源性外泌体。
本研究采用超高速离心的方法获取新西兰兔骨髓干细胞源性外泌体,将外泌体与软骨细胞体外共培养,检测其对软骨细胞增殖和迁移的调节,以证实我们的假说。
1 材料和方法
1.1 材料
主要材料:Ⅱ型胶原酶、胰酶、低糖 DMEM和FBS购自美国Gibco公司;抗兔 CD29、CD44、CD31、CD105、CD34、CD45、CD49d、CD106、HLA-DR 抗体购自美国BD公司;Ⅱ型胶原酶、IL-1β、细胞膜Dil荧光探针、细胞核DAPI荧光探针、MTT购自美国Sigma-Al⁃drich公司;BCA蛋白分析试剂盒购自碧云天生物公司;CD63和CD81一抗购自英国Abcam公司,二抗购自北京中杉金桥生物技术有限公司。
主要仪器:细胞培养箱(Thermo,美国),超净操作台(海尔,中国),超高速离心机(日立,日本),荧光显微镜(Leica,德国),倒置显微镜(Olympus,日本),酶标仪(Biorad,美国)。
动物:清洁级成年新西兰大白兔,雌雄不限,由北京市创伤骨科研究所动物室提供。
1.2 方法
1.2.1 MSCs的培养和鉴定
采用密度梯度离心法获取新西兰兔的骨髓MSCs(bone marrow mesenchymal stem cells,BMSCs)。无菌条件下截取双侧中段胫腓骨,暴露骨髓腔,完全培养基反复快速冲洗骨髓腔,Ficoll液分离收集细胞,离心后再次收集细胞,反复冲洗后完全培养基重悬,接种至培养皿,置于37℃5%CO2恒温培养箱培养。倒置相差显微镜下观察细胞生长至80%~90%融合,对细胞进行1︰2或1︰3传代。采用流式细胞仪对BMSCs表面抗原进行鉴定。
1.2.2 BMSCs源性外泌体的获取和鉴定
采用传统的超高速离心的方法提取BMSCs分泌的外泌体(BMSC-Exos)。将BMSCs用无血清培养基培养48 h后,收集培养液,以2000 g离心10 min,去除细胞碎片。吸取上清液,以100,000 g离心70 min两次,得到的沉淀即为外泌体。适量PBS重悬后,透射电镜下对外泌体的形态进行观察。Western blot技术进行外泌体表面抗原CD61和CD83的鉴定。
1.2.3软骨细胞的获取和培养
无菌切取若干只新西兰兔关节软骨并剪成碎片,置离心管中,以0.25%胰蛋白酶37℃消化30 min,0.2%胶原酶37℃消化90 min,吸取上清,离心收集细胞,接种至培养皿,置于37℃5%CO2恒温培养箱培养。倒置相差显微镜下观察细胞生长至80%~90%融合,对细胞进行1︰2或1︰3传代。取第2代或第3代软骨细胞进行后续实验。
1.2.4 软骨细胞增殖的检测
采用MTT法检测软骨细胞增殖。软骨细胞接种在96孔板。待软骨细胞长至80%~90%融合时,将完全培养基替换成含有40 μg/mL、80 μg/mL、120 μg/mL 外泌体的PBS或不含外泌体的PBS。不同含量的BMSCExos与软骨细胞共培养4 h、8 h、16 h、24 h、48 h。在培养结束前4 h,每孔加入5 μg/mL MTT 20 μL。培养时间结束时,吸去上清,加入150 μL DMSO溶解结晶,水平振摇10 min后,酶标仪570 nm检测吸光度。
模拟骨性关节炎(osteoarthritis,OA)关节腔炎性环境,在软骨细胞培养基中加入10 ng/mL IL-1β,或者同时加入外泌体,MTT法检测软骨细胞增殖的变化。
1.2.5 软骨细胞摄取BMSC-Exos的检测
待软骨细胞长至80%~90%融合时,用PBS冲洗细胞,将完全培养基置换成不含血清的培养基。Dil加入到BMSC-Exos中,100,000 g离心2 h,用不含血清的培养基重悬之后,加入软骨细胞中,共培养2 h、4 h和8 h。之后,将采用4%多聚甲醛对软骨细胞进行固定15 min,DAPI染色5 min,PBS冲洗后,荧光显微镜下观察。
1.2.6 软骨细胞迁移的检测
采用划痕试验对软骨细胞的迁移能力进行检测。软骨细胞接种至六孔板中,待细胞铺满孔底,用200 μL无菌微量移液器枪头沿着六孔板的孔中央进行划痕,PBS漂洗掉细胞残渣,新的不含血清的培养基(含有或不含有BMSC-Exos)加入六孔板中,再培养24 h。每孔设置3个复孔。倒置相差显微镜下进行观察,并测量划痕两侧距离,与0 h对比后,计算划痕愈合率。
1.2.7 统计学方法
采用SPSS 17.0统计软件进行分析。数据以均数±标准差表示。两组均数间比较采用独立样本t检验;多组均数组间比较采用单因素方差分析,两两比较采用SNK检验。检验水准a=0.05。
2 结果
2.1 BMSCs的鉴定
本研究成功地从新西兰兔的骨髓中获取了BM⁃SCs。流式细胞术检测结果显示,多数BMSCs表达CD29、CD44、CD49d和CD105,而低表达CD34、CD45、CD106和HLA-DR(图1)。表达值分别为CD29 98.3%、CD44 97.6%、CD49d 86.7%、CD105 95.4%、CD34 32.6%、CD45 17.4%、CD106 15.8%、HLA-DR 27.6%。
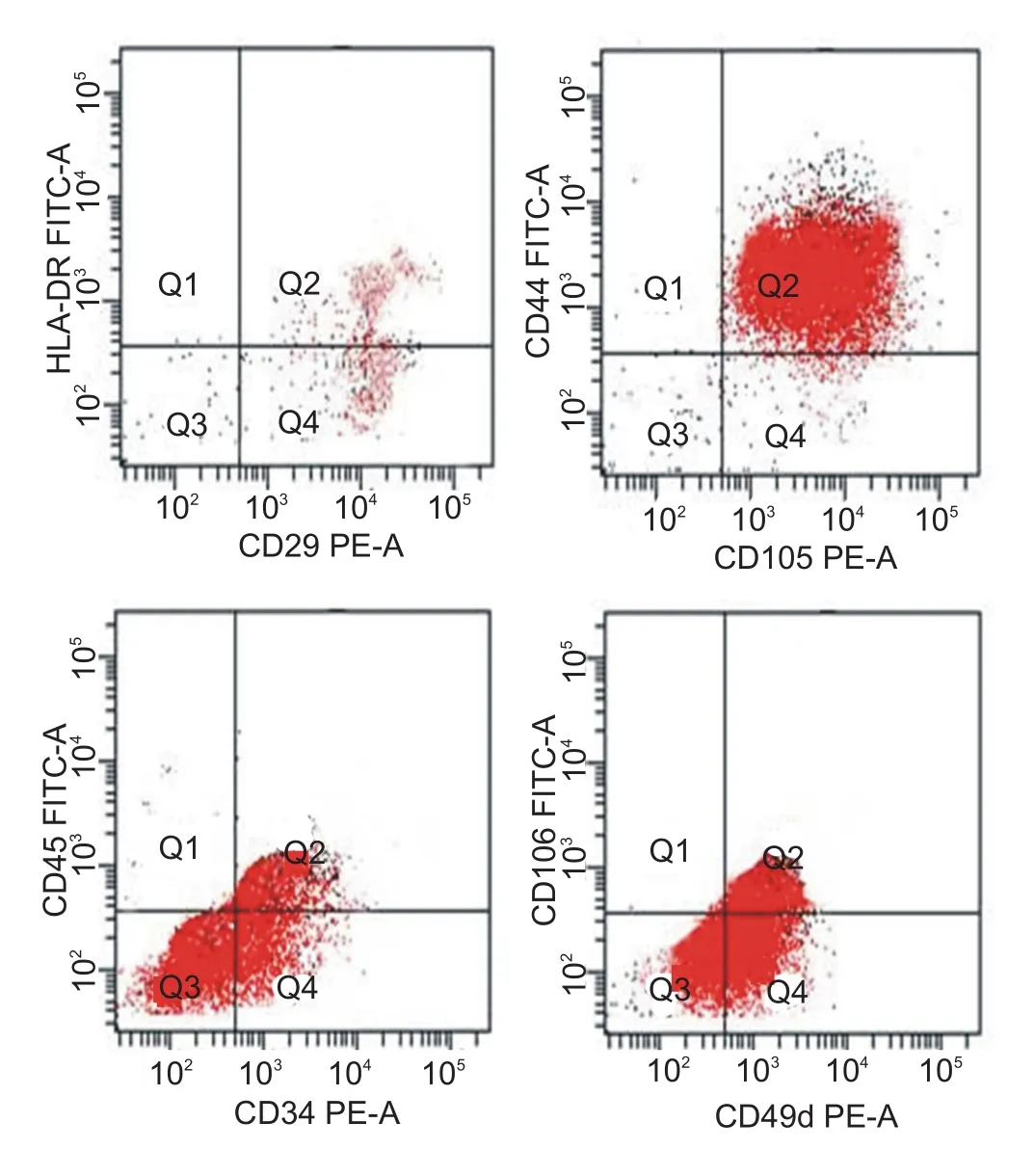
图1 流式细胞术检测BMSCs的表面标记
2.2 BMSC-Exos的鉴定
采用透射电镜对BMSC-Exos的形态学进行观察。电镜下,外泌体呈近似球形,直径40~100 nm。West⁃ern blot检测表明,与既往研究者的结果一致[9,10],本研究提取的外泌体表达CD63和CD81(图2)。

图2 BMSC-Exos的鉴定
2.3 BMSC-Exos能够促进软骨细胞增殖
为观察外泌体对软骨细胞生物学行为的作用,本研究将不同浓度的BMSC-Exos与软骨细胞在体外进行共培养,结果显示,40 μg/mL、80 μg/mL和120 μg/mL含量的BMSC-Exos均可显著促进软骨细胞增殖(P<0.05),80 μg/mL和120 μg/mL外泌体的作用没有显著差异(图3)。后续实验均采用80 μg/mL进行。

图3 MTT法检测BMSC-Exos对软骨细胞增殖的作用
2.4 BMSC-Exos能够被软骨细胞摄取
由于BMSC-Exos能够促进软骨细胞增殖,本研究进一步采用荧光显微镜观察软骨细胞摄取BMSC-Exos的情况。如图4所示,BMSC-Exos被Dil标记为红色,软骨细胞的细胞核被DAPI标记为蓝色。通过荧光显微镜,观察到红色标记的BMSC-Exos能够被软骨细胞摄取,且在共培养8 h的时候,BMSC-Exos主要集中在软骨细胞的细胞核周边。

图4 荧光显微镜下观察软骨细胞对BMSC-Exos的摄取
2.5 BMSC-Exos能够促进软骨细胞迁移
如图5和表1所示,软骨细胞培养24 h后,划痕愈合率约44%,当给予软骨细胞BMSC-Exos共培养24 h后,划痕间距明显减小,划痕愈合率上升至约63%,愈合率显著升高(P<0.05)。

表1 划痕愈合率(%,均数±标准差)

图5 BMSC-Exos对软骨细胞迁移的影响
2.6 BMSC-Exos抑制IL- 1β 诱导的软骨细胞增殖能力下降
IL-1β是OA的重要前炎症细胞因子。因此在软骨细胞培养体系中加入BMSC-Exos和IL-1β,观察BM⁃SC-Exos对软骨细胞的保护作用。如图6所示,IL-1β能够时间依赖性抑制软骨细胞的增殖(P<0.05),而BMSC-Exos能够完全逆转IL-1β的作用。

图6 IL-1β刺激下BMSC-Exos对软骨细胞增殖的检测
3 讨论
外泌体是由细胞分泌的,脂质双分子层包裹的,含有mRNA、miRNA和蛋白质等多种小分子的囊泡。几乎所有细胞均可产生外泌体,如免疫细胞、上皮细胞、干细胞、肿瘤细胞等[11,12]。
随着研究的进展,细胞治疗逐渐受到重视。由于低免疫原性和多向分化潜能,MSCs移植越来越多地被尝试应用于临床。但是,移植到损伤部位的MSCs仅有少部分存活,且MSCs移植有可能引起长期异常分化和肿瘤形成[1-3],这些潜在的安全风险和未知因素极大地限制了MSCs的广泛应用。近些年来,研究者们更倾向于认为MSCs促进损伤修复的机制主要是一种间接的、依赖于旁分泌的方式,而MSCs源性外泌体(MSCs de⁃rived exosomes,MSC-Exos)可能是其中的关键作用组件[1-3]。MSC-Exos参与调控多个病理过程,如可明显降低心肌缺血再灌注过程中的炎症反应,减轻心肌损伤[13];抑制缺氧诱导的小鼠肺动脉高压模型的肺部炎症反应[14];作用于白血病患者血液中的细胞可明显增强抗炎因子IL-10、TGF-β的表达,降低促炎因子IL-1、IL-6、TNF-α的表达[15]。我们既往的研究表明,MSCs与软骨细胞共培养能够促进软骨细胞表型的维持[8],但是具体机制仍是未知的,且目前MSC-Exos在软骨损伤修复中的作用研究较少。
关节软骨缺损如未得到及时处理,会逐渐扩大至周围正常软骨,造成进一步磨损,是引发骨关节炎(os⁃teoarthritis,OA)的重要原因之一。我国OA患者约有1亿人,且呈不断增加趋势,由于极高的患病率和致残率,以及昂贵的治疗费用,OA已成为造成经济损失和影响社会发展的主要疾病之一。目前临床治疗软骨缺损的常用方法如关节腔灌洗术、微骨折术、自体/异体软骨移植等,旨在减轻关节疼痛和缓解症状,长期治疗效果仍较为局限[4-7]。以MSCs为基础的细胞治疗已证实具有较好疗效,但是MSCs向软骨组织定向分化的各种因素是十分复杂的,同时也面临着畸胎瘤[16]形成的风险。已有的研究表明,MSC-Exos能有效促进OA患者关节软骨缺损的修复[17],因此研究者们推测MSCExos有望替代MSCs成为关节软骨缺损/OA的辅助治疗新策略。
我们采用超高速离心法获取骨髓MSCs来源的外泌体(BMSC-Exos),通过透射电镜观察BMSC-Exos呈近似球形,Western blot鉴定BMSC-Exos表面表达CD63和CD81。将不同含量的BMSC-Exos与软骨细胞共培养,发现BMSC-Exos的作用类似于生长因子,能够时间和剂量依赖性促进软骨细胞增殖。共培养4 h,BMSC-Exos即有明显的促增殖作用,但120 μg/mL的作用与80 μg/mL相比无显著差异。因此,后续实验我们均采用80 μg/mL的剂量。荧光染色实验进一步证实,体外共培养环境中,软骨细胞能够摄取BMSCExos,且在共培养4 h,发现带有红色荧光的BMSCExos位于软骨细胞周围,共培养8 h,发现大量红色荧光聚集在带有蓝色荧光的软骨细胞核周边,表明可能在共培养的更早期BMSC-Exos即向软骨细胞迁移。
在正常关节液中含有少量IL-1β,而OA患者的关节液中IL-1β浓度显著升高[18,19],并且OA患者的软骨细胞表面IL-1受体的表达量是正常人软骨细胞的2倍,这就造成了OA患者的软骨细胞对IL-1β的高反应性。研究通过转染技术使抗IL-l受体拮抗蛋白在病变的关节内高表达,结果发现IL-1β的破坏作用明显减弱[19],这些变化说明OA的发生伴随着IL-1β表达量升高,IL-1β的高表达在OA的发展过程中起着极其重要的作用。本研究采用IL-1β作为前炎症因子刺激软骨细胞,与既往研究者的结果类似[20,21],发现软骨细胞增殖受到明显抑制。当给予BMSC-Exos同时作用,软骨细胞降低的增殖能力得到完全逆转。这提示,OA患者的关节腔中给予BMSC-Exos注射治疗可能改善患者受损软骨细胞的增殖功能。张长青[10]团队的研究表明,滑膜干细胞源性外泌体能够增强软骨细胞的增殖和迁移,与该研究结果一致,本研究通过划痕试验发现,BMSCExos体外能够促进软骨细胞迁移。
4 结论
MSCs源性外泌体具有与MSCs本身类似的促进软骨细胞增殖和迁移的作用,如能进一步确证该作用,则将是MSCs源性外泌体能够作为非细胞治疗方法应用于关节软骨缺损/骨关节炎的有力佐证。
