中医病证相符的大鼠疮疡模型的建立及其血浆、尿液代谢组学研究
2019-03-20陈德轩蔡红蝶宿树兰朱永康
陈德轩,蔡红蝶,宿树兰,朱永康*
(1.南京中医药大学附属医院,江苏 南京 210029;2.南京中医药大学药学院,江苏 南京 210023)
中医外科学古代称为“疡科”,体表感染性疾病在其中占有重要位置,中医外科的内外治法都是围绕体表感染类疾病(疮疡)展开论述的;中医现代化进程中,针对很多经典方药及疮疡类疾病的实验研究必然用到体表感染模型,体表感染模型的建立是相关研究的基础。
代谢组学是系统生物学研究不可缺少的重要组成,代谢组学被视为生物体整体功能状态的“生化表型”,能够即时、灵敏、客观表征生物在各种外界因素的刺激下体整体功能状态的应答与调节[1]。目前多成分与多作用靶点药物显示出明显的作用优势,传统中医药的整体观也越来越受到更多重视。因而,建立符合传统中医药自身特点、能够科学表征其整体疗效的药效学评价体系,揭示中医药多组分、多靶点协同整合机制,是研究中医药的重中之重。近年来,代谢组学越来越多地应用于中医“证候”本质的揭示[2]、方剂整体疗效的作用机制[3]以及中药安全性评价等等方面,能够客观地阐明中医药的临床治疗原理。
本文在前人研究基础上[4],根据病证相符的原则,采用胶带表皮剥脱加金葡菌菌液注射方法制备大鼠体表感染模型,该模型具有“阳证疮疡”成脓期的典型表现,可以用于相关实验研究。并进一步运用血浆、尿液代谢组学方法揭示体表感染模型大鼠的内源性小分子代谢产物的变化,从体内代谢角度阐明该模型的科学性和合理性。以期为同类研究提供技术方法支撑和参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级SD大鼠20只,6~7周龄,体质量200~220 g,雌雄各半,由南京中医药大学实验动物中心提供,许可证号码SCXK(苏)2012-0004。饲养及无菌手术在该中心进行,温度、湿度正常。
1.1.2 试剂与仪器
感染细菌菌种:金黄色葡萄球菌ACTT 25923,浓度1×108个/mL,由江苏省中医院细菌室提供。实验药物麻醉剂:水合氯醛,江苏省中医院制剂中心,批号:2014080。光学显微镜( Olympus,日本)江苏省中医院病理实验中心提供。超高效液相色谱与飞行时间质谱仪联用(UHPLC-Q-TOF/MS)分析条件及工作站等:江苏省方剂研究重点实验室提供。
1.2 实验方法
1.2.1 动物分组及模型制备
20只大鼠随机分为两组,每组10只。正常组,表皮剥脱,皮下多点注射生理盐水;模型组,表皮剥脱,滴注菌液,并皮下多点注射菌液。
体表感染模型:采用胶带剥脱法[4]加皮下多点注射菌液法复制大鼠体表感染模型。实验大鼠适应性喂养3 d 后,分别在腹腔内注射10%水合氯酸麻醉(剂量为3 mL/kg),选择背部皮肤作为实验区域,使用电动剃毛器剃去背部毛发约3.0 cm×3.0 cm,以宽约2 cm胶带连续粘扯背部软毛,约30次左右脱去毛发和表皮层,以潮红光亮见渗出轻微血滴为度,去除面积约3 cm2左右。滴注菌液组10只大鼠即刻于表皮剥脱处以取样器滴注5 μL含108金黄色葡萄球菌菌液。放置入饲养笼等待自然苏醒。以后3 d,每天于剥脱表皮正中注射金黄色葡萄球菌108个/mL×0.5 mL,并在感染区域2 cm2周围选取多点行皮下注射菌液。约至第4天背部注射部位出现明显红肿、皮薄光亮、点压有软化,有脓液为造模成功。正常组行相应剥脱、注射,仅注射等量的注射用生理盐水。
1.2.2 样本收集与处理
(1)随机10只大鼠造模前1 d通过眼眶静脉取血,并通过代谢笼收集10只大鼠的24 h尿液样本。造模后的第4天,2组再分别取血和收集大鼠的尿液。取样经离心取血浆后,分组标记后储存于-70℃的环境中,留待后续分析处理。所有血浆样品均用3倍量乙腈沉蛋白。将100 μL的血浆,加入到300 μL的乙腈溶液当中,通过涡漩混匀1 min,13 000 r/min高速离心处理10 min后,取上清液过0.22 μm滤膜,各取2 μL滤液进样UHPLC-Q-TOF/MS。尿液样品在3 000 rpm离心10 min以除去固体杂质,取上清液按体积比1∶2加入磷酸盐缓冲液(0.2 mol·L-1Na2HPO4/0.2 mol·L-1NaH2PO4),静置10 min,再于同样条件下13 000 rpm,离心10 min,所有尿液样品过0.22 μm滤膜,各取上层清夜2 μL进样UPLC-Q-TOF-MS分析。
(2)造模完成后,5只大鼠腹腔内注射麻醉,取背部疮疡形成部位靠近中心部的包括皮肤至肌层各层组织约0.5~1 cm2,4%多聚甲醛分组固定,分别行HE染色和革兰氏染色,制作病理标本。
1.2.3 观察指标
(1)观察一般情况: 每日观察各组大鼠行为活动、粪便性状、疮面形态、颜色等。
(2)病理切片检测:观察病理切片的急性炎症反应、中性粒细胞浸润、单核细胞浸润、细菌残留情况等。
(3)造模前后的血浆和尿液代谢轮廓变化。
1.2.4 UHPLC-Q-TOF/MS分析条件
色谱条件:ACQUITF UHPLC BEH-C18色谱柱(2.1 mm×50 mm,1.7 μm,美国Water公司);流动相:A(0.1%甲酸水溶液),B(乙腈);血浆样品梯度洗脱:0~3 min,B:5%~45%;3~13 min,B:45%~95%;13~14 min,B:95%;14~14.1 min,B:95%~5%。尿液样品梯度洗脱:0~8 min,B:5%~30%;8~11 min,B:30%~70%;11~13 min,B:70%~95%;13~14 min,B:95%;14~14.1 min,B:95%~5%。
质谱检测条件:ESI+模式下,源温度:120℃,脱溶剂气温度:400℃,毛细管电压:4 000 V,锥孔电压:30 V。锥孔气流量:50 L/h,脱溶剂流量:900 L/h;扫描时间:0.3 s;质量扫描范围:100~1 000 m/z。ESI-模式下,源温度:120℃,脱溶剂气温度:350℃,毛细管电压:3 000 V,锥孔电压:40 V。锥孔气流量:50 L/h,脱溶剂流量:600 L/h;扫描时间:0.3 s;质量扫描范围:100~1 000 m/z。
1.2.5 数据分析
利用Masslynx 4.1工作站进行数据采集,并对所有数据进行主成分分析(PCA)、正交校正的偏最小二乘、判别分析(OPLS-DA)。
2 实验结果
2.1 大鼠一般情况及创面情况
正常组整体状态较好,活动灵敏,造模前后均无明显的蜷缩、少食等现象。模型组随着菌液注射体质量增长不明显,逐渐出现蜷缩、少食,尿液深黄、尿少,大便稀溏、腥臭或干结粪便等。正常组的局部创面在连续3 d的注射后见少量的皮肤稍显潮红,稍隆起水肿,无明显的浆液性或脓性分泌物。模型组局部创面在滴、注菌液后的第2天即出现皮肤潮红、有浅表脓点出现,稍肿胀,至注射后的第4天局部出现隆起,颜色焮红,表皮剥脱,见浆液性或脓性分泌物,出现脓点,部分按压后有局部软化、轻微的波动感觉。根据全身出现的蜷缩、尿黄、粪便干结和局部的焮红、软化、脓液形成等现象,此时符合中医阳证疮疡的中期证候表现。直观上造模成功。
继续观察至造模后的1周左右,造模组局部和全身症状均明显减轻或消失,说明大鼠对局部感染的自愈能力较强。两组均未出现大鼠死亡现象。
2.2 创面肉芽组织病理染色结果
2.2.1 正常组第4天病理切片
由图1A苏木素-伊红染色(100倍)病理切片图可看出,大鼠表皮局部糜烂,炎性渗出形成,鳞状上皮灶性脱落,中度急慢性炎细胞浸润,以中性粒细胞为主。毛囊及脉管周少许炎细胞浸润。图1B革兰氏染色(100倍)显示,表皮炎性渗出物中见散在革兰阳性菌。
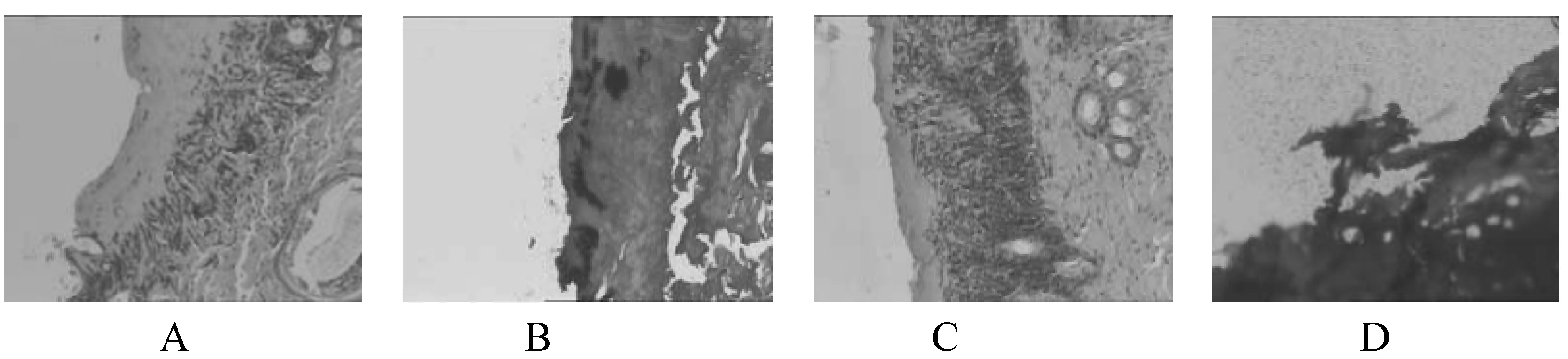
图1 正常组第4天病理切片
2.2.2 模型组第4天局部组织病理切片
图1C苏木素-伊红染色(100倍)显示,大鼠表皮局部糜烂,鳞状上皮灶性脱落,重度急慢性炎细胞浸润,以中性粒细胞为主。毛囊及脉管周炎细胞浸润。图1D革兰氏染色(100倍)表皮炎性渗出物中见大量革兰阳性菌,真皮纤维组织中小灶区域见少许革兰阳性菌浸润。
2.3 造模前后大鼠血浆代谢轮廓分析
采用UPLC-QTOF/MS在正、负离子模式下采集正常组与模型组大鼠血浆的典型总离子流图。如图2所示,血浆中内源性物质均得到良好的分离,且实验模型大鼠血浆的图谱与正常组大鼠血浆的图谱存在一定的差异。为了进一步检测大鼠体表感染模型的代谢轮廓的变化情况,对正常组和体表感染模型大鼠的血浆代谢谱的数据进行模式识别,如PCA和OPLS-DA,见图3。PCA图可以看出正常组与模型组大鼠血浆代谢谱分为两类,两者明显区分。OPLS-DA图可以看出正常与模型大鼠的血浆生物样品呈现聚拢状态,且区分明显。
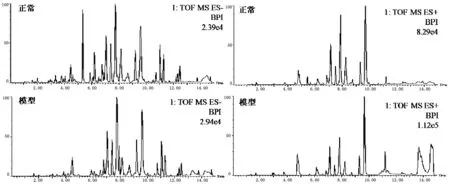
图2 正常和模型大鼠血浆生物样品在ESI+/ESI-模式下的色谱图
2.4 造模前后大鼠尿液代谢轮廓分析
采用UPLC-QTOF/MS在正、负离子模式下采集正常组与模型组大鼠尿液的典型总离子流图。如图4所示,尿液中内源性物质均得到良好的分离,且模型大鼠尿液的图谱与正常大鼠血浆的图谱存在一定的差异。为了进一步检测大鼠体表感染模型的代谢轮廓的变化情况,对正常组和体表感染模型大鼠的尿液代谢谱的数据进行模式识别,如PCA和OPLS-DA,见图5。PCA图可以看出正常组与模型组大鼠尿液代谢谱分为两类,两者明显区分。OPLS-DA图可以看出正常与模型大鼠的尿液生物样品呈现聚拢状态,且区分明显。
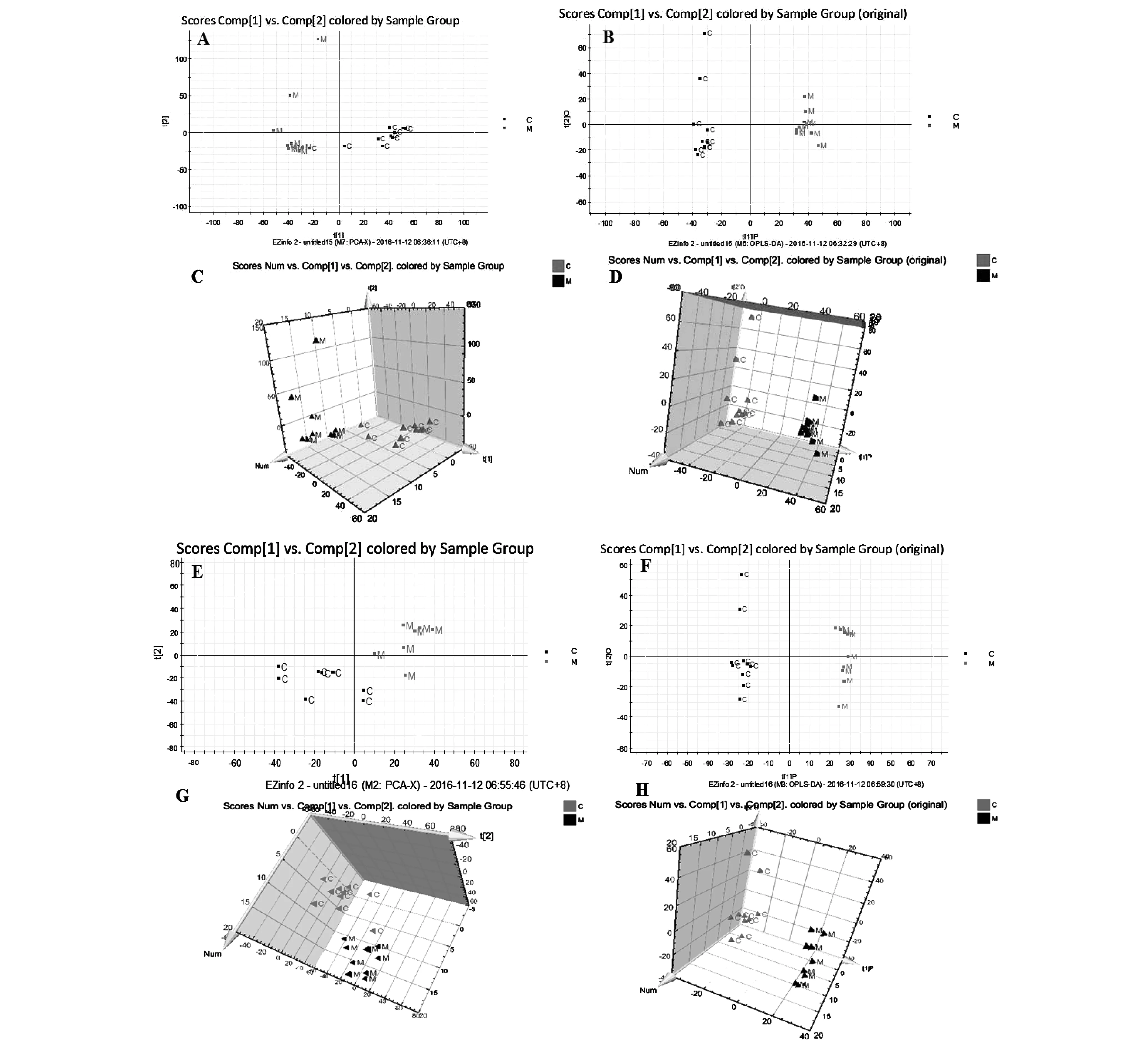
注:A,E.PCA图(2D图);B,F.OPLS-DA图(2D图);C,G.PCA图(3D图);D,H.OPLS-DA图(3D图);A,B,C,D为ESI-模式;E,F,G,H为ESI+模式图3 大鼠血浆生物样品在ESI+/ESI-模式下的PCA及OPLS-DA图
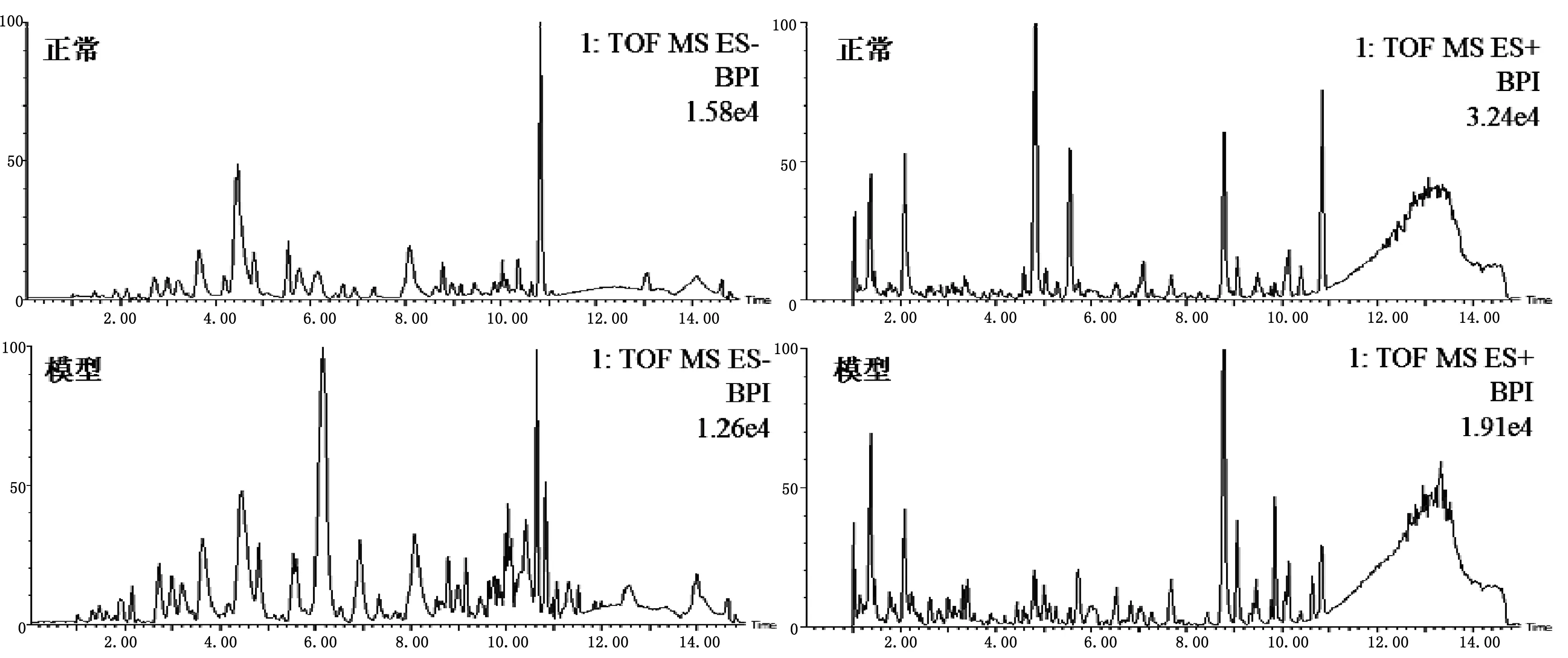
图4 正常和模型大鼠尿液生物样品在ESI+/ESI-模式下的色谱图

注:A,E.PCA图(2D图);B,F.OPLS-DA图(2D图);C,G.PCA图(3D图);D,H.OPLS-DA图(3D图);A,B,C,D为ESI-模式;E,F,G,H为ESI+模式图5 大鼠尿液生物样品在ESI+/ESI-模式下的PCA及OPLS-DA图
3 讨论
本研究按照“胶带剥脱法”加皮下多点注射菌液法完成实验动物模型的建立。将大鼠腹腔麻醉局部褪毛后以市售透明胶带纸于大鼠背部大约粘扯30次左右后面积约3 cm2,即可导致大鼠表皮脱落,局部皮肤光亮、潮红、见渗血点而无广泛血液渗出,显露真皮层,滴注菌液约后待麻醉动物苏醒,菌液基本吸收,予以单笼饲养大鼠,以避免大鼠之间相互舔舐伤口影响药物的疗效。以后每天同一时间局部皮下再注射菌液,连续3 d。造模第4天观察造模效果整体良好,感染情况明显,出现较典型的局部红热肿胀现象,从全身及局部考察符合中医外科阳证疮疡的特点,局部感染组织经病理切片证实为明显的炎症反应。从组织病理切片显示来看,模型大鼠的皮肤坏死明显,表面有大量的炎性渗出物及坏死物,大量淋巴细胞、单核细胞及中性粒细胞浸润,符合体表感染的病理变化。通过代谢组学方法验证分析发现,模型组的血浆和尿液在OPLS-DA图上均呈现聚拢状态且与空白组完全分开,偏离正常状态,为模型造模成功提供明确的佐证。该造模方法取得成功,并未出现大鼠死亡。
中医证候动物模型的建立与研究是联系中医基础和临床的桥梁和纽带,是有效中药的筛选、药物作用机制深入研究的基础[5],模型制作成功与否,直接影响实验的过程与结果,一种符合中医证候特点的疮疡中期感染模型的复制显得必要。目前体表感染模型(疮疡)的制作有金葡菌直接注射法[6]、十字切开注射法[7-11]和表皮剥脱菌液滴注法[12]等,均可不同程度地引起局部的感染证候,但由于动物的抗感染能力较强,比较难复制出疮疡中期(脓肿期)的模型,经过反复的预实验,本次研究采用Elisabeth Kugelberg 等[4]设计的胶带表皮剥脱加皮下连续注射的方法制作模型,目的是造成连续感染,使得感染模型进入疮疡中期阶段,以满足实验需求。后续的实验研究中,可根据需要减少注射次数和初次菌液滴注量和吸收时间等,可获得不同感染程度的局部疮疡模型,供不同的实验需要。
中医证候动物模型的建立与评价经历了较长时间的发展,现在仍处于探索的阶段,也存在着许多的问题和争议,这主要源于证本质研究尚未完善,临床诊断信息无法应用于动物模型评价中。学术界公认的较客观地评价中医证候的指标并不多,且缺乏特异性等。代谢组学是一种采用系统生物学思路研究代谢小分子组的高通量的分析方法,通过比较不同条件下相关小分子的代谢图谱,找到具有差别意义的生物标志物[13-14],为客观评价中医证候模型提供了不同的思路与依据,代谢组学整体性、动态性、系统性特点与中医基本理论非常吻合,在中医证候动物模型研究领域中展现出很重要应用前景,对中医药现代化的实现起到有力的推动作用[15]。利用代谢组学对中医证候动物模型进行研究,具有方法论的高度契合性、学术思想的有效相通性和研究方法的一致性等特点和优点,将会是今后研究的热点和趋势。应用代谢组学来研究、评价和指导建立中医证候动物模型,通过代谢组与生物体功能状态关系的建立,能够比较有效地克服目前证候动物模型证候难以判定的难题,同时又可指导中医证候动物模型的创制,有希望进一步推进中医证候动物模型的复制以及中医证候本质标准化和规范化的研究[16]。
