紫外线等离子体复合诱变赤红球菌提高红色素产量
2019-03-19陈红爽张孟阳王丽娟毕付提王德培
陈红爽,张孟阳,王丽娟,毕付提,王德培
(天津科技大学 生物工程学院工业发酵微生物教育部重点实验室,省部共建食品营养与安全国家重点实验室,天津300457)
色素即着色剂,是印染工业和食品添加剂的一个重要组成部分,它可以改善印染物品和食品的色泽,是决定产品品质的关键因素之一[1]。目前色素主要来源:化学合成色素和天然色素。许多合成色素经毒理检测证实对人体有一定的危害性,因而被限制使用。天然色素则因安全性高并具有一定的保健功能而受到广泛关注,成为研究热点[2]。国内对天然红色素的提取研究起步较晚,但发展迅速[3]。目前天然色素远远不能满足现代工业的需要,开发天然色素新品种,对原有天然色素的生产工艺进行改造,己成为非常迫切的问题[4-5]。因此通过诱变育种或是分子手段选育出一株高产红色素的菌株具有重要意义。
常压室温等离子体诱变系统(atmospheric and room temperature plasma,ARTP)是近几年新发展的一种诱变方法[6]。它是一种等离子体源,能够产生25℃~40℃的温度且具有高活性粒子浓度的等离子体射流。这种高活性的离子体能够使微生物的细胞膜或细胞壁的结构及通透性发生改变,也能与生物体内的生物大分子(酶或DNA)相互作用,引起生物体的死亡或突变[7],从而引起基因的随机突变。诱变后突变株的细胞膜具有高通透性的特点,底物可以通过细胞膜进入细胞,产物同时也能很快分泌到细胞外[8]。与分子手段相比,等离子体诱变育种具有操作简便、安全无毒、低成本的优点[9]。多功能等离子体诱变系统(multifunction plasma mutagenesis system,MPMS)作为一种新一代微生物诱变平台,以等离子体诱变为主,可与紫外、化学诱变等多种手段结合,提高了突变率和改变了突变类型[10]。
本文以前期从自然界中分离筛选得到的野生赤红球菌YM-2作为出发菌株,采用等离子体单独诱变,等离子体连续诱变、紫外线单独诱变、紫外线等离子体复合诱变等方法对赤红球菌YM-2进行诱变,通过对不同诱变方法及其条件的探究,以期筛选育出一株高产红色素的赤红球菌。
1 材料与方法
1.1 材料
1.1.1 供试菌株
赤红球菌YM-2(Rhodococcus ruber YM-2)由生化过程与技术实验室自潜水艇烟囱中分离得到,中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏号:CGMCC No.12604。
1.1.2 试剂
果糖、氯化钠、MgSO4·7H2O、KH2PO4(分析纯):博欧特(天津)化工贸易有限公司;酵母粉、蛋白胨、琼脂、玉米浆、无水乙醇(分析纯):天津市化学试剂开发中心。
1.1.3 培养基
种子培养基:果糖10 g/L,蛋白胨6 g/L,酵母粉15 g/L,氯化钠 10 g/L,玉米浆 15 g/L,KH2PO40.6 g/L,MgSO4·7H2O 0.3 g/L;pH 6.5;灭菌121℃,20 min。
发酵培养基:果糖15 g/L,蛋白胨5 g/L,酵母粉15 g/L,氯化钠 12 g/L,玉米浆 17 g/L,KH2PO40.8 g/L,MgSO4·7H2O 0.3 g/L ;pH 6.5;灭菌 121 ℃,20 min。
筛选培养基:果糖8 g/L,蛋白胨5 g/L,酵母粉10 g/L,氯化钠6 g/L,玉米浆10 g/L,KH2PO40.6 g/L,MgSO4·7H2O 0.2 g/L ;pH 6.5;灭菌 121℃,20 min。
1.2 仪器与设备
Mandela型多功能等离子体诱变系统(MPMS):北京艾德豪克仪器生物有限公司;常压室温等离子体诱变系统(ARTP):北京思清源生物科技有限公司;320-S型pH计:梅特勒-托利多(上海有限公司);TU-1810紫外可见光分光光度计:北京普析通用仪器有限责任公司;LRH-250A生化培养箱:韶关市泰宏医疗器械有限公司;MQD-S3R旻泉摇床:上海旻泉仪器有限公司;KM-23C超声波清洗机:广州市科洁盟实验仪器有限公司;YP电子天平:上海津平科学仪器有限公司等。
1.3 方法
1.3.1 培养方法
种子培养:挑取一环斜面或平板中菌落直径大且颜色分布均匀的单菌落,接种到含有50 mL种子培养基的250 mL三角瓶中,于摇床中150 r/min,28℃培养40 h。
发酵培养:将活化好的种子液,以4%(体积分数)的接种量接种到含有50 mL发酵培养基的250 mL三角瓶中,于摇床中190 r/min,28℃发酵72 h。
诱变前菌体活化培养:取活化好的种子液,以4%(体积分数)的接种量接种到含有50 mL种子培养基的250 mL三角瓶中,于摇床中190 r/min,28℃培养24 h,使菌体处于对数生长的中后期。
1.3.2 菌株的诱变
菌悬液的制备:取1 mL活化的菌液于2 mL EP管内,4 000 r/min离心3 min,弃上清收集菌体,用无菌的生理盐水离心洗涤3次,然后将菌体重悬于无菌生理盐水中,稀释10倍,使细胞的终浓度为1×107个/mL。
等离子体诱变:取菌悬液10 μL滴在ARTP诱变专用无菌小铁片中央,将其置于等离子体诱变系统(ARTP)中进行等离子体诱变,以99%的氦气作为工作气体,输入功率120W,间距15mm,气流量10 L/min,分别诱变时长 10、15、20、25、30、35、40、45、50 s计算致死率及正突变率[11]。
等离子体连续诱变:将第1次等离子诱变筛选出的菌株45 S-2,作为出发菌株制备成菌悬液,经等离子诱变的流程和条件,进行第2次等离子诱变,筛选高产红色素菌株。
紫外线诱变:取上述菌悬液10 μL均匀的涂布于诱变杯中,晾干后将其置于多功能等离子体诱变系统(MPMS),用紫外线诱变进行处理,分别诱变时长20、25、30、35、40、45、50、55、60 s,计算致死率及正突变率。
紫外线-等离子体复合诱变:取上述菌悬液10 μL均匀的涂布于诱变杯中,晾干后将其置于多功能等离子体诱变系统(MPMS),先用紫外线诱变进行处理,随后进行等离子体诱变,计算致死率及正突变率。
1.3.3 筛选方法
诱变初筛:将诱变处理后的诱变小铁片加入装有990 μL培养基的2 mLEP管里,将菌种洗下制成菌悬液。稀释100倍后,取200 μL均匀涂到筛选培养基表面,28℃静置培养72 h,挑选菌落直径≥1 mm的菌株。
诱变复筛:将初筛菌种接于液体种子培养基中,于摇床中150 r/min,28℃培养40 h,活化2次后以4%(体积分数)的接种量接于发酵培养基中,于摇床中190 r/min,28℃培养72 h,然后将菌液收集到离心管中5 000 r/min离心10 min,弃上清液留菌体,用蒸馏水离心洗涤3次。将湿菌体于-20℃冰箱里冷冻12 h。
1.3.4 红色素的提取及检测方法
取出冷冻12h后的湿菌体解冻30min,加入100%乙醇10 mL混匀,在冰浴上进行超声波碎处理,超声功率300 w,萃取菌体内红色素,用分光光度计对萃取的红色素进行光谱扫描,测出红色素的OD450值。
1.3.5 计算
致死率的计算:对诱变处理过的菌液在适当的稀释度下涂平板,28℃培养72 h通过单菌落计数来计算其致死率,并获得致死率曲线。

正突变率的计算:28℃培养72 h挑取平板上菌落直径≥1 mm的菌株,菌落颜色红色程度深且均匀的菌株统计为正突变株。

2 结果与分析
2.1 初筛方法的建立
所用的菌株是赤红球菌YM-2,其次生代谢产物红色素,肉眼可见。出发菌株YM-2在筛选培养基中28℃培养72 h菌落直径分布见表1。
由表1可知,菌落直径≥1mm的占7.0%,0.74mm~1 mm的菌落占11.0%,菌落直径≤0.74 mm的菌落占82.0%。
试验选择赤红球菌在筛选培养基中28℃培养72 h挑选菌落直径≥1 mm,菌落呈均匀深红色菌株,作为初筛正突变菌株。

表1 平板菌落大小分布Table 1 The distribution of colony size
2.2 复筛方法的建立
红色素是赤红球菌次生代谢的产物,因此,与赤红球菌发酵时间和菌体密度密切相关,将赤红球菌摇瓶发酵连续5 d,每隔一段时间取样一次,测其菌体干重和红色素产量,绘制菌体干重和红色素含量随发酵时间变化的积累曲线,测出提取红色素的时间。赤红球菌YM-2的菌体干重及类胡萝卜素积累曲线见图1。

图1 赤红球菌YM-2的菌体干重及类胡萝卜素积累曲线Fig.1 The profile of bacterial weight and carotenoid accumulation of YM-2
由图1可以看出,菌体的生长和红色素的合成主要分为3个阶段。在0~36 h为菌体生长阶段菌体大量增殖,但是红色素只有少量合成;在36 h~72 h为红色素合成阶段,在此阶段内生物量基本保持不变,红色素开始大量积累[12];在摇瓶发酵进行72 h之后,菌体生物量和总类胡萝卜素产量都开始出现不同程度的下降,因此将此时间段称为产物降解阶段。因此将摇瓶复筛发酵时间确定为72 h,此时菌体生物量和总类胡萝卜素的粗提产量分别达到8.25。
2.3 等离子体诱变结果
2.3.1 等离子体诱变对菌株致死率及正突变率的影响
菌株经等离子诱变后,其致死率和正突变率如图2所示。

图2 等离子诱变对菌株的致死率和正突变率影响Fig.2 The effect of ARTP treatment on lethality rate and positive mutation rate
等离子体诱变对YM-2的致死力较强,ARTP处理25 s时致死率达到81.05%,处理50 s时致死率达到92.1%。已有研究表明,致死率通常在85%~95%之间的正突变率最高,所以一般选择这个致死率区间进行诱变筛选[13-14]。通过对致死率在80%~95%之间的6个点测定其正突变率,如图2显示,结果表明等离子体处理45 s时正突变率最高,为39.40%,此时致死率为88%。
2.3.2 等离子体单独诱变的筛选结果
按照2.1的方法对等离子体处理后的菌悬液,进行平板初筛,挑取30株菌落直径较大菌株按照2.2的方法进行复筛,红色素产量见图3所示。

图3 等离子诱变突变株红色素的产量Fig.3 The red pigment production of the mutants on ARTP treatment
由图3可知,直径≥1 mm的菌株中,90%的菌株发生了正突变,证明了初筛方法的有效性。从中筛选出一株红色素产量最高菌45S-2,红色素提取液的OD450值为3.120,相比于出发菌株提高了16.0%。
2.4 等离子体连续诱变的筛选结果
将上述等离子体诱变筛选到的高产菌株45S-2再次进行等离子体诱变,按照2.1的方法进行平板初筛,挑取30株按照2.2的方法进行复筛,红色素产量见图4所示。
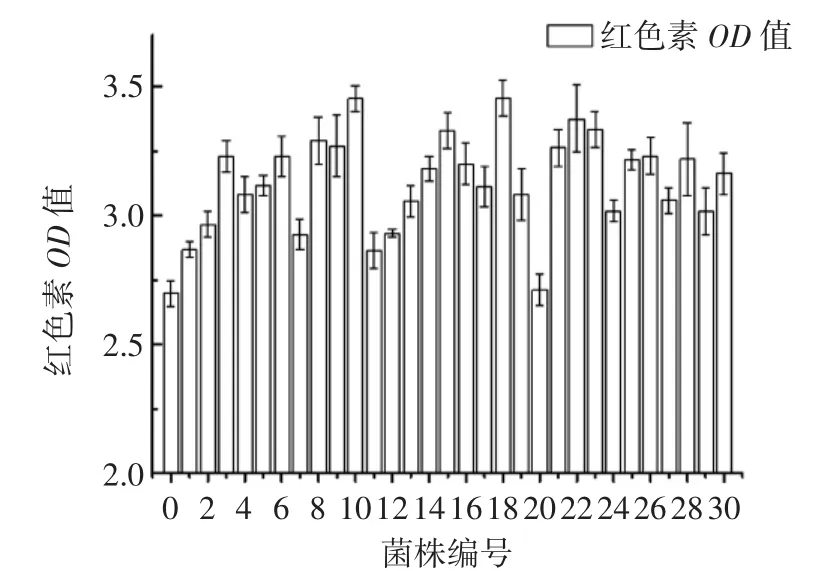
图4 等离子体诱变突变株红色素的产量Fig.4 The red pigment production of the mutants on ARTP treatment
由图4可知,上图中编号的10、18、22分别对应菌株A2、A5、A7,这3株是筛选出产红色素相对较高的菌株,红色素提取液的OD450值依次为3.490、3.453、3.414,较出发菌分别提高了29.80%、28.36%、26.91%。
2.5 紫外诱变结果
2.5.1 紫外线诱变对菌株致死率及正突变率的影响
以YM-2为出发菌株进行紫外线诱变。测定其致死率曲线见图5所示。
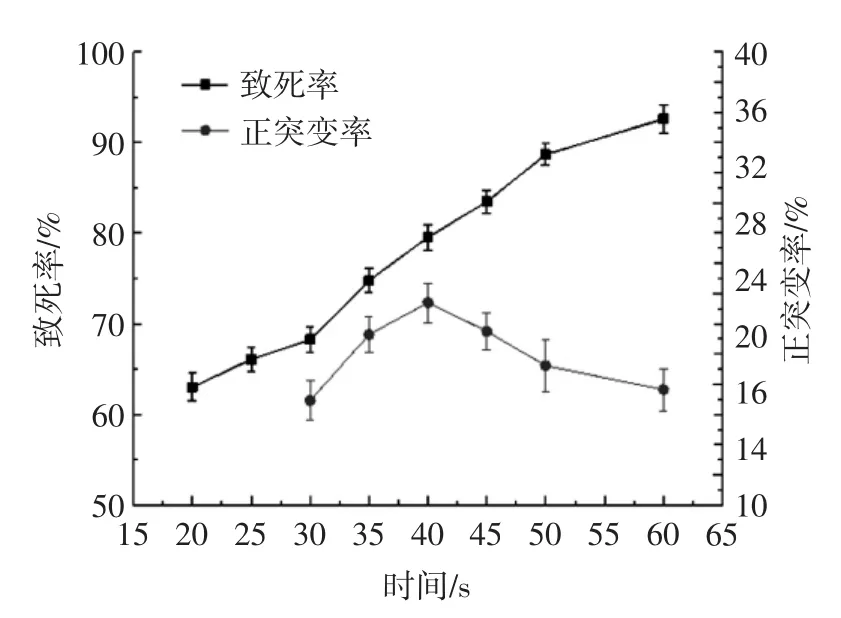
图5 紫外线诱变对菌株的致死率和正突变率影响Fig.5 The effect of UV treatment on lethality rate and positive mutation rate
由图5可知,紫外线单独诱变对YM-2的致死力较弱,UV处理20 s时致死率达到63.04%,处理50 s时致死率达到88.7%。当紫外线诱变处理40 s时正突变率最高,为23.4%,此时致死率为79.57%。
2.5.2 紫外线诱变的筛选结果
当紫外线处理后的菌悬液,按照2.1的方法进行平板初筛,挑取30株按照2.2的方法进行复筛,红色素产量见图6所示。
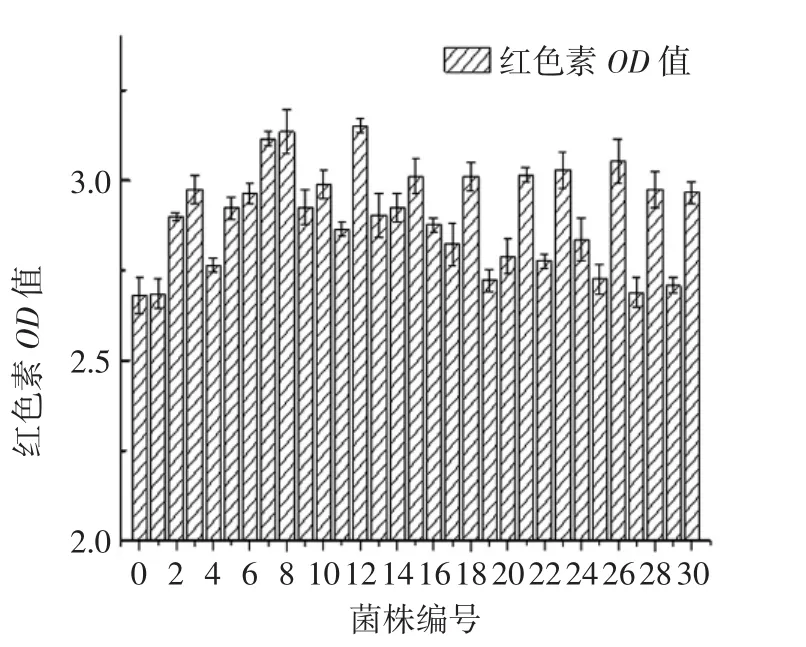
图6 紫外诱变突变株红色素的产量Fig.6 The red pigment production of the mutants on UV treatment
由图6可知,直径≥1 mm的菌株中,80%的菌株发生了正突变,证明初筛方法的有效性。挑选的30株菌株中,红色素提取液的OD450值为3.00~3.20的菌株占26.7%。经过紫外线单独诱变及筛选,图中编号的12、8分别对应菌株C6、C9,这两株是筛选出产红色素相对较高的菌株,红色素提取液的OD450值依次为3.181、3.132,较出发菌分别提高了18.70%、16.87%。从试验结果看出紫外线诱变最好正突变率为23.4%,而等离子体诱变最好正突变率39.40%,所以考虑紫外线和等离子体复合诱变以期筛选到较好的菌株。
2.6 紫外线-等离子体复合诱变结果
2.6.1 紫外线-等离子体复合诱变对菌株致死率和正突变率的影响
复合诱变包括两种或多种诱变剂的先后使用、同时使用、同一诱变剂的重复使用。普遍认为复合诱变具有协同效应。单一诱变因子长期使用容易使菌株产生耐受性,两种或两种以上诱变剂合理搭配进行复合诱变较单一诱变效果更好[15]。
本试验采用先紫外处理后等离子体的复合诱变顺序,以紫外线诱变时间20 s为确定诱变时间,等离子体诱变时长分别为 4、6、8、10、12、14、16、18 s 考察致死率及正突变率如图7所示。由图7可知,在复合诱变中,随着复合诱变时间的增加,致死率除在等离子体诱变10 s和12 s时有所下降,整体是呈现上升状态,但正突变率却在等离子诱变12 s时最高,说明两种诱变因子存在协同作用,即紫外线和等离子体两种诱变方法同时作用于菌株,导致等离子体诱变18 s致死率到达90%以上,而单独等离子诱变50 s时致死率达到92.1%,两种诱变剂复合使用致死效率明显提高。
2.6.2 紫外线-等离子体复合诱变的筛选结果
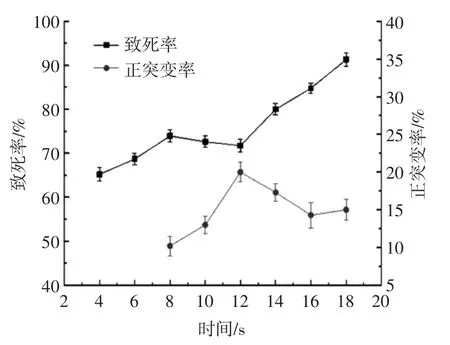
图7 紫外线-等离子体复合诱变对菌株的致死率和正突变率影响Fig.7 The effect of MPMS-UV treatment onlethality rate and positive mutation rate
当紫外线-等离子体复合诱变处理后的菌悬液,按照2.1的方法进行平板初筛,挑取30株按照2.2的方法进行复筛,红色素产量见图8所示。

图8 紫外线-等离子体复合诱变突变株红色素的产量Fig.8 The red pigment production of the mutants on MPMS-UV treatment
挑选的30株菌株中,红色素提取液的OD450值为3.00~3.30的菌株占33.4%。而单独紫外诱变复筛OD450值为3.00~3.30的菌株占26.7%,且经过紫外线-等离子体复合诱变及筛选,图中编号的21、30分别对应菌株H5、H8,这两株是筛选出产红色素相对较高的菌株,红色素提取液的OD450值依次为3.230、3.153,较出发菌分别提高了20.52%、17.65%,表明紫外线-等离子体复合诱变明显优于紫外线单独诱变。
2.7 突变菌的遗传稳定性研究
将经等离子体单独诱变、等离子体连续诱变、紫外线单独诱变、紫外线等离子体复合诱变筛选到的菌株进一步摇瓶复筛,得到两株产量提高菌(A2、A5),为考察突变株的遗传稳定性,将A2、A5菌株在平板培养基中传代培养10代,并将各代菌体分别经种子活化后接种于发酵培养基中,28℃培养72 h,通过分光光度法测定红色素产量,如图9所示。
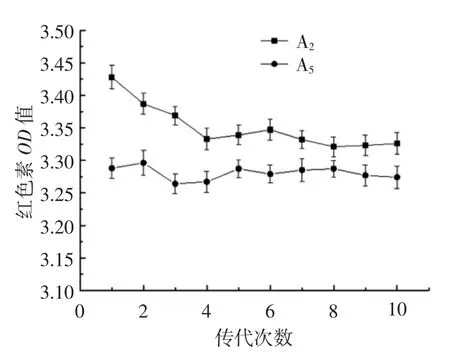
图9 突变株的遗传稳定性实验Fig.9 Genetic stability experiment of the mutant strains
由图9可知,菌株A2在传代从第1代到第4代红色素提取液的OD450值有明显的下降,但到第5代至之后,红色素提取液的OD450值趋于稳定。而菌株A5在传代从第1代到第2代红色素提取液的OD450值略由上升趋势,但第3代到第4代有明显的下降,到第5代之后很快提取液的OD450值回复且遗传比较稳定。
3 结论
该文研究等离子体诱变对赤红球菌的致死率及正突变率的影响,从结果得出,等离子体诱变45 s时正突变率最高达到为39.40%,从诱变效果来看,有明显的提高,可以作为诱变育种的首选方法。在该条件下再次进行等离子体诱变,筛选出一株产量提高的菌株A2。与出发菌株YM-2相比,红色素的粗提产量从0.86 g/L提高到1.12 g/L,提高了30.23%,传代10次发现遗传稳定性良好。
通过不同诱变方法(等离子体单独诱变,等离子体连续诱变,紫外线单独诱变,紫外线-等离子体复合诱变)对目的菌株YM-2进行诱变。等离子体单独诱变结果:筛选出45S-2,红色素提取液的OD450值为3.120,相比于出发菌株提高了16.0%;等离子体连续诱变结果:分别筛选出A2、A5、A7,红色素提取液的OD450值依次为 3.490、3.453、3.414,较出发菌分别提高了29.80%、28.36%、26.91%;紫外线单独诱变结果:分别筛选出C6、C9,红色素提取液的OD450值依次为3.181、3.132,较出发菌分别提高了18.70%、16.87%;紫外线-等离子体复合诱变结果:分别筛选出H5、H8,红色素提取液的OD450值依次为3.230、3.153,较出发菌分别提高了20.52%、17.65%。从诱变剂对菌株产红色素的诱变效果可见:单独进行紫外线或等离子体诱变的效果相近;而复合诱变如紫外线-等离子体复合诱变,或等离子体连续诱变明显比单一诱变效果提高,其中等离子体连续诱变效果对产红色素有较好作用。
