梯度有序支架材料诱导神经干细胞的定向迁移
2019-03-18李梦媛李晓然戴建武文铁桥
李梦媛, 李晓然, 戴建武, 文铁桥
(1. 上海大学生命科学学院, 上海200444;2. 中国科学院苏州纳米技术与纳米仿生研究所纳米-生物界面研究重点实验室, 江苏苏州215123;3. 宁夏医科大学回医药现代化教育部重点实验室, 银川750004)
脊髓损伤是中枢神经系统的严重创伤, 脊髓损伤后脊髓神经元大量缺失, 星形胶质细胞增生形成新的微环境, 分泌出基质细胞衍生因子-1α(stromal-cell-derived factor-1α, SDF1α)形成浓度梯度, 可长距离募集神经干细胞(neural stem cells, NSCs) 迁移到损伤部位[1]. 然而, SDF1α 在损伤部位浓度低且保留时间短, 导致神经干细胞不能形成足够的群落实现神经网络连接, 这是脊髓损伤修复效果不佳的原因之一[2]. 近年来, 已有学者通过注射、移植包载SDF1α 的活性材料到骨损伤[3]、心肌损伤[4]、软骨损伤[5]等的损伤部位, 实现SDF1α 局部梯度浓度释放, 可诱导自体干细胞迁移到损伤部位, 促进组织再生. 本工作采用静电纺丝法制备放射状胶原/聚己内酯(polycaprolactone, PCL)电纺纤维支架, 担载具有胶原特异结合区的SDF1α, 制备得到胶原特异结合的SDF1α(collagen-binding domain SDF1α, CBD-SDF1α)梯度有序支架, 在进行神经干细胞培养后, 研究出此梯度有序支架材料对神经干细胞及神经干细胞球迁移能力的影响.
1 材料与仪器
1.1 材料和试剂
PCL (Sigma); 1, 1, 1, 3, 3, 3-六氟-2-异丙醇(Sigma); 胰酶替代物(Gibco); 表皮生长因子(epidermal growth factor, EGF)(Peprotech); 碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)(Peprotech); B27(Gibco)等.
1.2 仪器
激光共聚焦扫描显微镜(A1RSi, 尼康); 场发射环境扫描电子显微镜(Quanta 400 FEG,美国FEI); CO2恒温细胞培养箱(HERA cell i150, 赛默飞); 微量注射泵(KDS100, 美国KDS)等.
2 实验方法
2.1 梯度有序纤维支架的制备
纤维支架溶质为胶原与PCL, 以3∶7 比例混合溶于六氟异丙醇(浓度比为20%). 固定静电纺丝装置, 接收装置采用点电极与环形电极的组合[6]. 使用微量注射泵泵出胶原和PCL 的混合溶液, 控制其流速为0.15 mL·h−1, 控制高压直流电源电压为10 kV; 溶液喷头距接收装置的距离约为10 cm.
2.2 CBD-SDF1α 的制备
制备负载CBD-SDF1α, 大肠杆菌BL12(DE3)负载pET-CBD-SDF1α 质粒以表达CBDSDF1α 蛋白, 并用6×HIS 纯化标签纯化和检测[3].
2.3 支架材料孵育CBD-SDF1α
将胶原/PCL 纤维支架材料用1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC)和N-羟基硫代琥珀酰亚胺(N-Hydroxysuccinimide; 1-hydroxypyrrolidine-2, 5-dione, NHS) 交联后, 磷酸缓冲盐溶液(phosphate buffer saline, PBS) 清洗3 遍. 支架材料在75% 的乙醇中浸泡2 h 消毒, PBS 清洗3 遍. 将500 µL 的CBD-SDF1α(0.5×10−6M)滴加在交联后的支架材料上, 在37◦C 培养箱中孵育2 h.
2.4 NSCs的分离培养
出生24 h 的美国癌症研究所(Institute of Cancer Research, ICR)饲养小鼠断颈处死后放入75%的乙醇中浸泡消毒, 在超净工作台中提取其大脑海马区. 使用胰酶替代物在37◦C 恒温下消化分离的海马区10 min, 然后将获得的细胞重悬培养在无血清的DMEM(dulbecco’s modified eagle medium)/F12培养基中,同时添加20 ng·mL−1bFGF、20 ng·mL−1EGF、B27、丙酮酸盐和非必需氨基酸[7]进行NSCs 培养.
2.5 NSCs 的迁移
将NSCs 接种在材料外周, 使用贴壁培养基培养2 h (贴壁培养基:高糖DMEM/F12、胎牛血清(fetal bovine serum, FBS) 和B27) 后, 更换分化培养基培养1 d (分化培养基:DMEM/F12 和B27). 在培养1 d 后, 用4% 多聚甲醛固定NSCs 20 min, 然后再用0.08%triton X-100 透膜5 min, 用5% 牛血清白蛋白(albumin from bovine serum, BSA) 封闭30 min. 将处理后的NSCs 样品4◦C 恒温下孵育一抗12 h. 最后, 在室温孵育二抗和4’, 6-二脒基-2-苯基吲哚(4’, 6-diamidino-2-phenylindole, DAPI)40 min 后, 使用激光共聚焦扫描荧光显微镜观察拍照.
2.6 数据处理
数据的处理和计算采用Microsoft Office Excel 2007 软件, 数据以“平均值± 标准差(X±SD)”的形式表示, 各指标组间差异采用t 检验法进行统计.
3 实验结果
3.1 梯度有序纤维支架
图1 为CBD-SDF1α 梯度支架材料图. 如图1(b)中的梯度有序纤维支架扫描电子显微镜图(scanning electron microscope, SEM)所示, 利用静电纺丝技术制备一种可同时提供有序纤维结构和梯度浓度生物信号分子的新型梯度材料. 该材料中心密度高, 外周密度低, 由此形成外周向中心逐渐增大的连续性密度梯度, 这种有序纤维结构可促进NSCs 迁移的接触引导. CBD-SDF1α 孵育在制备好的支架材料上, 形成稳定结合的CBD-SDF1α 浓度梯度.CBD-SDF1α 是具有胶原特异结合性的基质衍生因子[8], 选用制备的材料中含有30%的胶原成分, 此支架材料可以与CBD-SDF1α 特异结合, 增大结合稳定性并且使CBD-SDF1α 存留时间更长, 可使其缓慢释放[9]. 趋化因子受体4(chemokine receptor-4, CXCR4)是CBD-SDF1α的特异受体, 其强烈的趋化作用可促使NSCs 以及NSCS 迁移运动, 这将有利于NSCs 从CBD-SDF1α 低浓度区域向高浓度区域迁移.

图1 CBD-SDF1α 梯度支架材料Fig.1 CBD-SDF1α embedded in the radially aligned electrospun fiber scaffolds
3.2 NSCs在梯度有序支架上的迁移
图2 为有序梯度支架材料上NSCs 和NSCS 的迁移图. 图2(a)中, 将NSCs 种植在支架材料外周(红色虚线右侧)[10], 在贴壁培养2 h 后, 更换分化培养基培养1 d, 激光共聚焦扫描荧光显微镜拍照发现NSCs 沿着CBD-SDF1α 浓度梯度由低(材料外周)向高(材料中心)方向定向迁移. DAPI 染色观察到部分NSCs 迁移至材料中心区域[11].
将体外增殖培养4 d 的NSCS 如上所述种植在支架材料外周, 在贴壁培养2 h 后, 更换分化培养基培养1 d 后观察如图2(b)中的DAPI 染色所示, NSCS 在迁移过程中由团聚状态分散成单个细胞继而沿支架梯度由CBD-SDF1α 低浓度区域向高浓度区域迁移, 部分迁移出来的单细胞迁移至材料中心区域.

图2 有序梯度支架材料上NSCs 和NSCS 的迁移Fig.2 Migration of NSCs and NSCS on orderly gradient fiber scaffolds
图3 为NSCS 在有序梯度支架上的迁移图. 图中(b)∼(e)为NSCS 种植在放射状有序支架外周后迁移1 d 的局部放大图, 其中(b)为支架材料中心的部位即支架材料CBD-SDF1α 最高浓度区域, 可观察到有少量NSCs 迁移到此处. NSCS 扩散出的NSCs 沿着CBD-SDF1α 浓度低的外周迁移至浓度高的中心(约5 mm).

图3 NSCS 在有序梯度支架上的迁移Fig.3 Migration of NSCS on aligned gradient fiber scaffolds
图4 显示了NSCS 的扩散情况. 图中(a)为种植在梯度有序支架材料外周的NSCS 在不同区域扩散出NSCs 数目的对比图. 由于支架材料由中心至外周密度梯度逐渐降低, 故支架上负载的CBD-SDF1α 浓度也逐渐降低. 种植在距支架材料中心6 mm 位置处的NSCS 扩散出的NSCs 数目较种植在距支架材料中心8 mm 位置处扩散出的显著增大(p<0.01). (b)为种植的NSCS 在支架材料不同位置扩散出NSCs 的面积与NSCS 面积比的对比图. 种植在距离材料中心6 mm 位置处的NSCS 扩散出的NSCs 面积与NSCS 总面积之比, 与种植在距离材料中心8 mm 位置处的NSCS 扩散出的NSCs 面积与NSCS 总面积比相较显著增大(p <0.05),说明CBD-SDF1α 浓度越高NSCS 扩散出的NSCs 越多, 并且扩散的距离更远, 形成的扩散面积更大.
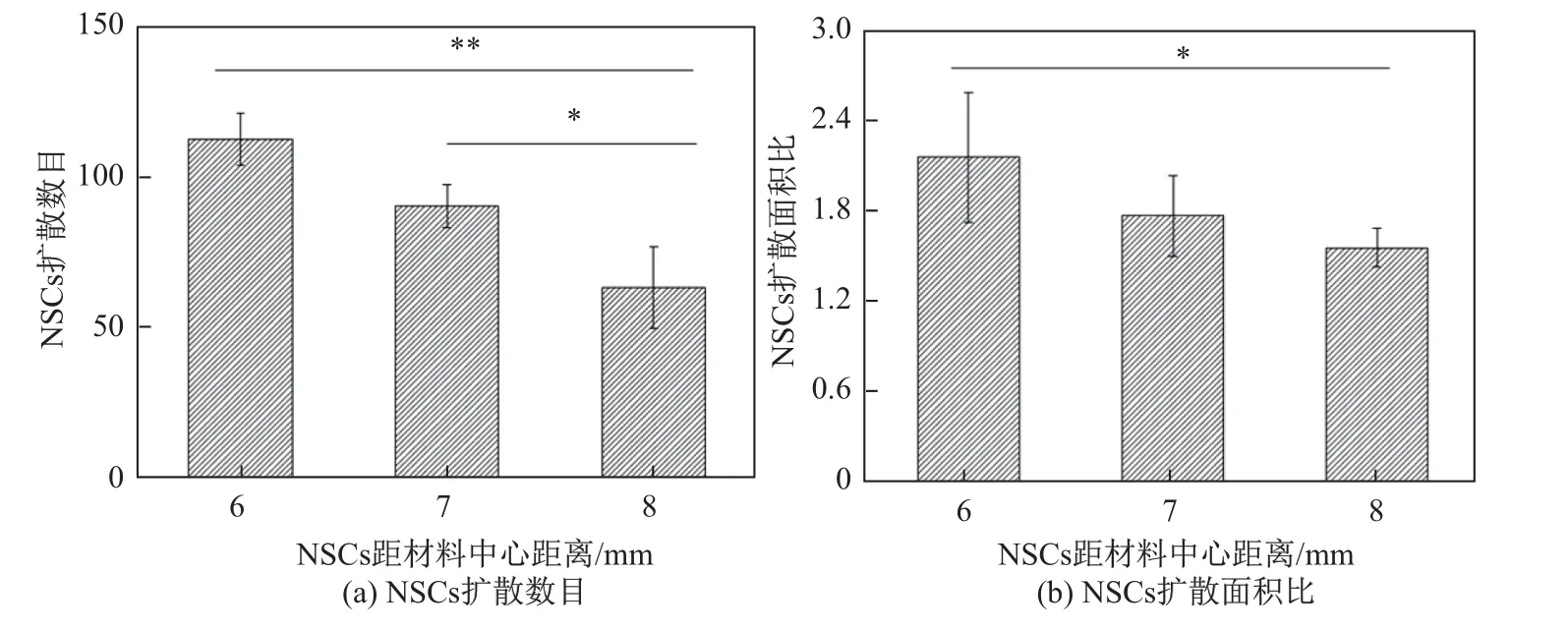
图4 NSCS 的扩散情况Fig.4 Diffusion of NSCS on aligned gradient fiber scaffolds
图5 为NSCS 在有序梯度支架材料上的定向迁移图. 分别选取(a)和(b) 2 个不同方向进行拍摄, 可明显观察到NSCS 有沿纤维支架方向迁移的趋势, 且有部分NSCs 从NSCS 中迁移出.

图5 NSCS 在有序梯度支架材料上的定向迁移Fig.5 Directional migration of NSCS on aligned gradient fiber scaffolds
3.3 NSCS的迁移形态
图6 为NSCS 迁移过程中的形态图. 图中, NSCS 迁移培养1 d 后荧光染色, DAPI (蓝色)、Nestin(绿色)、CXCR4(红色)标志NSCS 迁移过程中的形态变化. CXCR4 是基质衍生因子SDF1α 的特异性受体, 在NSCs 迁移过程中起重要的调控作用[12-14]. 图6(c)显示了NSCS在纤维方向上(横向)呈明显伸展形态, 表明NSCS 中的CXCR4 积极应答CBD-SDF1α, 使NSCS 沿着梯度有序纤维方向上呈现极化及定向延伸.
4 结束语
本工作通过简单易行、条件可控的方法制备连续性密度梯度有序纤维支架, 负载CBDSDF1α 形成连续性浓度梯度有序支架. 这种纳米至微米级的梯度材料同时提供有序拓扑结构与生物活性分子浓度梯度, 可诱导NSCs 以及NSCS 长距离定向迁移. 在此过程中还可以观察到, NSCS 在迁移中会缓慢迁移出NSCs, 在CBD-SDF1α 浓度高的纤维支架区域迁移出的NSCs 在迁移数量与距离上明显高于在CBD-SDF1α 浓度低的纤维支架区域. 本实验材料应用于修复脊髓损伤时诱导NSCs 由脊髓断端向中心缺损部位定向迁移的情况有待进一步探究.
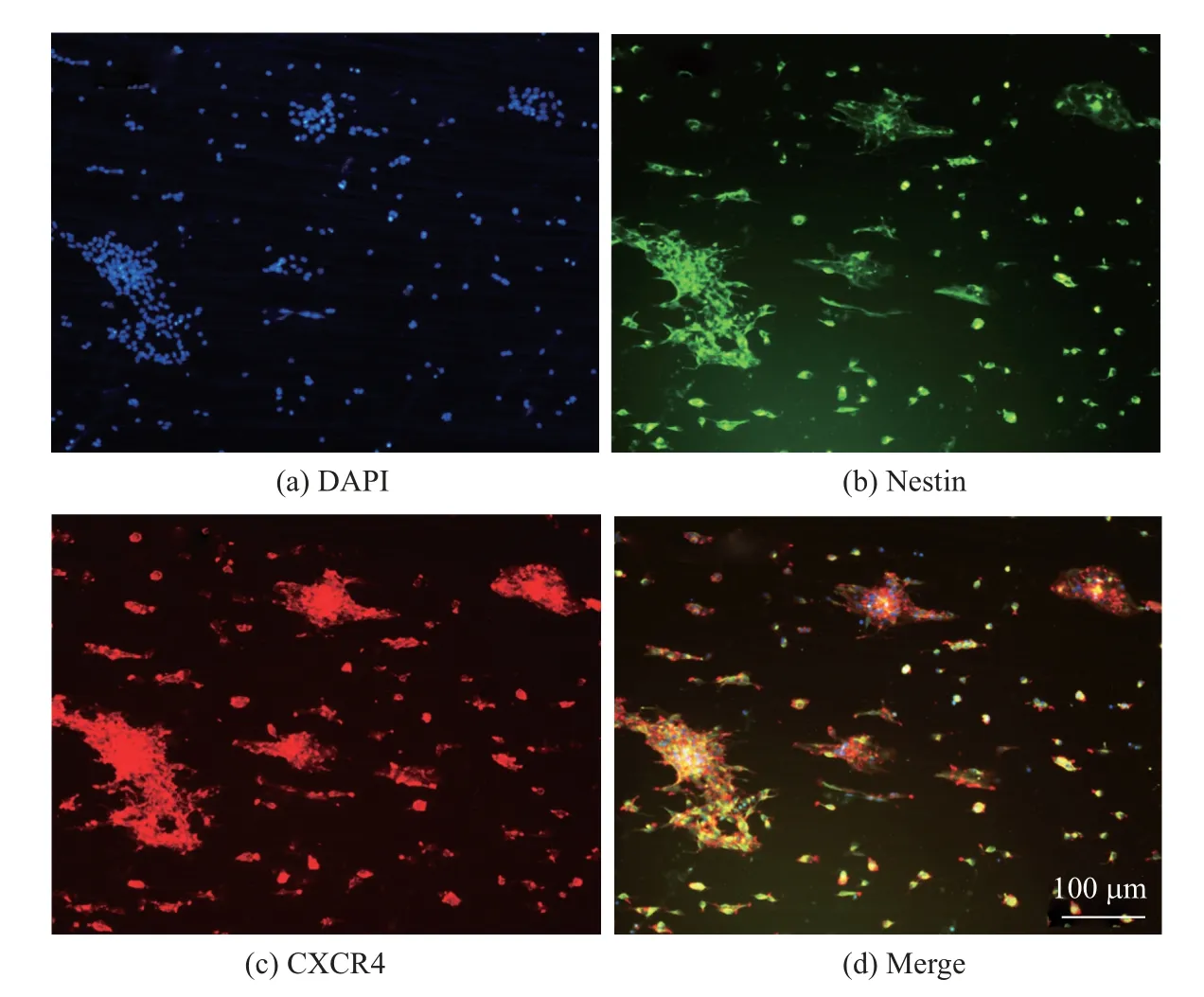
图6 NSCS 迁移过程中的形态Fig.6 Cell morphology of NSCS migrated on the aligned fiber scaffolds
