真姬菇生产废料不同溶剂提取物抗氧化活性研究
2019-03-18李佳欢都新荣王若瑾金文松胡开辉
李佳欢,都新荣,王若瑾,金文松,胡开辉*
(1.福建农林大学 生命科学学院,福州 350002;2.福建农林大学(古田) 菌业研究院,福建 宁德 352200)
真姬菇(Hypsizygusmarmoreus),又名海鲜菇、白玉菇、蟹味菇等,味道鲜美,口感脆嫩,广受亚洲人们喜爱[1,2]。随着种植规模的不断扩大,现今真姬菇已经成为国内食用菌工厂化栽培的重要品种之一。真姬菇采收后,经切头、分拣,挑选菇柄长度大于15 cm的成品菇进行包装,整个流程会产生大量的生产废料,即小菇、菇脚,占鲜菇重量的15%左右。其中,小菇的价格约为成品菇的30%,而菇脚大部分按垃圾处理,随意丢弃不但造成资源的浪费,且易造成霉菌及其他有害微生物滋生,造成环境污染[3]。因此,若能将小菇和菇脚等废渣“变废为宝”,将对整个食用菌产业产生巨大的经济价值和社会效益。
研究表明,真姬菇多糖具有抗氧化活性,浓度为5 mg/mL时,其清除能力与Vc基本相当[4];与茶树菇、松杉灵芝相比,真姬菇的抗氧化活力更高[5]。Lee等[6]指法,不同溶剂对真姬菇提取物的抗氧化活性有一定影响。于洪超等[7]在对真姬菇菌脚中营养成分和活性成分的研究中指出,真姬菇菌脚中多糖、黄酮、皂苷、总酚的含量均高于子实体。林群英等[8]在对真姬菇菇脚的研究中也发现真姬菇菇脚酶解产物可延长秀丽线虫寿命,具有良好的抗氧化活性。
本文采用ABTS、DPPH及亚铁还原能力测定方法对真姬菇成品菇、小菇及菇脚的水、甲醇、丙酮和正丁醇4种不同提取物进行体外抗氧化活性研究,并测定各种提取物中总酚的含量,进行相关性分析,为真姬菇菇脚、小菇的综合开发利用提供了理论支持。
1 材料与方法
1.1 材料与试剂
供试材料:真姬菇菇脚、小菇、成品菇,购于福建福泉鑫生物科技有限公司。材料在实验室于55 ℃烘干,经粉碎后过60目筛,最后分别密封备用。
供试试剂:没食子酸(纯度≥99.0%)标准品,购于上海麦克林生化科技有限公司;ABTS(纯度≥98.0%)、抗坏血酸、水溶性维生素E,购于北京Solarbio科技有限公司;DPPH(纯度≥97.0%),购于梯希爱(上海)化成工业发展有限公司;甲醇、丙酮、正丁醇、无水乙醇、福林酚试剂、过硫酸钾、磷酸钠、铁氰化钾、三氯乙酸、三氯化铁等,购于国药集团化学试剂有限公司,以上试剂未标注皆为分析纯。
1.2 仪器与设备
低碳节能烘干房 龙岩市向荣制冷设备有限公司;HZQ-F100全温振荡培养箱 苏州市培英实验设备有限公司;HC-2000高速多功能粉碎机 永康市天祺盛世工贸有限公司;AL204电子天平 梅特勒-托利多仪器(上海)有限公司;WP-UP-III-20精密型超纯水机 四川沃特尔水处理设备有限公司;N-1300D-WB旋转蒸发仪、CA-1115A冷却水循环泵、A-1000S水流抽气机 埃朗科技(东京理化器械(株)独资工厂);DK-S24型电热恒温水浴锅 上海精宏实验设备有限公司;调速型迷你离心机 生工生物工程(上海)股份有限公司。
1.3 实验方法
1.3.1 不同溶剂提取物的制备
准确称取30.0 g干燥的真姬菇、小菇、菇脚粉末置于三角瓶中,按固液比1∶10(g/mL)加入提取的溶剂于摇床中,在150 r/min,26 ℃条件下,提取12 h,过滤,得到滤液并减压蒸馏回收溶剂(38~55 ℃)[9],在溶剂体积约为10 mL时,得浸膏,用移液管吸出至平皿,于冷冻干燥机中挥干溶剂,称重备用。采用同样的方法,用水、甲醇、正丁醇和丙酮分别进行提取,分别得到物料的对应提取物,每组设置2个重复,计算提取率后于-20 ℃保存备用。
精确称取不同的溶剂提取物0.4 g溶解于10 mL DMSO中,利用超声振荡充分溶解配制成40 mg/mL的样品母液于4 ℃冰箱保存待用。
1.3.2 总酚含量的测定
参考Labuckas D O等[10]的方法对样品中的总酚含量进行测定,采用福林-酚比色法(Folin-Ciocalteu)测定样品中的总酚含量。以没食子酸作为标品进行标准曲线的测定,根据没食子酸浓度(X轴)与OD值(Y轴)绘制标准曲线,所得标准曲线的线性回归方程为:Y=0.1041X-0.0356,R2=0.9992。
1.3.3 抗氧化能力测定
1.3.3.1 样品稀释方法
吸取不同溶剂提取物的母液,用DMSO稀释成20,10,8,6,4,2,1,0.5 mg/L的样品溶液备用。
1.3.3.2 ABTS自由基清除活性测定
配制7 mmol/L的ABTS和4.9 mmol/L的K2S2O8(过硫酸钾)作为储备液,测定时取ABTS储备液和 K2S2O8储备液各10 mL,混匀后于黑暗中放置12~16 h,然后用无水乙醇在734 nm下较准OD值至0.700±0.003,配制成ABTS工作液[11]。加入20 μL不同浓度(0.5~10 mg/mL)的样品溶液在96孔板中,再加入180 μL ABTS工作液,震荡摇匀,避光放置30 min,将96孔板放入酶标仪中在734 nm下测得样品的吸光度(As)。用10 μL DMSO代替样品溶液测得空白吸光度(Ac);用无水乙醇代替ABTS混合液测得样品本底吸光度(Aj);不同浓度分别做3个平行,取其平均值,以Vc做阳性对照,清除率计算公式为:

(1)
最后根据计算出的清除率算出EC50值。
1.3.3.3 DPPH清除自由基能力
用无水乙醇作为溶剂溶解DPPH配制成0.4 mmol/L的溶液,置于棕色瓶中放于阴凉处储藏备用。在96孔板中加入100 μL不同浓度的样品溶液和100 μL 0.2 mmol/L的DPPH。加样完成后置于室温下避光振荡30 min,待充分反应在 517 nm 波长处测得样品的吸光度(As) ;用20 μL DMSO代替体系中的样品溶液测得空白吸光度(Ac) ;用无水乙醇代替体系中的 DPPH溶液测得样品本底吸光度(Aj) ;每种样品的每个浓度分别做3个平行,计算其平均值。以 Vc做阳性对照,按公式(1)计算出其清除率[12]。
1.3.3.4 还原能力测定
取20 μL稀释后不同浓度的DMSO样品溶液于离心管中,再依次加入50 μL磷酸钠缓冲液(0.2 mmol/L,pH 6.6)和50 μL 1% 的K3Fe(CN)6(W/V),50 ℃水浴20 min后,加入20 μL 10%的三氯乙酸终止反应,随后于12000 r/min下离心3 min[13]。取100 μL离心后的上清液和100 μL去离子水充分混合,加入20 μL的0.1% FeCl3,室温孵育15 min,700 nm下测定样品吸光度,吸光值越大,还原力越强。以20 μL DMSO代替样品作为空白,以Vc作为阳性对照,平行测定3次。
1.3.4 数据处理
采用Origin 8.5和SPSS 20.0数据处理软件进行数据统计分析。
2 结果与分析
2.1 不同溶剂对菇脚、小菇、成品菇提取率的影响
不同溶剂对真姬菇菇脚、小菇、成品菇提取率的影响见表1。经不同溶剂提取后,菇脚、小菇、成品菇中不同极性的物质在4种有机萃取剂中的分布趋势保持一致,萃取率为:水萃取物>甲醇萃取物>正丁醇萃取物>丙酮萃取物。根据相似相溶原理,推断样品中的物质成分亲水性较强,易溶解于水。通过对比菇脚、小菇、成品菇不同萃取物的得率可以发现,水与甲醇的萃取率呈现出成品菇>小菇>菇脚,其中菇脚与成品菇差异显著(P<0.01);而正丁醇提取物的萃取率,菇脚与成品菇差异并不显著,但两者显著高于小菇得率(P<0.05)。结果说明真姬菇菇脚中小极性物质的含量与成品菇相似。
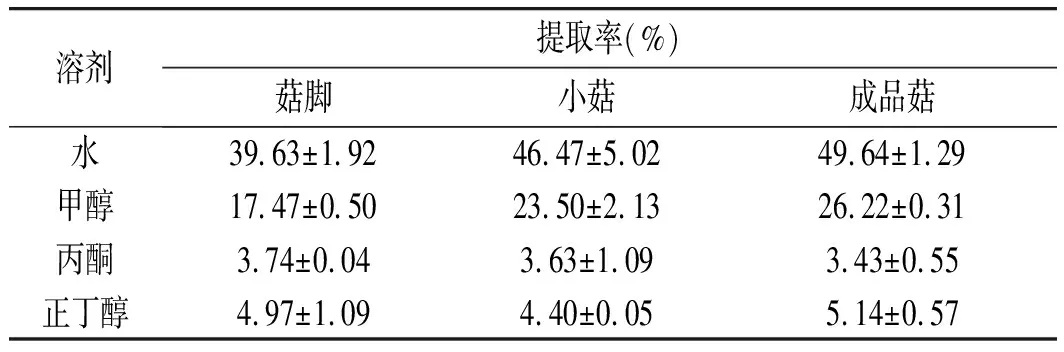
表1 不同溶剂萃取物的提取率Table 1 The extraction rates of various solvent extracts
2.2 真姬菇不同溶剂提取物中总酚含量的测定
真姬菇所含的抗氧化成分中主要是酚类化合物,它们具有良好的抗氧化活性,并且能够与维生素和胡萝卜素等其他抗氧化有效成分同时作用于人体,一起发挥抗氧化功能,有效地清除机体中多种有害的自由基[14]。因此,近年来酚类化合物对人体健康产生的重要影响也受到越来越多研究人员的关注。

表2 不同溶剂提取物的总酚含量Table 2 Total phenol content of various solvent extracts
因为真姬菇中的酚类物质在不同溶剂中具有不同的溶解度,由表2可知,真姬菇菇脚、小菇、成品菇的水提物中总酚的含量最高,分别为1.146,1.447,1.458 mg/g,其次是甲醇、丙酮和正丁醇,随着溶剂极性的减小,总酚得率越来越小,导致这种现象的原因可能是真姬菇总酚的极性较大,亲水性强,易溶解于水。另外,真姬菇成品菇的总酚含量在各溶剂提取物中普遍高于菇脚和小菇,这与各溶剂对真姬菇有效成分的提取率相关性一致。
2.3 真姬菇不同溶剂提取物对ABTS自由基的清除作用
ABTS法是使用最广泛的检测方法之一,它可与过氧化物酶和氢过氧化物在一起形成稳定的蓝绿色ABTS+阳离子自由基,且在734 nm处有一个特征吸收峰[15]。当样品中存在抗氧化成分时,可与ABTS+自由基分子发生反应从而使反应体系褪色,导致溶液的光吸收值下降,其下降程度取决于抗氧化剂的抗氧化能力大小。
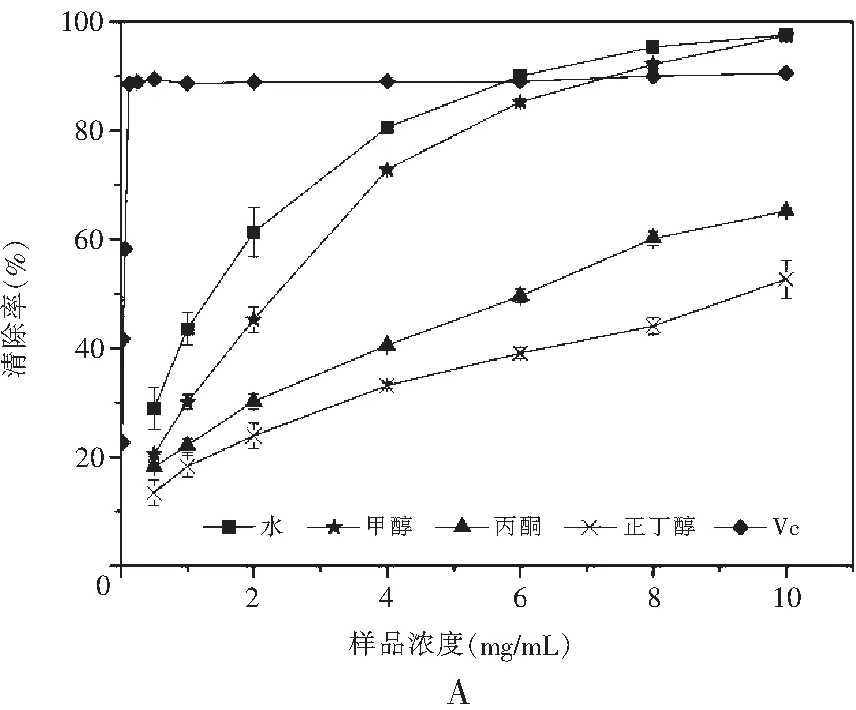
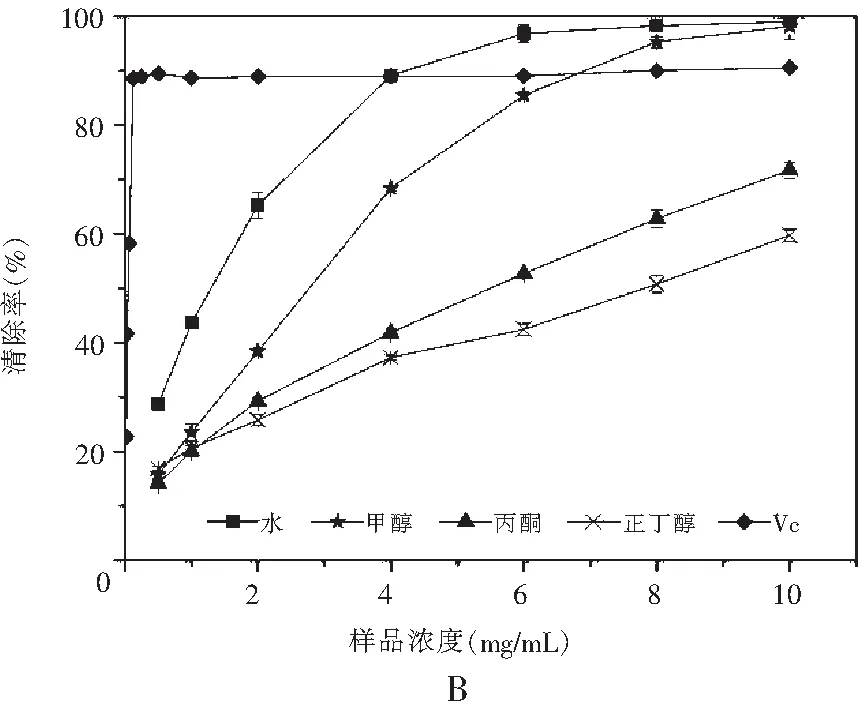
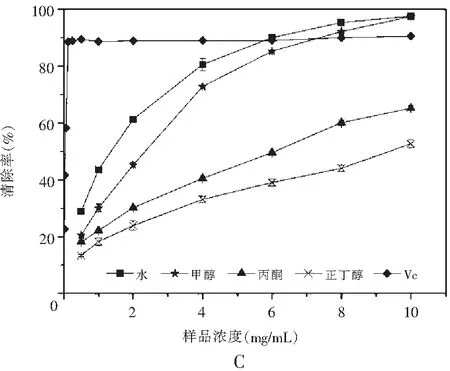
图1 真姬菇各提取物ABTS清除能力Fig.1 ABTS radical scavenging activities of various solvent extracts of Hypsizygus marmoreus
注:A为菇脚,B为小菇,C为成品菇。
之3种样品真姬菇各溶剂提取物对ABTS自由基的清除能力见图1。结果表明样品浓度在2~10 mg/mL范围内,样品对ABTS自由基都具有良好的清除作用,且其清除能力均随着样品溶液浓度的增加而增加。真姬菇菇脚和小菇萃取物清除ABTS自由基能力的趋势为:水>甲醇>丙酮>正丁醇;成品菇各种萃取物清除ABTS自由基能力的趋势为:水>甲醇>正丁醇>丙酮。当浓度达到8 mg/mL时,水提取物和甲醇提取物均能够达到80%以上的清除率,几乎与作为对照的抗氧化剂Vc具有相同的清除ABTS自由基能力。丙酮和正丁醇提取物清除能力则相对较差,但在10 mg/mL的浓度时也能达到60%左右的清除率。说明水和甲醇是提取真姬菇中抗氧化成分的良好溶剂,真姬菇中大极性的物质清除ABTS自由基的能力较强,该结果与总酚含量变化情况保持一致。
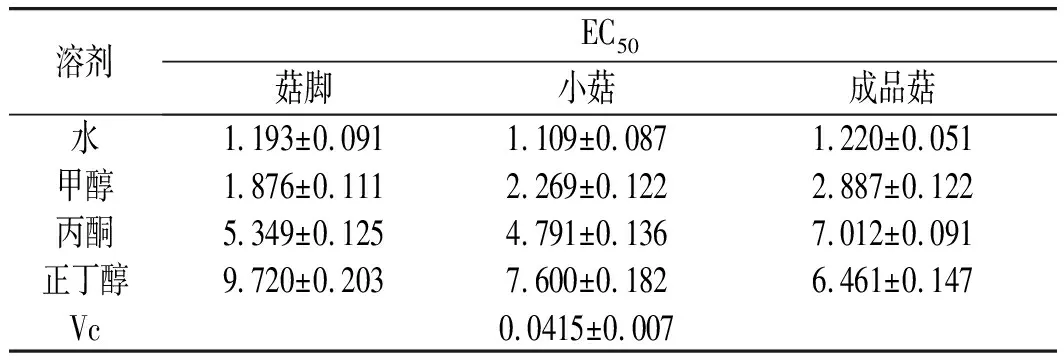
表3 真姬菇提取物ABTS清除能力的EC50值Table 3 EC50 values of ABTS radical scavenging activities of various solvent extracts of Hypsizygus marmoreus
比较真姬菇3种样品清除ABTS自由基的能力可以发现,真姬菇菇脚甲醇提取物的EC50为1.876 mg/mL,与成品菇相比差异极显著(P<0.01);小菇水提物、丙酮的EC50为1.109,4.791 mg/mL,显著高于成品菇与菇脚(P<0.05)。说明当同时以水和甲醇作为溶剂的情况下,菇脚和小菇清除ABTS自由基的能力会优于成品菇。
2.4 真姬菇不同溶剂提取物对DPPH自由基的清除作用
DPPH·是一种稳定的以N为中心的自由基,将其溶解在乙醇溶液中呈深紫色,且在517 nm处有一个特征吸收峰[16]。当反应体系中存在抗氧化成分时,它能与DPPH·的单电子配对从而使517 nm 处的吸收峰消失,且颜色变浅的程度与配对电子数成化学计量关系[17]。
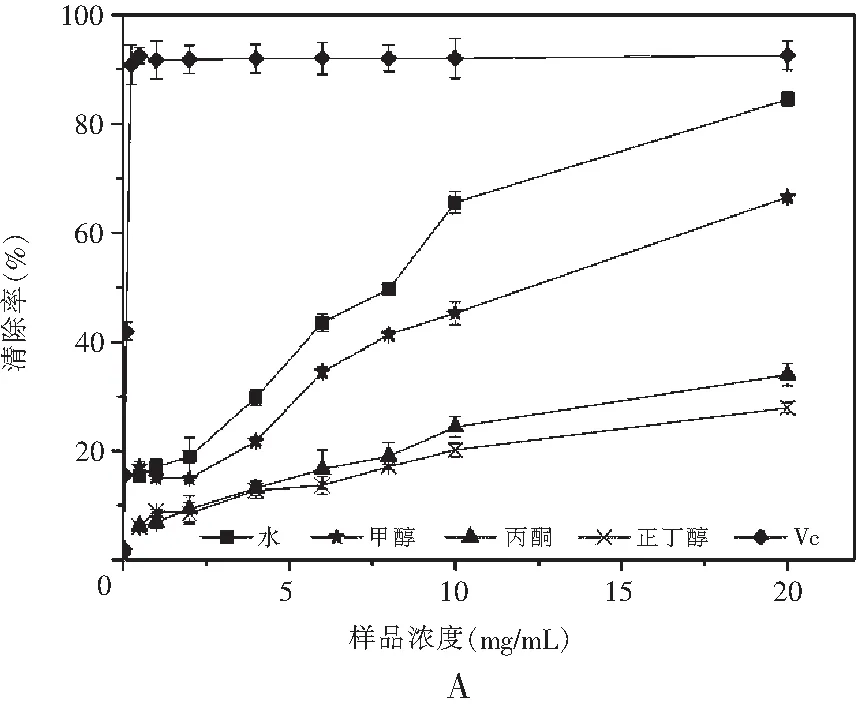
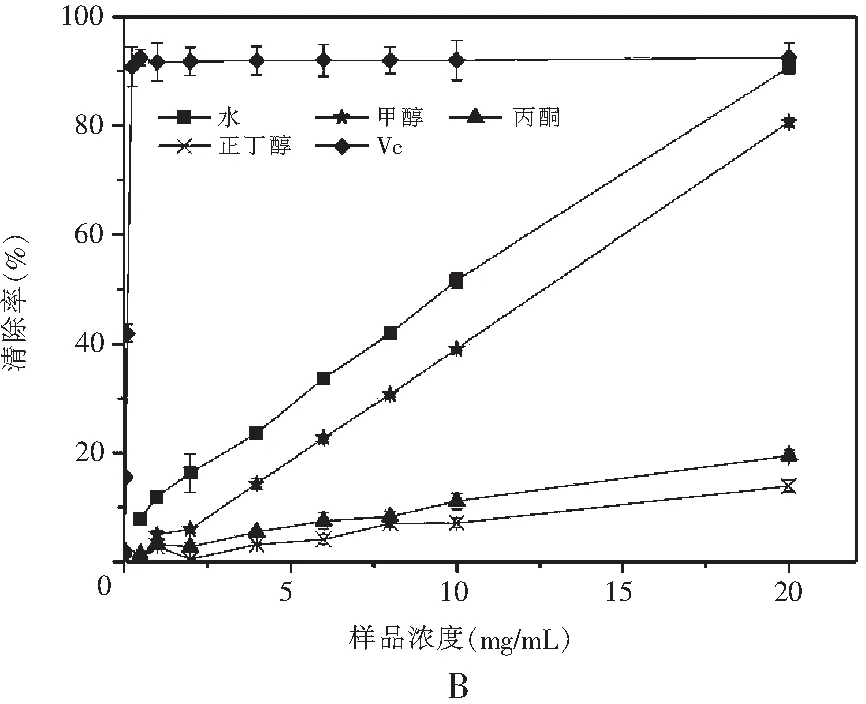
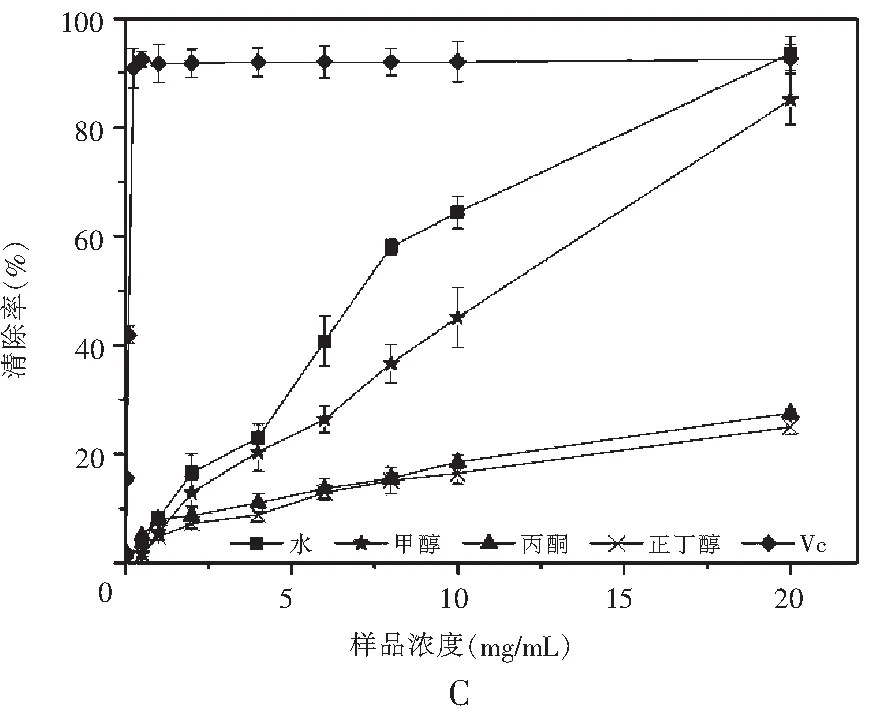
图2 真姬菇各提取物DPPH清除能力Fig.2 DPPH radical scavenging activities of various solvent extracts of Hypsizygus marmoreus
注:A为菇脚,B为小菇,C为成品菇。
由图2可知,在样品质量浓度为0~20 mg/mL范围内,这4种溶剂提取物对DPPH自由基均具有一定的清除能力,它们清除DPPH自由基能力的趋势均为:水提物>甲醇>丙酮≈正丁醇,同时计算得到真姬菇菇脚、小菇、成品菇水提取物的EC50分别为8.854,10.063,8.941 mg/mL,菇脚提取物与成品菇清除DPPH自由基的能力无显著差异;甲醇提取物的EC50分别为11.389,12.598,12.839 mg/mL,成品菇提取物清除DPPH自由基的能力显著高于小菇、菇脚(P<0.05),丙酮和正丁醇提取物在测试浓度范围内未达50%,该结果与ABTS清除自由基实验结果基本保持一致。
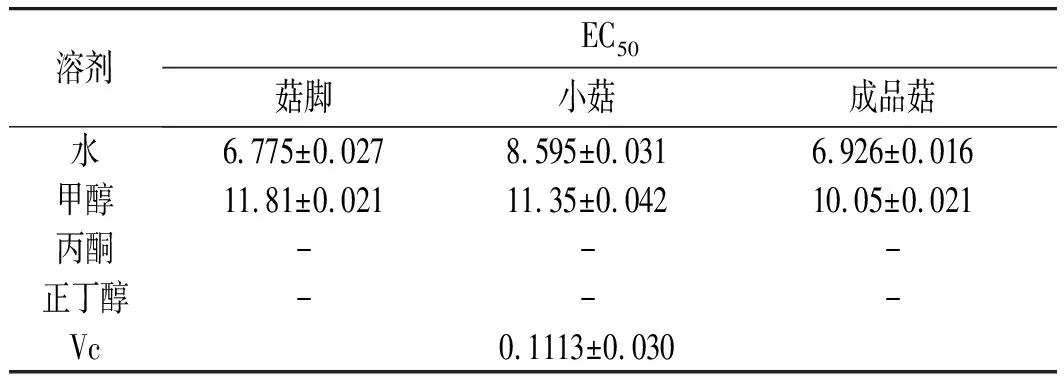
表4 真姬菇提取物DPPH清除能力的EC50值Table 4 EC50 values of DPPH radical scavenging activities of various solvent extracts of Hypsizygus marmoreus
2.5 真姬菇不同溶剂提取物总还原能力的测定
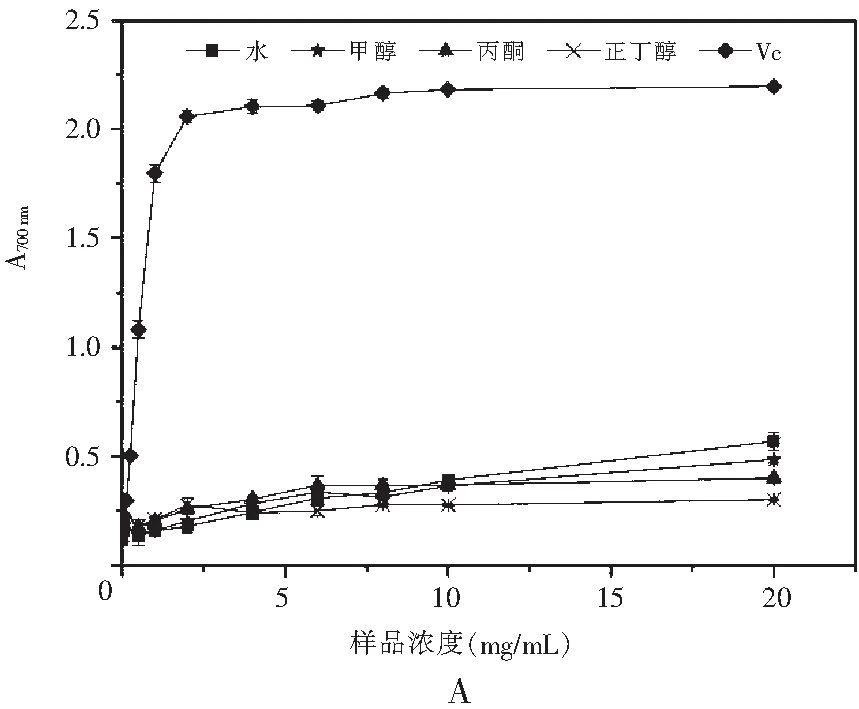
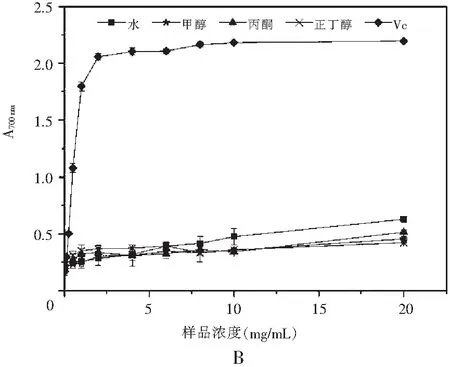
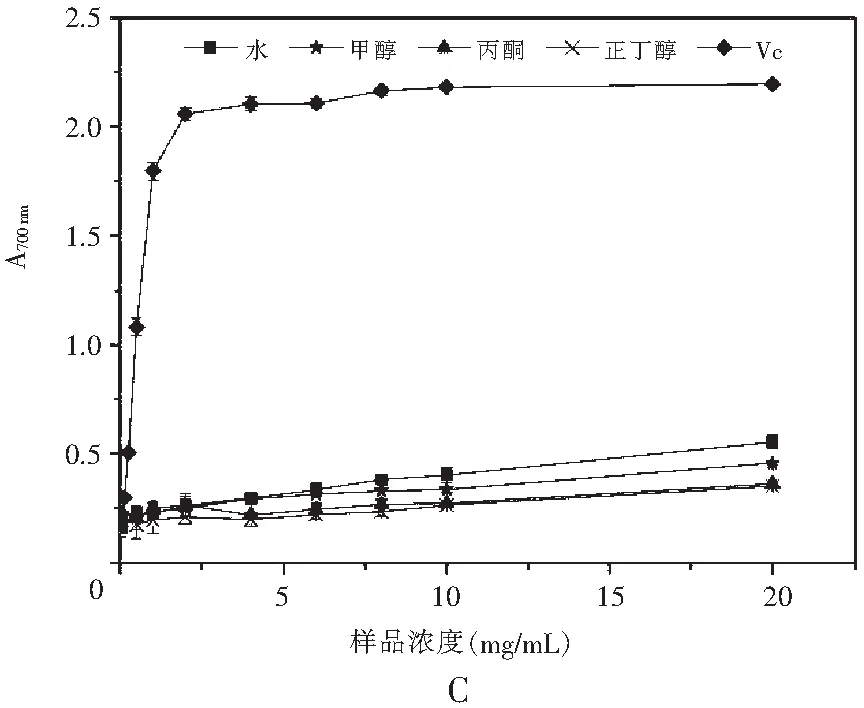
图3 真姬菇大菇各溶剂提取物Fe3+还原能力Fig.3 Fe3+ reduction abilities of various solvent extracts of Hypsizygus marmoreus
注:A为菇脚,B为小菇,C为成品菇。
铁还原法是测定样品还原能力的常用方法,当具有还原能力的还原剂与Fe3+溶液反应时,溶液颜色会由淡黄色变为浅绿色,其吸光值在特定波长范围内会升高,从而可以用吸光值的高低来衡量样品的还原能力,吸光值越高说明样品的还原能力越强[18]。
由图3可知,在本实验选取的浓度范围(0~20 mg/mL)内,反应体系充分混合反应后在700 nm处测得的吸光度会随着样品浓度的增大而不断升高,即样品的还原能力随浓度的增大而不断增强,且上升趋势较为平缓,剂量效应关系明显。当浓度达到20 mg/mL时,4种溶剂的真姬菇提取物反应后得到的吸光度均能达到0.35以上,说明样品均具有一定的还原能力。菇脚、成品菇总还原能力的趋势为:水>甲醇>丙酮>正丁醇;而小菇总还原能力的趋势为:水>甲醇>丙酮>正丁醇。与自由基清除反应相同,真姬菇菇脚、小菇、成品菇水提物的总还原能力最好,浓度达到20 mg/mL时在700 nm的吸光度分别为0.570,0.631,0.553,总还原能力为小菇>菇脚≈成品菇。
2.6 抗氧化活性和总酚含量的相关性
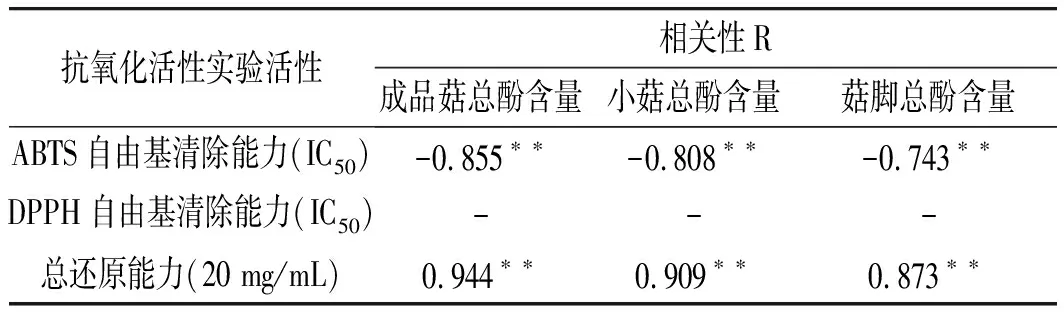
表5 真姬菇抗氧化活性和总酚含量的相关性Table 5 Correlation between antioxidant activity and total phenol content of Hypsizygus marmoreus
注:“**”表示在0.01 水平(双侧)上显著相关。
采用线性回归的方法分析提取物总酚含量与提取物抗氧化活性之间的相关性,真姬菇菇脚、小菇、成品菇总酚含量与ABTS自由基清除能力呈现负相关,其相关系数分别为-0.855,-0.808,-0.743;而与总还原能力的相关系数分别为0.944,0.909,0.873。结果表明总酚含量与清除ABTS自由基能力、总抗氧化活性之间存在显著相关性,说明提取物中发挥抗氧化活性的主要成分之一为总酚。对比菇脚、小菇、成品菇3者间的差异可以发现,相关性系数绝对值逐渐降低,表明各提取物间发挥抗氧化活性的除总酚外,还有非酚类物质,如萜类、多糖、Vc等。由于丙酮、正丁醇提取物DPPH自由基清除能力的EC50值无法测算,故相关性无法计算。有研究表明抗氧化活性及与总酚含量存在一定的相关性,但不同指标间相关性差异较大[19]。本实验中总酚含量与ABTS自由基清除能力呈现出良好的相关性,该结果与以往的研究结果保持一致[20,21]。同时,总酚含量与总还原能力相关系数在0.873~0.944之间,这与Lee Y L等的研究存在差异,他们分析发现真姬菇中的总酚含量与还原力之间不具有相关性,引起该差异的原因可能是不同真姬菇品种及提取方法的差异导致提取物中总酚含量存在差异。
3 结论
本实验采用4种不同溶剂对真姬菇菇脚、小菇和大菇进行提取,并对提取物进行总酚含量的测定,随后采用了ABTS自由基清除实验、DPPH自由基清除实验和Fe3+还原法实验,测定了所有溶剂提取物样品溶液的抗氧化能力。
总体来说,4种溶剂提取物的抗氧化能力大小依次是:水提取物>甲醇提取物>丙酮提取物≈正丁醇提取物。比较3种样品的抗氧化活性可以发现,菇脚及小菇水提物、甲醇提取物清除ABTS自由基和总还原能力均优于成品菇,特别是菇脚、小菇对ABTS自由基的清除能力,当浓度达到8 mg/mL时,水提取物和甲醇提取物均能够达到80%以上的清除率,几乎与作为对照的抗氧化剂Vc具有相同的清除ABTS自由基能力。
以上结论表明,真姬菇菇脚、小菇不同溶剂提取物均具有不同程度的抗氧化能力,尤其是水提物与甲醇提取物。本实验不仅为真姬菇生产废料的综合利用,更为新型天然抗氧化剂的寻找提供了新的可能。
