苦荞黄酮提取方法的研究及含量测定分析
2019-03-18孙亚利周文美赵天明李向东王小平
孙亚利,周文美*,赵天明,李向东,王小平
(1.贵州大学 酿酒与食品工程学院 发酵工程与生物制药省重点实验室,贵阳 550025;2.贵州大学 酿酒与食品工程学院,贵阳 550025;3.贵州理工学院食品药品制造工程学院,贵阳 550025)
苦荞麦,别名菠麦、花荞等,起源于我国西南部,栽培于我国东北、内蒙、河北、山西、陕西、甘肃、青海、四川、云南等地,亚洲、欧洲和北美也有栽培[1,2]。
苦荞麦有“五谷之王”的美称,是药食两用的良药佳肴。《本草纲目》记载:“苦荞味苦,性平寒,能实肠胃,益气力,续精神,利耳目,炼五脏渣秽”[3]。苦荞麦富含黄酮、氨基酸、膳食纤维、多糖、多酚等活性成分,其中黄酮类化合物具有显著的抗氧化功效,可以防治多种慢性疾病,在食品加工中广泛用于各种糕点、调味食品、保健食品等的生产,深受人们的喜爱[4-8]。
闫斐艳[9]、王廷璞等[10]、李朋等[11]曾分别采用热水浸提、乙醇提取、索氏提取等方法对苦荞总黄酮含量进行了探究,综合分析可得:热水浸提法得率最低,为0.44%,且产物纯度低,不易保存;乙醇提取法耗时太长,不利于高效作业;索氏提取法最优提取率为1.462%,但其适用规模太小,无法投入生产,相比而言,超声和微波提取法利用机械效应、空化效应、热效应和电磁场作用[12,13],可有效辅助乙醇浸提法,实现生物有效成分的快速分离。本实验以贵州苦荞为研究对象,对超声波和微波辅助醇提法提取苦荞麦总黄酮的工艺条件进行了优化,探讨了苦荞麦中黄酮类化合物的提取和测定方法,以期为苦荞麦黄酮类化合物的进一步研究、开发和利用提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
苦荞麦:2017年9月采集于贵州省贵阳市白云区;芸香苷标准物质:贵州迪大生物科技有限责任公司;无水乙醇、三氯化铝、乙酸钾(均为分析纯):天津市富宇精细化工有限公司;甲醇、磷酸(均为色谱纯):天津市科密欧化学试剂有限责任公司。
101-1型电热鼓风干燥箱 北京科伟永兴仪器有限公司;AL104电子天平 梅特勒-托利多仪器(上海)有限公司;HC-280T2高速多功能粉碎机 永康市绿可食品机械有限公司;PS-100A超声波清洗器 东莞市洁康超声设备有限公司;ORW2S-5H微波设备 南京澳润微波科技有限公司;岛津UV-2550紫外可见分光光度计 厦门仪宸科技有限公司;Agilent 1260 Infinity LC高效液相色谱仪 安捷伦科技有限公司。
1.2 实验方法
1.2.1 芸香苷标准曲线的绘制
按李欣等的AlCl3法[14],测定吸光度,以吸光度为横坐标、芸香苷质量浓度(mg/mL)为纵坐标绘制标准曲线,得回归方程y=0.0292x+1.2738E-5,r=0.99956。
1.2.2 苦荞麦中总黄酮的制备
样品的前处理:将苦荞麦置于45℃烘箱中,烘干过夜,取出适量于粉碎机中粉碎,过100目筛,放入自封袋中,备用。
超声提取法:准确称取1g苦荞麦粉末,与一定量乙醇混合,在不同提取温度下,超声波功率500W,持续一段时间后;4℃、5000r/min离心15min,取上清液经0.45μm滤膜过滤得到总黄酮提取液。
微波提取法:准确称取1g苦荞麦粉末,与一定量乙醇混合,微波功率300W,持续一段时间后;4℃、5000r/min离心15min,取上清液经0.45μm滤膜过滤得到总黄酮提取液。
在较低温度超声提取时,应注意循环换水,以防因机器工作造成温度升高;微波提取时,要注意调节冷凝水的流速,防止提取液喷出;应小心缓慢取出离心管中上清液,避免有沉淀倒出。
1.2.3 苦荞麦中总黄酮含量的测定
取1mL样品待测液于10mL容量瓶中,用AlCl3法测其吸光度,计算苦荞麦中总黄酮的含量。根据回归方程求得相应苦荞黄酮浓度,按下式计算总黄酮得率:

1.2.4 HPLC色谱条件[15-19]
色谱柱:Agilent TC C18(4.6mm×250mm,5μm);流动相:甲醇-0.3%磷酸溶液(47∶53,V/V);柱温:30℃;检测波长:257nm;流速:1.0mL/min;进样量:10μL。重复6次。
1.2.5 苦荞芸香苷HPLC分析
芸香苷对照品溶液的制备:准确称取芸香苷0.010g,用色谱级甲醇定容至10mL容量瓶中,摇匀,制成1mg/mL芸香苷对照品贮备液。准确称取苦荞麦粉1g,根据1.2.2待测液的制备方法处理,离心,取1.5mL上清液,0.22μm滤膜过滤备用。本实验于2018年5月~6月,分别在贵州大学和贵阳理工学院完成。
1.3 实验设计
分别考察了乙醇质量分数、料液比、超声时间、微波时间及超声温度对苦荞黄酮得率的影响,采用L9(34)正交设计,确定超声波辅助醇提法和微波辅助醇提法的最佳工艺参数,并对这2种方法进行分析比较。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇质量分数对苦荞总黄酮得率的影响
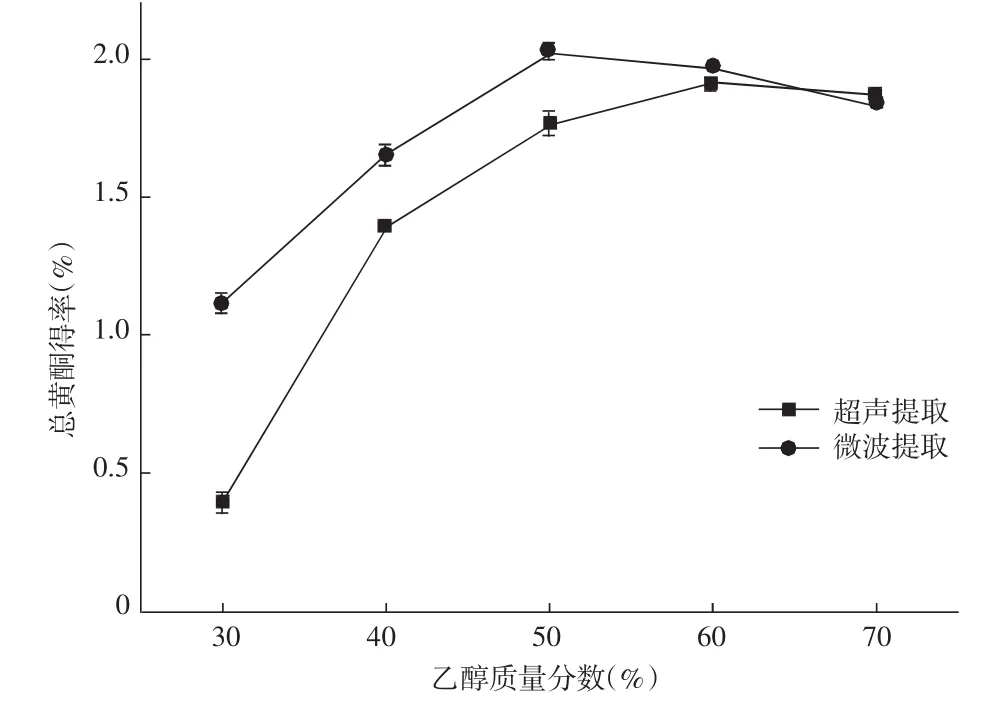
图1 乙醇质量分数对苦荞黄酮得率的影响Fig.1 Effect of ethanol mass fraction on the yield of tartary buckwheat flavonoids
由图1可知,随着乙醇质量分数的提高,苦荞总黄酮得率先增加后减少,当乙醇浓度达到60%和50%时,超声、微波提取总黄酮得率最高,继续增加乙醇浓度,总黄酮得率下降,可能是其他醇溶性杂质、色素等溶出,造成黄酮溶解度降低,得率减小[20]。故超声提取、微波提取的最佳乙醇浓度分别为60%和50%。
2.1.2 料液比对苦荞总黄酮得率的影响
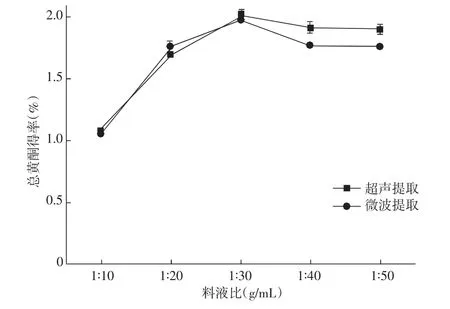
图2 料液比对苦荞总黄酮得率的影响Fig.2 Effect of ratio of material to liquid on the yield of total flavonoids in tartary buckwheat
由图2可知,随着料液比的减小,总黄酮得率先增加后减少;当料液比达到1∶30时,总黄酮得率最高,其主要原因可能是料液比大时不能使苦荞黄酮充分溶解,料液比小时苦荞黄酮浓度过小,进而影响总黄酮得率。综上,在超声提取和微波提取实验中,最佳料液比均为1∶30。
2.1.3 提取时间对苦荞总黄酮得率的影响
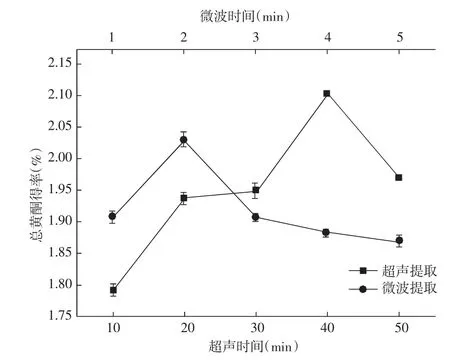
图3 超声时间和微波时间对苦荞总黄酮得率的影响Fig.3 Effect of ultrasonic time and microwave time on the yield of total flavonoids in tartary buckwheat
由图3可知,随着提取时间增加,总黄酮得率先增加后减少;当超声时间、微波时间分别为40,2min时,总黄酮得率最高;继续延长提取时间不利于得率的提升。可能是由于提取时间增加,热量聚集,造成黄酮结构改变,得率减小。综上,确定超声、微波提取最佳时间分别为40min和2min。
2.1.4 超声温度对苦荞总黄酮得率的影响
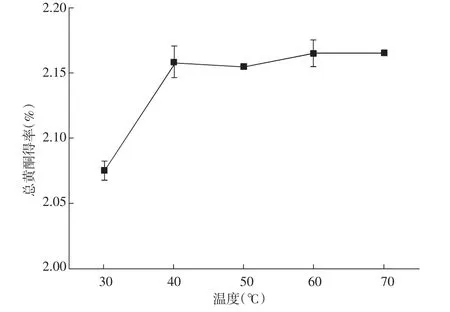
图4 温度对苦荞总黄酮得率的影响Fig.4 Effect of temperature on the yield of total flavonoids in tartary buckwheat
由图4可知,提取温度在40℃内,苦荞黄酮溶解度随温度的升高而增大;超过40℃后,黄酮得率变化不显著(p>0.05),这可能是因为当温度过高时,蛋白质析出,造成黏度增大,进而影响了黄酮物质的析出。因此选择40℃为最佳超声提取温度。
2.2 正交试验结果
2.2.1 超声波辅助醇提法
在单因素试验的基础上,选择乙醇质量分数、料液比、温度、时间4个因素,采用L9(34)正交试验考察各因素对苦荞黄酮提取效果的影响,确定超声提取的最佳工艺,并对结果进行方差分析和显著性检验,正交试验结果见表1,方差分析见表2。
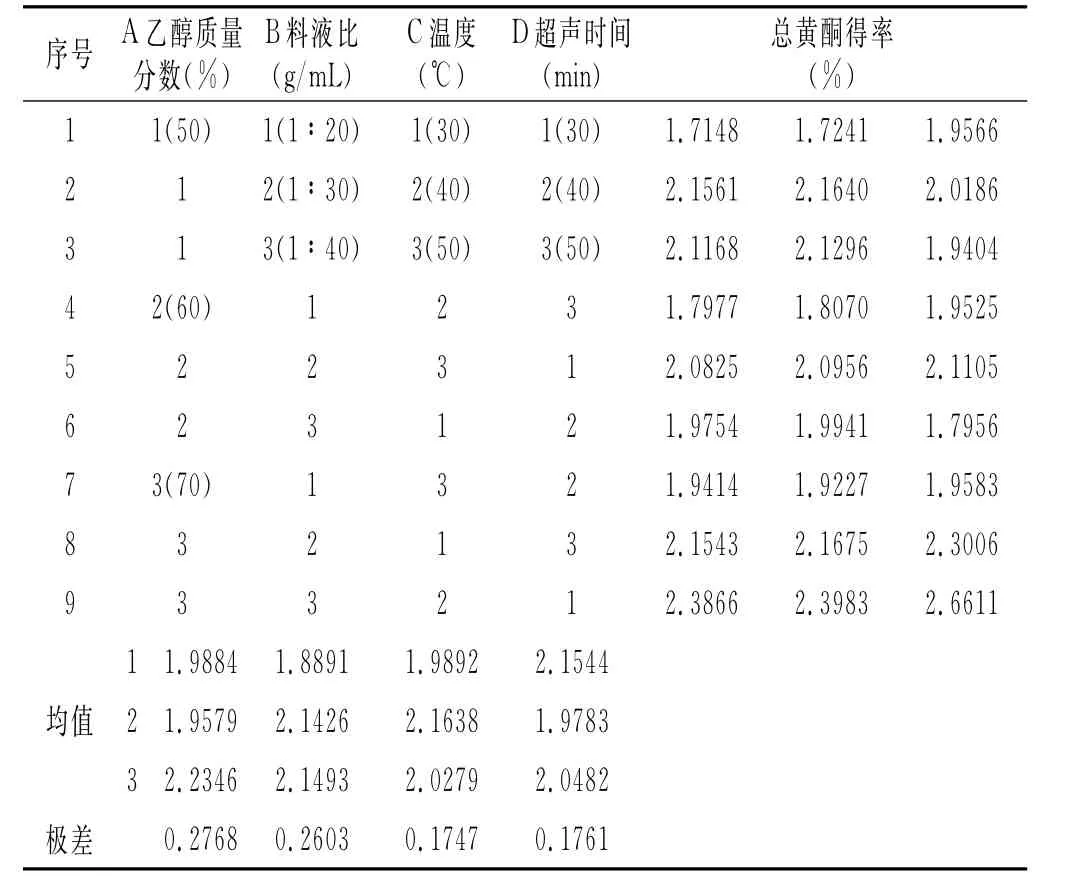
表1 超声提取正交试验结果Table1 Ultrasonic extraction orthogonal test results
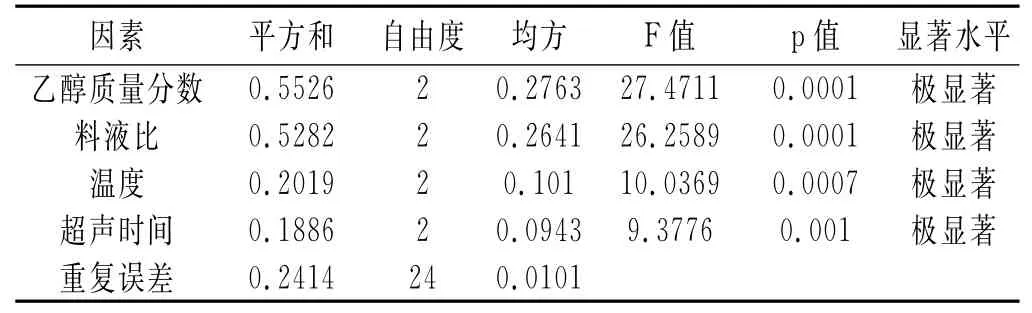
表2 超声提取正交试验方差分析Table2 Analysis of variance of ultrasonic extraction orthogonal test
由表1和表2可知,4个因素均对总黄酮得率有极显著影响,各因素对总黄酮得率影响的程度为:乙醇质量分数>料液比>提取时间>提取温度,超声提取的最优,工艺为A3B2C2D1,即乙醇质量分数为70%,料液比为1∶30,提取时间为30min,提取温度为40℃,平均得率为2.35%。
2.2.2 微波辅助醇提法
在单因素试验的基础上,选择乙醇质量分数、料液比、时间3个因素,采用L9(34)正交试验考察各因素对苦荞黄酮提取效果的影响,确定微波提取的最佳工艺,并对结果进行方差分析和显著性检验,正交试验结果见表3,方差分析见表4。
银行贷款方面,虽然目前我国很多银行都有了自己的小额信贷部门,但从小微企业通过银行贷款融资的过程和结果看,依然很受“歧视”。原因包括:
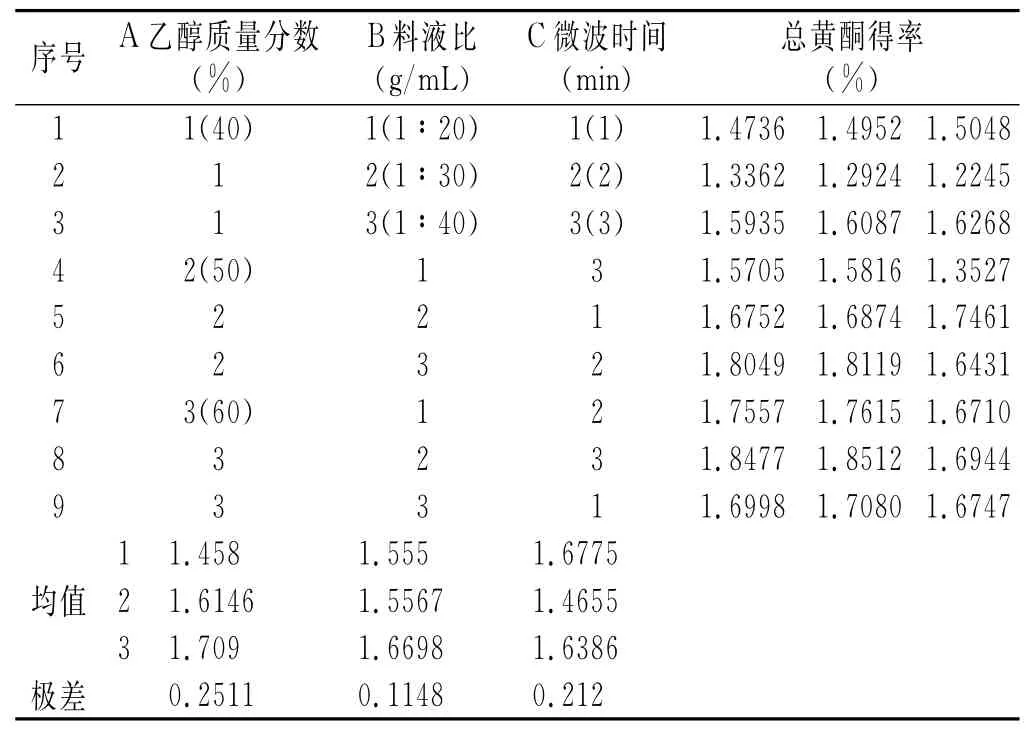
表3 微波提取正交试验结果Table3 Microwave extraction orthogonal test results
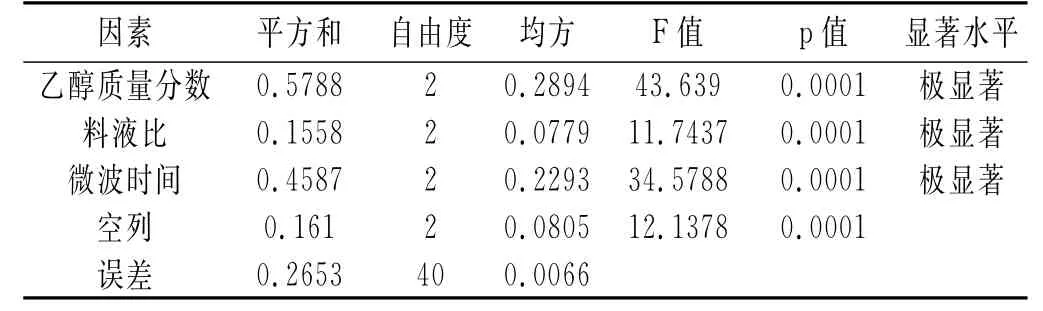
表4 微波提取正交试验方差分析Table4 Analysis of variance of microwave extraction orthogonal test
由表3和表4可知,3个因素均对总黄酮得率有极显著影响,影响程度为:乙醇质量分数>提取时间>料液比,微波提取最优工艺为A3B3C1,即乙醇质量分数为60%,提取时间为1min,料液比为1∶40,平均得率为2.47%。
通过正交试验结果分析可得,微波提取总量高于超声提取,且差异显著(p<0.05),而且微波提取大大节省了时间。
2.3 苦荞总黄酮含量的测定
2.3.1 精密度试验
按1.2.2节制备苦荞黄酮样品液,按1.2.3节测定吸光度,连续测定6次,得精密度为1.13%,精密度试验符合要求。
2.3.2 稳定性试验
按1.2.2节制备苦荞黄酮样品液,按1.2.3节分别于15,30,45,60,75,90min测定吸光度,结果见表5。
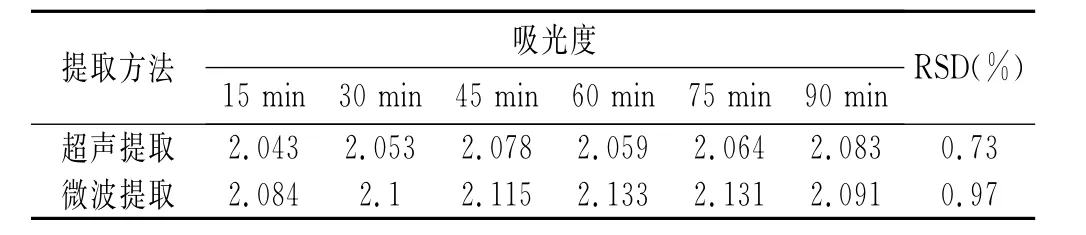
表5 总黄酮稳定性试验Table5 The stability test of total flavonoids
超声提取与微波提取的RSD分别为0.73%和0.97%,即2种提取法在90min内总黄酮量基本不变,稳定性良好,符合试验要求。
2.3.3 重现性试验
按1.2.2节制备苦荞黄酮样品液,按1.2.3节测定吸光度,结果见表6。

表6 总黄酮重现性试验Table6 The reproducibility test of total flavonoids
超声提取与微波提取的RSD分别为1.31%和1.46%,重现性良好,符合试验要求。
2.3.4 回收率试验
精确称取苦荞麦粉1.0g,用于超声提取和微波提取的样品中分别加入40mL乙醇和1mL芸香苷标准品溶液(质量浓度为1.6mg/mL)。按上述超声提取和微波提取的最优工艺条件制备各样品溶液,重复5次,计算总黄酮得率,确定回收率,结果见表7。平均回收率分别为103.06%和101.11%,符合试验要求,两者回收率差异不显著(p>0.05)。
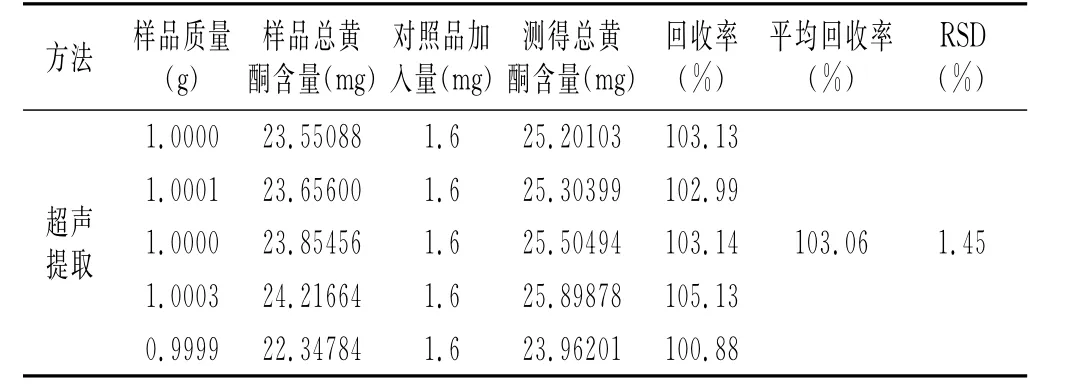
表7 总黄酮回收率Table7 The recovery of total flavonoids
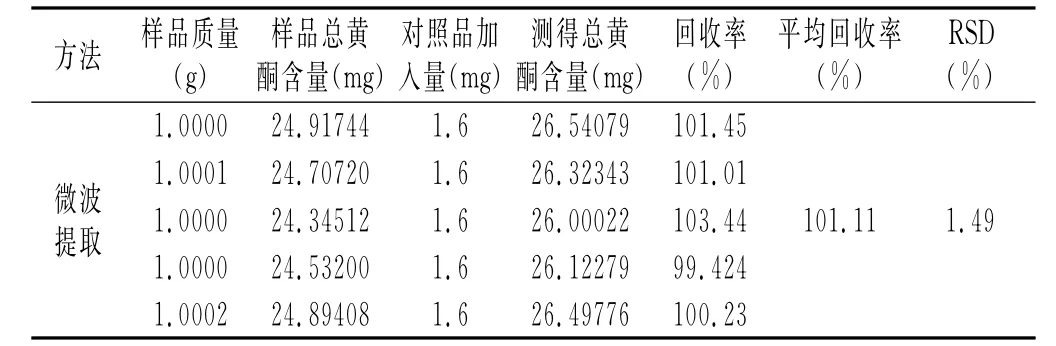
续 表
2.4 芸香苷的HPLC含量测定结果
2.4.1 芸香苷标准曲线的制作
以芸香苷进样量(μg/mL)为横坐标、峰面积为纵坐标绘制芸香苷标准曲线,得线性回归方程为y=1607.32848x-1.0414,r=0.99998,芸香苷含量在1~20μg/mL范围内呈线性关系,见图5和图6。
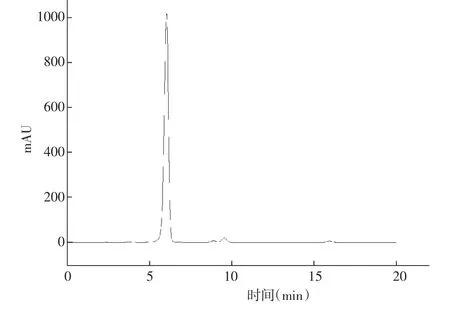
图5 芸香苷标准品色谱图Fig.5 Chromatogram of rutin standard
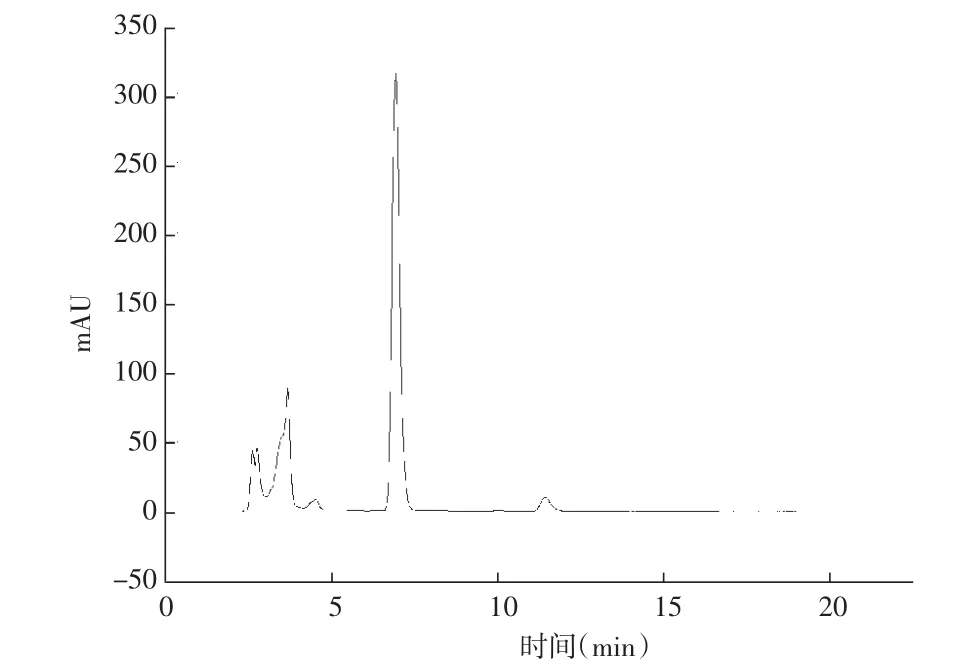
图6 样品色谱图Fig.6 Chromatogram of the sample
2.4.2 精密度试验
按1.2.2节制备苦荞黄酮样品液,连续进样6次,按1.2.4节测定芸香苷含量,得精密度为1.05%,精密度良好,符合试验要求。
2.4.3 稳定性试验
按1.2.2节制备苦荞黄酮样品液,每隔1h进样10μL,按1.2.4节测定芸香苷含量,结果见表8。超声提取与微波提取的RSD分别为1.32%和1.31%。即2种提取法在6h内芸香苷含量基本不变,稳定性良好,符合试验要求。

表8 芸香苷稳定性试验Table8 The stability test of rutin
2.4.4 重现性试验
按1.2.2节制备苦荞黄酮样品液,平行6次,按1.2.4节测定芸香苷含量,结果见表9。超声提取与微波提取芸香苷含量分别为1.141%和1.193%,RSD分别为1.43%和1.13%,重现性良好,符合试验要求。
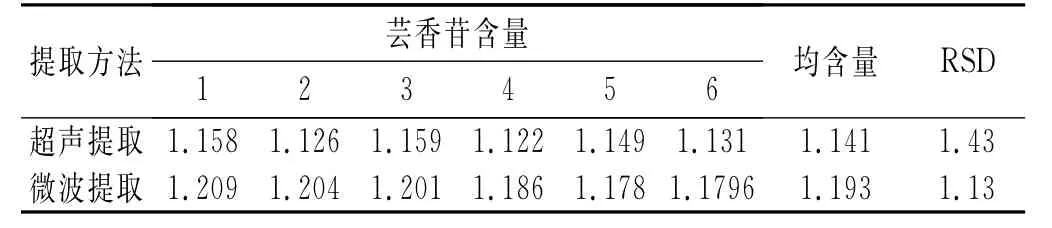
表9 芸香苷重现性试验Table9 The reproducibility test of rutin%
2.4.5 回收率试验
按2.4.4节制备回收率试验样品,依据1.2.4节测定芸香苷含量,确定回收率,结果见表10。平均回收率分别为103.61%和100.16%,两者回收率接近,微波的效果略好于超声波,且差异显著(p<0.05)。
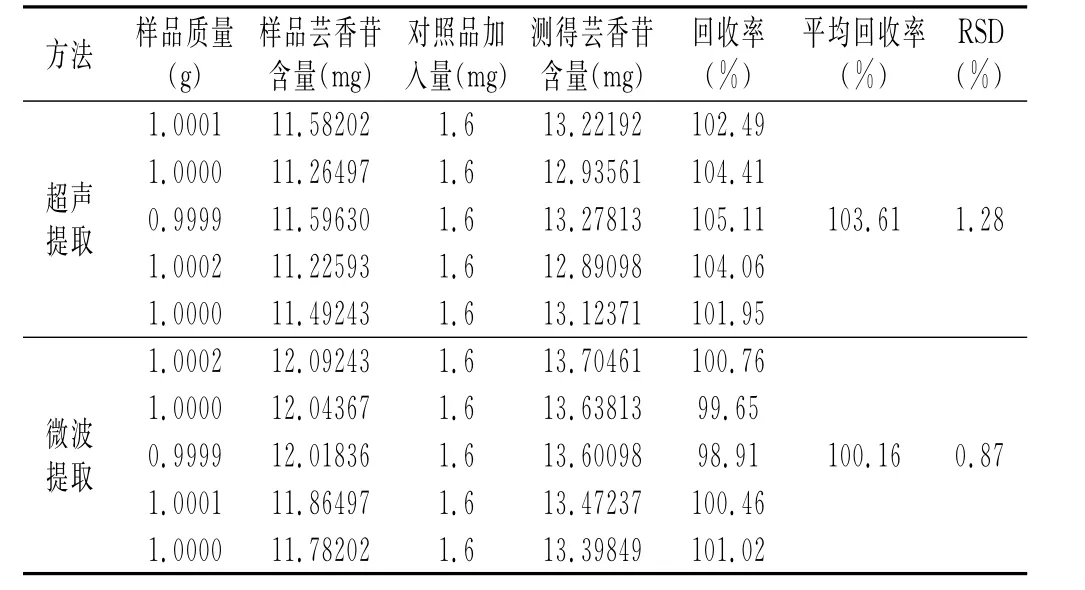
表10 芸香苷回收率Table10 The recovery of rutin
3 结论
由正交结果及方差分析可知,超声提取苦荞总黄酮的最优工艺为乙醇质量分数70%、料液比1∶30、提取时间30min、提取温度40℃,影响程度为:乙醇质量分数>料液比>提取时间>提取温度,4个因素均对总黄酮得率有极显著影响。微波提取最优参数为:乙醇质量分数60%、提取时间1min、料液比1∶40,影响主次为:乙醇质量分数>提取时间>料液比,均对总黄酮得率有极显著影响。
超声波辅助醇提法与微波辅助醇提法相比,微波提取黄酮得率更高,而且微波辅助醇提法 大大减少了生产周期,提高了产品得率。
采用HPLC法测定苦荞芸香苷含量,结果表明:超声提取芸香苷含量为1.141%,微波提取芸香苷含量为1.193%。微波提取效果优于超声提取,差异显著(p<0.05)。
