Kokumi肽及其受体的研究进展
2019-03-18伍伦杰伍圆明孙伟峰马力丁文武
伍伦杰,伍圆明,孙伟峰,马力,丁文武*
(1.西华大学 食品与生物工程学院,成都 610039;2.衡阳师范学院生命科学与环境学院,湖南 衡阳 421008)
在当前不断追求幸福感的生活模式下,单一味感的调味品已经难以满足消费者的需求,人们对于调味品的持续、浓厚、圆润、平衡协调感的关注度逐步提升,1990年,日本科学家将这类复杂的味觉感受首次定义为“kokumi”[1]。通常,kokumi物质本身不具有味道活性或味道活性较弱,但可通过与钙敏感受体(Calcium-sensing Receptor,CaSR)相互作用调节味觉受体到大脑神经系统的信号转导来增强食物的整体味觉感受,并呈现延渗、持久、饱满等的味道特征[2,3]。目前已报道的kokumi物质主要包括取代氨基酸类、取代吡啶类、低聚肽类等,其中kokumi肽类研究较为广泛[4],且近年来已逐渐成为食品风味研究领域的一个热点。本文主要综述了kokumi肽的来源、序列特征、检测方式、酶合成方法、在食品中的应用及其受体识别机制的研究现状。以期通过本文的综合论述,加深对kokumi肽从上游呈味机制到下游开发应用的系统认识及理解,为kokumi味的具体识别机制研究及kokumi肽的进一步挖掘、改造、应用提供一定的参考。
1 Kokumi肽的来源
食物中的滋味具有多样性的特点,具有明显特征的酸味、甜味、咸味、苦味、鲜味被逐步从中分离出来,而呈味特征较复杂且模糊的kokumi味感研究较晚。20世纪90年代,日本科学家Ueda等在研究大蒜和洋葱提取物的调味作用时,发现它们具有连续性、满口感、浓厚感的呈味特征,首次将此风味特征定义为kokumi,且经鉴定发现产生这类特征风味的关键物质主要为一系列含硫化合物,如S-烯丙基-半胱氨酸亚砜(蒜氨酸),(+)-S-甲基-L-半胱氨酸亚砜和γ-L-谷氨酰基-S-烯丙基-L-半胱氨酸[5]。随后,法国学者于1994年提出从Comté奶酪的水溶性级分中分离出3种具有复杂、浓郁味感的γ-谷氨酰肽[6]。1997年,Ueda等指出γ-谷胱甘肽(γ-L-Glu-L-Cys-Gly,GSH)是一种典型的kokumi肽,它单独溶于水中基本上是没有味道的或者味道很淡,但少量添加就可以显著降低鲜味物质如谷氨酸钠(MSG)、肌苷酸(IMP)的阈值,增加鲜味溶液中的连续性、口感和厚度,至今GSH已发展成为一种常用的食品添加剂[7-9]。
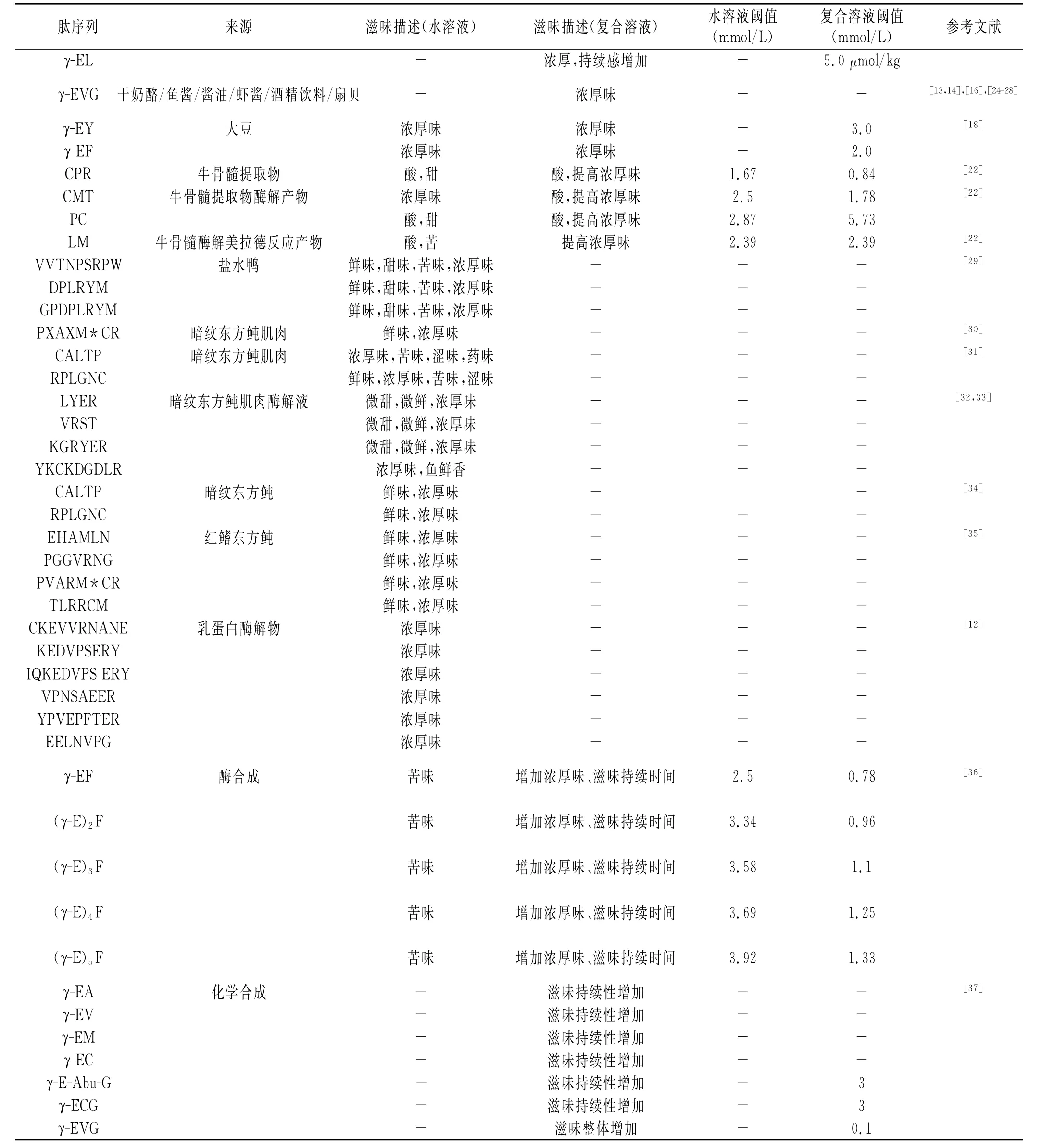
继GSH之后,近年来kokumi肽的种类不断被补充,包括γ-谷氨酰肽类以及一些低分子肽类等[10,11],主要来源于菜豆、扇贝、酒精饮料、发酵酱类、肉类和乳制品等风味食品中,其具体序列信息见表1。
2007年,Dunkel等从菜豆中发现3种γ-谷氨酰肽(γ-Glu-Leu,γ-Glu-Val和 γ-Glu-Cys-β-Ala),这 些肽具有轻微的收敛感,阈值在3.3~9.4mmol/L之间,对菜豆风味具有关键作用。2009年,Toelstede等也从成熟Gouda奶酪中鉴定出10种具有kokumi味的γ-L-谷氨酰二肽,这些肽的存在增强了奶酪的口感复杂性和味道连续性。2010年,王蓓等从乳蛋白酶水解物中分离鉴定出6种符合kokumi肽序列特征的多肽段,认为这些肽段可能对乳制品的kokumi风味具有一定贡献作用[12]。2012年,Kuroda等在生扇贝、加工扇贝产品以及各国的商业鱼酱中皆检测到kokumi肽γ-Glu-Val-Gly的存在[13-15],随后,在啤酒、酒精饮料、酱油等发酵产品中检测到了这类kokumi肽[16,17]。近年来,Shibata等对大豆种子水提取物的呈味物质进行了分析,发现γ-Glu-Tyr、γ-Glu-phe、棉子糖和水苏糖是大豆种子水提取物的醇厚味组分,它们在碱性条件下作用阈值较低,其中2种γ-谷氨酰肽是负责浓厚味的主要组分,2种寡糖主要负责补充增强γ-谷氨酰肽的味道[18,19]。
由于kokumi物质味感的复杂性,感官判定标准较为模糊,除上述较明确的kokumi肽以外,还有一系列潜在的kokumi肽也逐步被报道。Dunkel等曾从鸡汤中分离鉴定出3种本身具有微弱酸味和涩味的β型丙氨酰肽,但它们可与谷氨酸、氯化钠或氯化钾协同增强家禽类白肉的特征风味[20]。另有研究表明,部分发酵食品中的γ-谷氨酰肽经美拉德反应后,可促进发酵食品的浓厚感[21]。此外,在牛骨髓提取物及其美拉德反应产物中也发现了kokumi活性成分,在其水解物中发现8种鲜味和浓厚味寡肽,经美拉德反应后发现12条肽,其中有3条肽可导致空白牛肉汤的浓厚味明显增强[22]。

表1 Kokumi肽的序列来源和呈味信息Table1 The source of kokumi peptide sequence and its taste information
续 表
2 Kokumi肽序列结构特征
Kokumi肽的呈味效果与其分子量和结构密切相关[38],通过总结 kokumi肽相关研究发现,具有kokumi活性的肽一般具有以下特征:第一,kokumi肽分子量较小,如在酵母提取物的kokumi物质研究中,发现具有复杂、浓厚、连续性口感的kokumi滋味物质主要是分子量<1000u的寡肽[39]。另一项研究也表明多数kokumi活性较高的肽通常为分子量小于500Da的二肽或三肽。第二,kokumi肽的氨基酸组成及排列也具有一定的规律。Kokumi肽组分一般为N末端具有γ-L-谷氨酰残基的γ-谷氨酰肽,通过研究其与CaSR的相互作用发现,在具有高呈味活性的γ-谷氨酰肽结构中,当其第2个残基处为L-构型的中小型脂族、中性或非极性取代基时,如:Val、α-allylglycine、O-(methyl)-serine和tert-leucine等,γ-谷氨酰肽与受体的结合增强,呈味活性更高[40,41],当存在具有 C-末端游离羧基且没有侧链(如Gly)的第3个残基时,可进一步显著增强肽的kokumi活性。另有研究发现,含硫化合物具有增强食物kokumi味的作用,如含有Cys的肽段具有更强烈的浓厚感和更低的呈味阈值,主要是由其氨基酸侧链基团上的-SH在舌尖上产生的轻微收敛感引起的[42]。第三,kokumi肽味的强弱也与其官能团位置相关,如在奶酪中的γ-谷氨酰肽具有明显的浓厚味,而相同氨基酸序列的α-谷氨酰肽却没有浓厚味。除上述特征外,还发现在部分kokumi肽中存在疏水性苦味氨基酸 Arg、Leu、Gly和Pro等[43],但这些肽在低浓度条件下并没有苦味,反而呈现出浓厚、持久、绵延的kokumi风味特性,这表明疏水性氨基酸对kokumi肽的呈味效果具有一定影响[44]。
3 Kokumi味觉受体——CaSR
3.1 CaSR结构特征
早期研究表明5种基本滋味可以被特异性受体识别,其中苦味受体为T2Rs受体家族,甜味受体是异二聚体T1R2/T1R3,鲜味受体是异二聚体T1R1/T1R3,而咸味受体和酸味受体的最佳候选分别为上皮Na+通道(ENaCs)和瞬时受体电位家族成员PKD1L3及PKD2L1[45-54]。对于继五味后的第六味候选者——kokumi,日本学者研究发现添加浓厚感肽可以激活CaSR并增强基本口味的味觉强度,证明CaSR是kokumi物质的主要检测器并参与人类浓厚味觉的感知[55]。
CaSR定位于细胞的表面膜中,不仅在味觉细胞中表达[56],也在许多其他组织中表达,例如甲状旁腺、胃肠道、肾脏及中枢神经系统等[57-60]。CaSR属于G蛋白偶联受体(G-protein Coupled Receptors,GPCR)C家族,人源 CaSR(NCBI:NP_000379.2)由1078个氨基酸组成,其结构主要由3个部分构成(见图1中a):即大的N末端Venus Flytrap结构域(VFTD)、小的胞外富含半胱氨酸的结构域(CRD)和七螺旋跨膜结构域(TMD)[61]。与其他C类GPCR味觉受体一样,CaSR的识别配体的关键位点存在于VFTD中[62,63],两项独立的 实 验 表 明,VFTD 中 的 残 基 Ser-147、Ser-170、Asp-190、Tyr-218和Glu-297对CaSR识别Ca2+至关重要[64,65]。另外,Yong等人基于蛋白结晶数据则指出激动剂结合可诱导CaSR产生较大的构象变化:当受体没有结合配体时(无活性,见图1中b),其VFTD的两叶片呈现开放状态,且loop环游离在VFTD的外围;而当受体与配体结合时(有活性,见图1中c),VFTD的两叶片呈闭合状态,loop环紧贴在VFTD缝隙。综上,关于CaSR分子结构信息的研究将有助于理解包括浓厚感肽在内的kokumi物质如何被受体识别并提高呈味强度的分子机制。
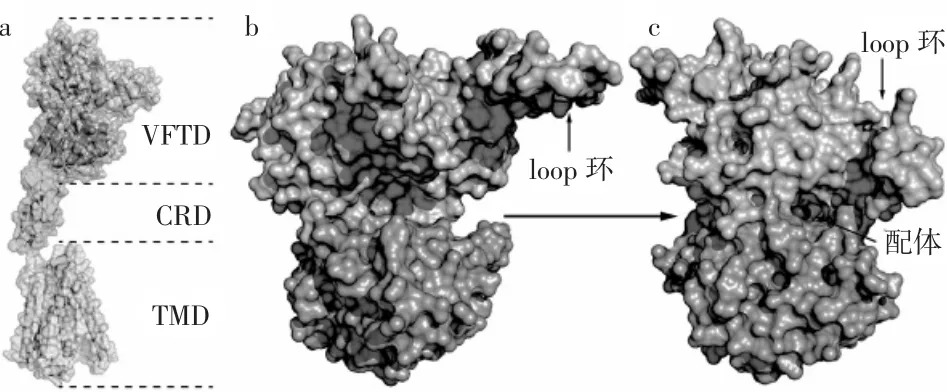
图1 CaSR结构及其VFTD构象变化示意图Fig.1 Schematic diagram of the CaSR structure and its VFTD’s comformational change
3.2 CaSR在味觉细胞中的信号传导机制
CaSR在各组织中具有不同的生理功能[66],这种功能多样性主要源于CaSR能识别多种配体以激活Gq/11,Gi/o,G12/13和 Gs等蛋白进而介导不同的下游信号通路[67]。然而在味觉感知方面,尽管GSH和γ-谷氨酰肽等浓厚感肽的浓度升高会增强CaSR的响应[68,69],但关于CaSR识别浓厚感肽而激活的下游信号通路及其与基本味觉的信号交流的信息知之甚少。
研究表明,每个味蕾由50~150个特殊味觉受体细胞(TRC)组成,TRC则分为4种类型:Ⅰ,Ⅱ,Ⅲ和Ⅳ型[70]。接收鲜、甜、苦味的 GPCR受体 T1Rs和T2Rs在II型 TRC中[71,72];而 CaSR 在II、III型 TRC中都有表达,且主要在III型中表达[73]。关于TRC的研究表明II型TRC不形成常规的突触连接,主要通过非囊泡运输方式释放ATP并将信号传递至下一级神经纤维[74-76],而III型TRC与神经末梢直接形成突触接触,有学者发现其可接收和整合来自II型细胞的信号[77-80]。综合上述结论及相关研究成果,Sarah等推断,表达于TRC的T1Rs或T2Rs与CaSR存在味觉信号传导途径的功能性偶联[81]。基于该假设,该团队描述了在II、III型TRC中可能的CaSR信号传导途径及其细胞间通讯(见图2):(1)在II型TRC中,CaSR最有可能与T1Rs共存于细胞膜上,在鲜味的传导中增强鲜味的持续性和浓厚感。鲜味物质(MSG)与kokumi物质(GSH)分别结合T1Rs和CaSR受体通过磷脂酶(PLC)依赖性途径增加胞内Ca2+浓度,最终促进神经递质ATP释放至胞外[82,83]。在该信号传导过程中,通过CaSR激活的信号通路增强Ca2+的释放,提高细胞动作电位并加强ATP的释放,从而呈现出鲜味增强的效果。(2)在III型TRC中,GSH激活细胞膜上的CaSR并通过同样的信号途径增加胞内Ca2+浓度,而胞内Ca2+浓度的增加与神经递质5-羟色胺(5-HT)的释放有关,但5-HT的释放是否以CaSR依赖性方式发生目前尚不清楚。另外,胞外的5-HT对II型TRC施加负分泌反馈,抑制其ATP释放。综上,在II、III型TRC产生的味觉信号互有影响,但这种细胞间的信号交流是否增强鲜味的浓厚感或持久性还有待证明。

图2 CaSR在味觉细胞中的信号传导机制Fig.2 The signal transmission mechanism of CaSR in taste cells
4 Kokumi肽的检测
由于kokumi物质的呈味特征一般是基于5种基本呈味综合评定其浓厚性、扩展性、持久性、集中性而得出的[84],加之其阈值较低,本身并没有或仅有极微的kokumi滋味,因此极难用一种单一的化学物质作为其感官评价的标准品以量化其kokumi强度[85]。目前,发展出了2种检测kokumi物质呈味强度的方法:一是感官评价方法;二是CaSR活性检测法。
4.1 感官评价法
Kokumi物质的感官评价方法是指在酸、甜、苦、咸、鲜味或其混合味溶液基础上添加kokumi物质,再借助人的味觉器官对混合溶液进行滋味上的语言、文字或数据描述,最后经统计学分析得出最终呈味感官评定结果[86]。Kokumi风味物质的感官评定方法是由Ueda首次提出的,在此基础上,经过不断的完善后,常用的kokumi味详细评价步骤如下:选取约20名(男女各半)18~25周岁的感官评价员,分别用蔗糖、咖啡因、乳酸、氯化钠和谷氨酸钠作为甜、苦、酸、咸、鲜味的标准品,用添加了一定浓度谷胱甘肽的空白鸡汤作为kokumi味的标准溶液,对评价员进行不同滋味特征的辨别及描述训练;再将实验样品按一定的浓度梯度添加到基础溶液或空白鸡汤中,通过与标准溶液进行比较,按照一定的打分标准对样品进行打分并按照一定的感官描述标准对样品进行感官描述性评价;最终的感官评分结果需经统计学方差分析后才能作为有效的感官评定数据。目前,感官评价是kokumi物质检测的主要方法。
4.2 CaSR活性检测法
近年来,由于感官评价法获得的结果包含一定的主观性且kokumi味描述较复杂,仅以这种评价方法已经难以满足物质kokumi强度的定量检测。随着研究的深入,逐步证明钙敏感受体可作为kokumi肽(γ-谷氨酰肽)的感知受体,它们可激发CaSR释放Ca2+流而启动一系列味觉信号传递,进而修饰酸、甜、苦、咸、鲜基本味并使人体感知到物质的浓厚感、复杂感和持久感,因此基于细胞Ca2+浓度改变的CaSR法逐渐被用于kokumi物质的检测中。Ohsu等于2010年首次以利用CaSR检测一系列合成的γ-谷氨酰肽的kokumi滋味,结合感官验证发现,kokumi味的γ-谷氨酰肽二肽和三肽皆具有CaSR激动剂活性,能引起味觉细胞Ca2+浓度变化,且其呈味活性与其CaSR激动剂活性之间具有较高的相关性。之后,Kuroda等也基于CaSR研究了kokumi物质的感知机制,发现所有测试的kokumi物质皆能作为CaSR激动剂,并且γ-谷氨酰肽的CaSR活性与浓厚度之间存在正相关[87]。2016年,Yusuke利用CaSR活性检测法并结合感官验证有效地筛选出一系列具有kokumi味的γ-谷氨酰肽,再次证明了基于细胞Ca2+浓度改变的CaSR法用于kokumi物质筛选的有效性。由上述应用实例可以看出,kokumi物质的CaSR活性检测法通常需要与感官评价法相结合使用。因为,CaSR的激动剂不止包含kokumi物质,还包括部分阳离子、氨基酸药剂、多胺类和碱性肽类如活化鱼精蛋白和聚赖氨酸等[88,89]。由此可见,仅依据味觉受体细胞释放钙离子浓度的增加来筛选kokumi物质具有一定的不准确性,该方法只适合于kokumi物质的初步筛选,kokumi物质的最终定性还需要依靠感官评价方法完成。综合而言,结合感官评价法与CaSR活性检测法检测kokumi物质是一个优选的筛选方式。
5 Kokumi肽的生物酶合成
Kokumi肽最初是从食物中经水解提取或化学合成获得的,为了促进kokumi肽的工业化应用,高效的生物酶催化合成方法逐步被报道。目前最常见的kokumi肽为γ-谷氨酰肽,多项研究报道该类kokumi肽可通过生物酶进行合成。γ-谷氨酰转肽酶(γ-Glutamyl transpeptidase,GGT)能水解γ-谷氨酰基化合物并将其γ-谷氨酰基部分转移至氨基酸和肽上形成新的γ-谷氨酰肽[90,91]。2009年,Toelstede等人指出蓝色脉纹奶酪中具有kokumi味的γ-谷氨酰肽主要是由其青霉菌中的GGT合成的[92]。另一项研究也证实在Parmesan芝士中的γ-谷氨酰二肽主要是由牛奶中的GGT催化产生的[93]。基于该结论,有学者将GGT添加到发酵食品中以获得kokumi肽。Thao等通过添加枯草芽孢杆菌来源的GGT到日本发酵豆酱中成功增加了豆酱中的鲜味和kokumi化合物,改善了豆酱的风味,其中谷氨酸浓度提高至20mmol/L,γ-Glu-Val和γ-Glu-Val-Gly等γ-谷氨酰肽浓度分别提高到70μmol和16μmol。另外一种具有GGT活性的谷氨酰胺酶也可合成γ-谷氨酰肽。Suzukit等将解淀粉芽孢杆菌来源的谷氨酰胺酶分别添加至大豆蛋白和谷蛋白水解物中,显著增强了产物的浓厚味[94];Yang等也利用这种酶转肽合成γ-[Glu](n>1)-Val和γ-[Glu](n>1)-Met,并将它们添加到酱油和鸡汤中,成功增加了酱油和鸡汤的kokumi味[95]。同时,他们还在腐乳发酵过程中通过添加谷氨酰胺酶成功消除了腐乳表面的白色颗粒(酪氨酸和苯丙氨酸),并将它们转换为γ-谷氨酰肽,改善了腐乳的kokumi风味[96]。利用生物酶合成kokumi肽克服了传统提取法产量低、纯度低、成本高等缺点[97],将促进kokumi肽的工业化生产及在食品调味中的应用。
6 Kokumi肽在食品中的应用
Kokumi肽具有直冲感温和,先觉感强,中觉味天然、圆润,后觉感丰满,回味悠长等特点,能够增强食物的浓厚感、连续性和充实感,可作为继增鲜调味料之后的一类新型味感调味料[98,99]。近期研究表明,kokumi肽组分中除GSH外,还有一种活性较高的γ-谷氨酰肽——γ-Glu-Val-Gly,可用于鸡汤中改善其浓厚感风味,具有极高的应用价值。2015年,该γ-谷氨酰肽被应用于减脂花生酱中,显著增强了减脂花生酱的浓稠感和余味,证明添加γ-Glu-Val-Gly可改善低脂肪食物的风味。2017年,Yang通过2种霉菌来源的谷氨酰胺酶合成了一系列kokumi肽γ-[Glu]n-Phe,并将其应用于商业酱油和模型鸡汤中,增加了两者的浓厚味。同年,安琪酵母集团推出了一种商业化的富含kokumi肽的酵母抽提物,将其应用于酱料中能从多方位改善酱料的风味进而提升其品质,既包括厚味、回味,还包括整体口感的协调性。此后,类似的kokumi型酵母抽提物被分别添加至黄豆酱和酱油中,显著增强了黄豆酱和酱油的kokumi风味,获得更好的口感协调 性[100,101]。上 述 kokumi肽 应 用 研 究 为 今 后kokumi物质在食品调味品领域的进一步工业化开拓了广阔的应用前景。
7 展望
随着人们生活水平的提高和饮食习惯的改善,对食物风味和质量的要求也不断提升,“低糖、低盐、低脂”逐渐成为健康饮食的发展趋势。Kokumi物质具有增强食物浓厚味、延长回味和提升整体协调性的呈味特征,并且阈值较低,少量添加至食品中即可减少糖、盐等调味料的使用量,在满足健康饮食需求的同时又可获得美好的味觉体验,使得kokumi物质在调味品领域极具开发潜力。在我国,kokumi肽的研究起步较晚,目前主要集中在新型kokumi肽的分离鉴定及混合型kokumi物质与其他食品的复合应用上,关于kokumi物质如何增强基本味觉的浓厚感和持续感及利用生物酶高效生产的研究较少。因此,急需结合生物学、信息科学进一步研究kokumi物质的呈味机制及在味觉感知中的信号传导方式,为新型kokumi肽的筛选、设计提供了理论基础;同时,加强kokumi肽生产工艺的研究,推动其低成本、高产量的工业化生产,促进其在调味品领域的应用,是今后kokumi物质研究的主攻方向。
