通过外源MeJA抑制H2O2积累提高烟草的耐冷性
2019-03-18马晓寒张环纬温心怡许自成
马晓寒 张 杰 张环纬 陈 彪 温心怡 许自成
通过外源MeJA抑制H2O2积累提高烟草的耐冷性
马晓寒 张 杰 张环纬 陈 彪 温心怡 许自成*
河南农业大学烟草学院, 河南郑州 450002
茉莉酸甲酯(MeJA)是可参与多种生理生化过程的激发子, 为探究外源MeJA对低温环境下烟草幼苗的影响, 以烟草品种“豫烟10号”为材料, 在其六叶一心时用4个不同浓度(1、10、100和1000 μmol L–1MeJA)进行喷施处理3 d后, 再进行低温处理, 同时以正常温度和低温处理作为阳性和阴性对照。分析各处理的长势指标、相对电解质渗透率、光合色素含量、抗氧化酶活性以及激素含量。结果表明: 在10 μmol L–1茉莉酸甲酯处理下能降低低温对烟草幼苗的损伤。然后在材料和时期不变的情况下, 进行DPI、10 μmol L–1MeJA以及DPI+MeJA处理以低温处理为对照, 测定了H2O2、O2–、CAT、MDA以及ASA-GSH循环的含量。证明在外源茉莉酸甲酯协同低温的处理下, 烟草植株中的H2O2主要作为毒害分子而非第二信使存在。
低温胁迫; 烟草幼苗; 茉莉酸甲酯; H2O2传导
烟草作为全球重要的经济作物和模式植物是喜温作物的典型代表。它原产于热带亚热带地区, 因此容易受寒冷天气的影响[1]。对于烟草植株, 其适宜生长温度(25~28℃)是前期较低, 中期较高, 成熟期不低于20℃。低温作为一种非生物胁迫已经在全世界成为限制作物生长和农业可持续发展的环境因素[2], 会对植物细胞造成不可逆的损伤。低温造成冷害和冻害, 冷害是指温度介于0℃和植株最低生长温度之间, 冻害则表示温度低于0℃[3]。冷害低温是本文探索的重点, 在冷害低温环境下, 虽然不会完全抑制植物生长和代谢但却能大幅度减缓作物生产, 尤其是对于像烟草类的冷敏感作物。在其移栽期, 倒春寒会加剧低温胁迫。经大量研究表明, 低温引起的植物损伤主要因细胞膜结构功能受损和活性氧过量[4]。
茉莉酸甲酯(MeJA)是一种与损伤相关的植物激素和信号分子, 作为天然植物生长调节剂, 广泛存在于各种高等植物中, 并在调节应激反应和植物发育中发挥重要作用[5]。大量的研究也证实了MeJA能够增强采后果蔬对低温的抗性[6-7], 也可以通过积累植物螯合素赋予拟南芥对Cu和Cd胁迫的耐受性[8]。并且茉莉酸甲酯的施用能够增强腺毛的分泌, 在病虫害、低温干旱等逆境中发挥防御的积极作用[9]。
脱落酸(ABA)和生长素(IAA)作为植物中重要的激素, 过氧化氢(H2O2)作为植物中关键的信号分子在应对非生物胁迫中有重要的作用[10]。二亚苯基碘(DPI)是NADPH氧化酶的抑制剂, 可以通过抑制NADPH氧化酶的产生间接抑制H2O2的生成[11]。
然而现阶段未曾探究外源MeJA对于烟草幼苗细胞组织耐冷性的影响, 同时对于MeJA与ABA、IAA以及H2O2的交叉串扰机理没有一定的研究。为了检验早期产生的H2O2是否是MeJA诱导耐冷性的关键因素, 遂在初期应用抑制植物中H2O2积累的DPI进行探究。
本试验基于以往的研究, 探究外源一定浓度的茉莉酸甲酯是否能够增强烟草对低温的耐受性, 并验证H2O2在MeJA介导的信号中的作用。本研究有助于进一步阐明外源MeJA应对低温胁迫的生理机制, 为MeJA在烟草等作物幼苗中的应用提供科学依据。
1 材料与方法
1.1 试验材料与处理
通过预实验选取“豫烟10号”为供试材料。于2017年4月在河南农业大学品质生态实验室采用霍格兰(Hoagland)营养液为水培育苗, 前期以育苗盘和工字格海绵为介质, 将种子用10%过氧化氢消毒后均匀地点在海绵中, 待烟草种子露白发芽后选取长势一致的幼苗用镊子移至蛭石中生长。烟草幼苗长至四叶期时从蛭石中移至水培盒中生长。培养箱昼夜温度为(28±2)℃/(18±2)℃、光周期为14 h/10 h循环、相对湿度为70%、光照强度为440 μmol m–2s–1。
烟草幼苗在六叶龄时对低温敏感[12], 待烟草幼苗在水培盒中长至六叶一心时, 采用单因素随机试验设计, 选取长势一致的幼苗进行处理。共进行2个不同试验。
试验1: 有6种处理, 每个处理3次重复, 每个重复3株烟苗。以正常温度处理的烟苗作为阳性对照, 低温处理(11℃/8℃)的烟苗作为阴性对照, 分别喷施1、10、100和1000 μmol L–1的MeJA预处理 3 d, 分别标记为CK、C0、C1、C10、C100、C1000。预处理期间保持正常生长温度, 预处理结束后进行5 d低温处理。期间保证每3 d换一次营养液, 每天通氧2 h。在低温处理的第5 天分别选取两片真叶测定各生理生化指标。本试验旨在探讨MeJA诱导烟草耐冷性的生理机制, 同时为试验2确定低温下幼苗生长发育的最适MeJA处理浓度。
试验2: 共4种处理, 每处理3次重复, 每个重复3株烟苗。低温处理(11℃/8℃)的烟苗为对照, 喷施10 μmol L–1MeJA、5 mmol L–1DPI (二亚苯基碘, NADPH氧化酶抑制剂)和10 μmol L–1MeJA+5 mmol L–1DPI, 保持正常生长温度预处理3 d。预处理结束后进行 5 d的低温处理。在此生长期间保证每3 d换一次营养液, 每天通氧2 h。在低温处理的第0、3、5天分别选取两片真叶测定各生理生化指标, 以探讨H2O2在MeJA诱导烟草幼苗的耐冷性中的作用。
所用试剂MeJA、DPI购于Sigma试剂公司, MeJA纯度为95%。
1.2 烟草幼苗鲜重、干重、最大叶面积的测定
在低温处理的每天测量同一叶的叶长和叶宽, 通过郑凤君等[13]的方法计算叶面积。在处理后的第5 天称量烟草幼苗的鲜重, 将幼苗以105℃烘箱杀青30 min, 70℃烘48 h至恒重后称量其干重。
1.3 相对电解质渗透率及光合色素含量的测定
参照Köhle等[14]的方法稍加改动, 使用雷磁DDS-11A电导率仪测定烟草植株自顶点的第2片完全展开叶的相对电解质渗透率。将0.5 g待测叶片加入25 mL双蒸水浸泡24 h, 使用电导率仪测定电解质渗透率R1, 通过在沸水浴中煮沸30 min后经冷却测定其电解质渗透率R2, 叶片相对电解质泄漏率为初始与最终的电导率的百分比。
参照Lichtenthaler和Buschmann[15]的方法加以改进测定叶绿素、叶绿素和类胡萝卜素的含量, 取相同叶位叶片0.2 g, 加入10 mL 80%的丙酮放置黑暗中处理24 h后测定其在665 nm、649 nm、470 nm的吸光值。
1.4 ABA和IAA含量测定
称取约0.1 g烟草样本, 在80%乙醇中均质化并在4℃浸提过夜。将匀浆以8000´离心10 min, 取上清液, 加0.5 mL试剂二萃取脱色3次, 氮吹仪吹至液面0.5 mL以下。将流动相定容至0.5 mL, 以针头式过滤器过滤于带有内衬管的样品瓶内待测。用HCl将其酸化至pH 2.5, 并用乙醚(有机物至水相1∶3)分配2次。随后将ABA和IAA从有机相转移到1%碳酸氢钠(pH 7~8; 有机相与水相的比例为1∶3)中, 用乙醚再萃取, 用重氮甲烷甲基化并使用针对ABA和IAA进行免疫测定[16]。
1.5 H2O2、O2–和MDA的含量测定
使用南京建成生物科技有限公司生产的试剂盒检测H2O2含量; 参照Jabs等[17]的羟胺氧化法测定超氧阴离子(O2–)的含量。按照Dhindsa和Matowe[18]方法, 使用硫代巴比妥酸(TBA)比色法测定丙二醛(MDA)含量。
1.6 抗氧化酶系统及非酶促系统测定
称取相同叶位烟草叶片0.5 g, 加入预冷的5 mL pH为7.8的磷酸缓冲液进行冰浴研磨, 并冷冻离心20 min, 上清液即酶活性提取液, 置4℃冰箱低温保存。按照Pinheiro等[19]的方法测定超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性。
将0.5 g叶片在5 mL 5%TCA溶液中均质化, 在4℃条件下以12,000´离心20 min。上清液即酶活性提取液。参考Law等[20]的方法测定抗坏血酸(ASA)、还原性谷胱甘肽(GSH)含量。
将0.5 g叶片用2 mL 6%的偏磷酸冰浴中研磨, 在4℃条件下以8000´离心20 min。上清液即酶活性提取液。参考Nakano等[21]的方法测定抗坏血酸过氧化物酶(APX)活性, 参照Foyer等[22]的方法测定谷胱甘肽还原酶(GR)活性。
1.7 数据统计与分析
每次测定数据均为3次重复实验的平均值。采用方差分析(ANOVA)和邓肯氏多重比较显示处理之间的差异。使用SPSS 19.0进行统计分析。
2 结果与分析
2.1 MeJA对低温下烟草幼苗生长的影响
如表1所示, 暴露于低温环境下的烟草幼苗在整个处理时期的鲜重干重以及最大叶面积都有显著的下降趋势。在低温处理5 d后, C0处理较CK处理的烟草幼苗地上部和根部的鲜重、干重分别减少了54.82%、65.17%、84.22%、63.00%; 而C10则分别减少了11.52%、28.65%、34.49%、23.33%。相对比下可以发现10 μmol L–1MeJA能够有效地促进低温下烟草的生长发育。并且100 μmol L–1MeJA处理的烟草幼苗也能够抵御低温的侵害, 但效果较10 μmol L–1MeJA差; 而浓度为1 μmol L–1和1000 μmol L–1的茉莉酸甲酯缓解效果不显著(表1)。
图1显示的是在低温处理5 d内各处理的最大叶面积的变化。在第1天和第2天各处理的最大叶面积没有显著差异, 自第3天开始处理间有显著性差异, 在第4、第5天处理间差异增大。表现为正常温度处理的烟草幼苗最大叶面积呈指数型态势增长, 其次是C10、C100处理的烟草幼苗。而C0、C1、C1000处理增量及差异均不显著。

表1 MeJA对低温胁迫下烟草幼苗地上部、根部的鲜重和干重的影响
CK: 正常温度处理; C0: 低温处理无MeJA喷施; C1: 低温处理+1 μmol L–1MeJA喷施; C10: 低温处理+10 μmol L–1MeJA喷施; C100: 低温处理+100 μmol L–1MeJA喷施; C1000: 低温处理+1000 μmol L–1MeJA喷施。数值后不同小写字母表示在0.05水平差异显著。
CK: Normal temperature treatment; CO: Low-temperature treatment without MeJA spray; C1: Low temperature treatment and 1 μmol L–1MeJA spray; C10: Low temperature treatment and 10 μmol L–1MeJA spray; C100: Low temperature treatment and 100 μmol L–1MeJA spray; C1000: Low temperature treatment and 1000 μmol L–1MeJA spray. Values followed by different letters are significantly different at< 0.05.

图1 低温处理5 d内各处理的最大叶面积
缩写同表1。图柱上不同小写字母表示在0.05水平差异显著。
Abbreviations are the same as those given in Table 1. Bar superscripted by different letters are significantly different at< 0.05.
2.2 MeJA对低温下烟草幼苗相对电导率及光合色素的影响
相对电导率和光合色素是胁迫下体现植物细胞损伤的重要指标。经过5 d的处理, 低温下不同浓度MeJA喷施较正常温度处理的相对电导率有不同程度的提高, 分别提高了2.66、2.75、0.22、1.11和2.97倍(图2-A)。即在C10和C100处理下烟草幼苗的相对电导率增长量较其他处理低, 尤其在C10处理下与CK处理的相对电导率无显著差异。说明在10 μmol L–1和100 μmol L–1MeJA处理下细胞膜完整性较好。
各处理光合色素含量的变化与相对电导率的变化一致。低温5 d后各处理的烟草叶片的叶绿素、叶绿素和类胡萝卜素含量都显著下降, 其中C10和C100处理下的光合色素维持在较高的含量水平, C10处理在类胡萝卜素含量上甚至高于CK处理的烟苗, C100处理的类胡萝卜素含量与CK处理的烟苗无显著差异(图2-B)。
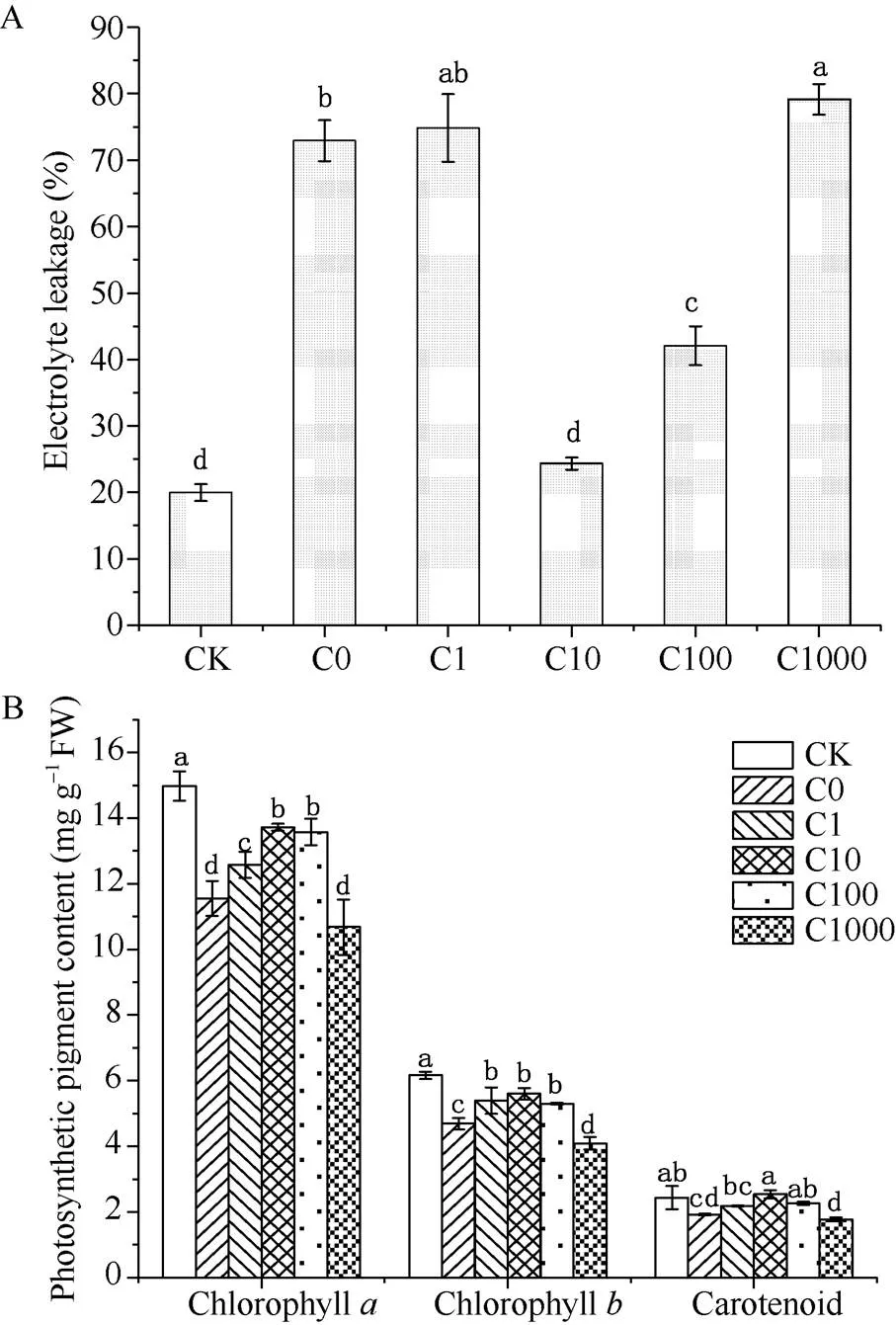
图2 低温处理5 d后各处理的相对电导率和光合色素含量
缩写同表1。图柱上不同小写字母表示在0.05水平差异显著。
Abbreviations are the same as those given in Table 1. Bar superscripted by different letters are significantly different at< 0.05.
2.3 MeJA对低温下烟草激素含量的影响
图3表示的是在外源喷施不同浓度的MeJA时, 烟草幼苗细胞中的ABA和IAA含量。在5 d低温的处理下, C0处理脱落酸有少许增加, 而生长素显著下降, 较CK处理下降了37.21%。在茉莉酸甲酯喷施下, C10处理ABA和IAA含量分别是C0的2.83倍和4.83倍。可以发现, 低温下喷施合适浓度的MeJA能够有效地提高激素含量以应对逆境。
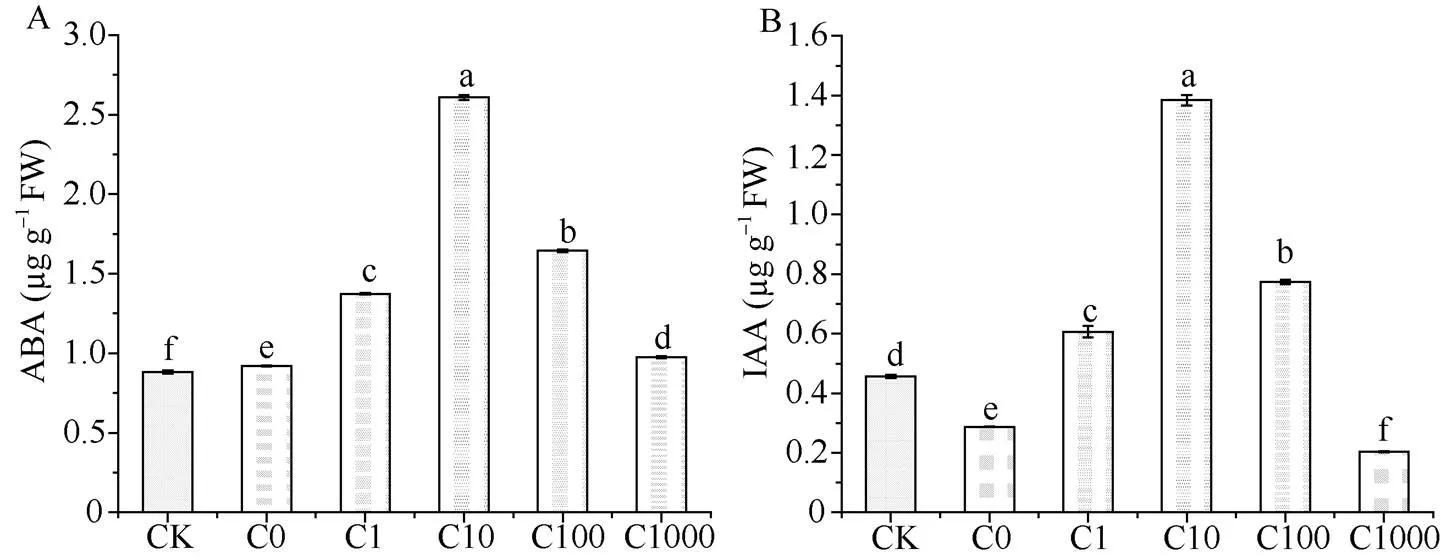
图3 低温处理5 d后各处理的激素含量
缩写同表1。图柱上不同小写字母表示在0.05水平差异显著。
Abbreviations are the same as those given in Table 1. Bar superscripted by different letters are significantly different at< 0.05.
2.4 MeJA对低温下烟草幼苗抗氧化酶的影响
烟草幼苗随着遭受低温胁迫时间的增长, SOD、CAT活性显著上升, 而POD显著下降(图4), 通过喷施茉莉酸甲酯会改变烟草幼苗体内的的抗氧化酶活性。C1000处理的SOD活性最高, C10处理的POD和CAT活性最高。整体对比下来, C10处理的SOD、POD、CAT较CK处理分别增加了3.39、0.52和2.41倍; C100处理的SOD、POD、CAT较CK处理分别增加了2.98、0.10和1.28倍。很明显除了SOD在C1000处理时较高外, C1和C1000处理与C0处理的烟草幼苗的抗氧化酶活性无显著差异。
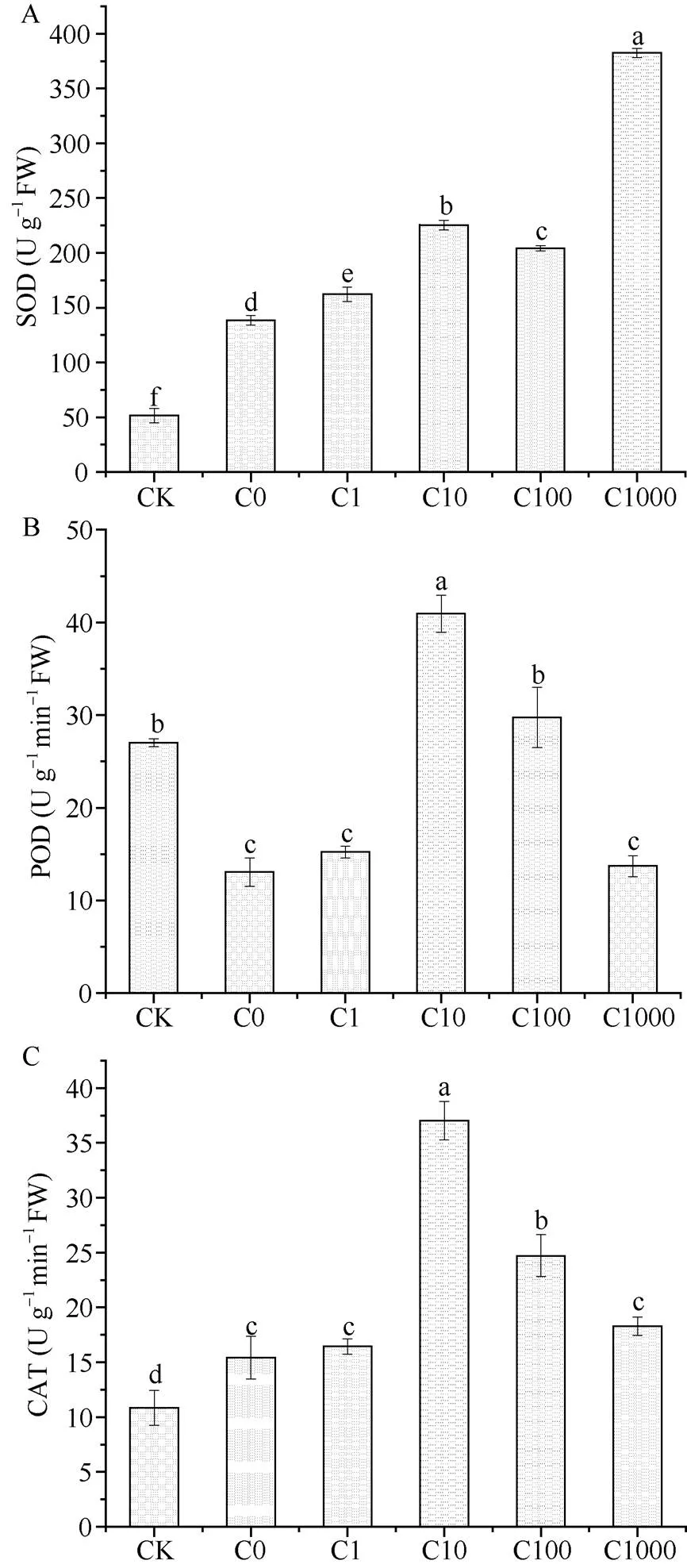
图4 低温处理5 d后各处理的抗氧化酶系统活性
缩写同表1。图柱上不同小写字母表示在0.05水平差异显著。
Abbreviations are the same as those given in Table 1. Bar superscripted by different letters are significantly different at< 0.05.
2.5 DPI对MeJA诱导烟草幼苗耐冷性的影响
在低温环境下的第0天, H2O2、O2–和CAT含量在4个处理中无显著差异, 在低温后的第3天差异开始明显显现。
低温处理下的烟草幼苗的H2O2、O2–含量显著升高, MeJA、DPI以及MeJA+DPI处理的烟草幼苗在处理后第3天含量最高, 第5天较第3天含量低。整体含量都低于低温胁迫下的烟草幼苗。而CAT呈现出相反的状态, 低温处理的烟苗随着时间的推移增量较小, 而低温下施用MeJA、DPI以及MeJA+ DPI的烟草幼苗CAT随着时间而不断增加。CAT在低温处理组第5天较第3天高7.22%, 较第0天高43.10%; MeJA组第5天较第3天高1.01倍, 较第0天高1.78倍; DPI组第5天较第3天高1.02倍, 较第0天高2.10倍; MeJA+DPI组第5天较第3天高0.97倍, 较第0天高2.28倍。可见在低温下施用MeJA、DPI、以及MeJA+DPI都能极大地提高CAT活性, 并且整体看来H2O2、O2–和CAT呈负相关关系(图5-A, B, C)。
MDA是已知的逆境条件下重要的脂膜过氧化指标, 其含量显示了细胞膜质过氧化程度和植物对逆境反应的强弱。通过3个时间段检测4个处理间烟草的MDA含量发现, 在第0天4个处理间的MDA没有显著差异。在第3天差异开始显著, 其中低温处理的MDA含量较第0天增长了4.68倍, 第5天的含量较第0 天增长了7.89倍; MeJA组第3天较第0天高1.32倍, 第5天较第0天高2.12倍; DPI组第3天较第0 天高1.52倍, 第5天较第0天高2.08倍; MeJA+DPI组第3天较第0天高1.27倍, 第5天较第0 天高2.02倍(图5-D)。这组数据说明在低温胁迫下植物中的MDA含量都会升高, 而在施用MeJA、DPI和MeJA+DPI时能够有效降低MDA的增长量。
2.6 DPI对MeJA诱导的ASA-GSH循环的影响
由图6可以发现, 随着时间的推移, 在低温处理下除了APX的活性, 其他含量都表现为先升高后降低; 而施用外源MeJA、DPI以及MeJA+DPI的处理都表现为持续升高。其中在处理的第0天, 4个处理的GR、GSH、APX、ASA差异不大, 在处理3 d后低温下处理与外源施用的各处理含量有显著差异, 5 d后差异明显加剧。在抗坏血酸–谷胱甘肽循环中, APX活性与其他3个含量的变化趋势不同, 表现为在胁迫的第0、3、5天4个处理含量都持续升高, 并且在胁迫第5 天低温处理组APX活性高达5.73 μmol min–1g–1, 是同处理第0、3天的2.69倍和2.35倍。也分别高出同时期MeJA、DPI以及MeJA+DPI处理41.30%、44.84%和46.50% (图6-C)。

图5 低温下各处理的活性氧、CAT及MDA的含量
图柱上不同小写字母表示在0.05水平差异显著。
Bar superscripted by different letters are significantly different at< 0.05.
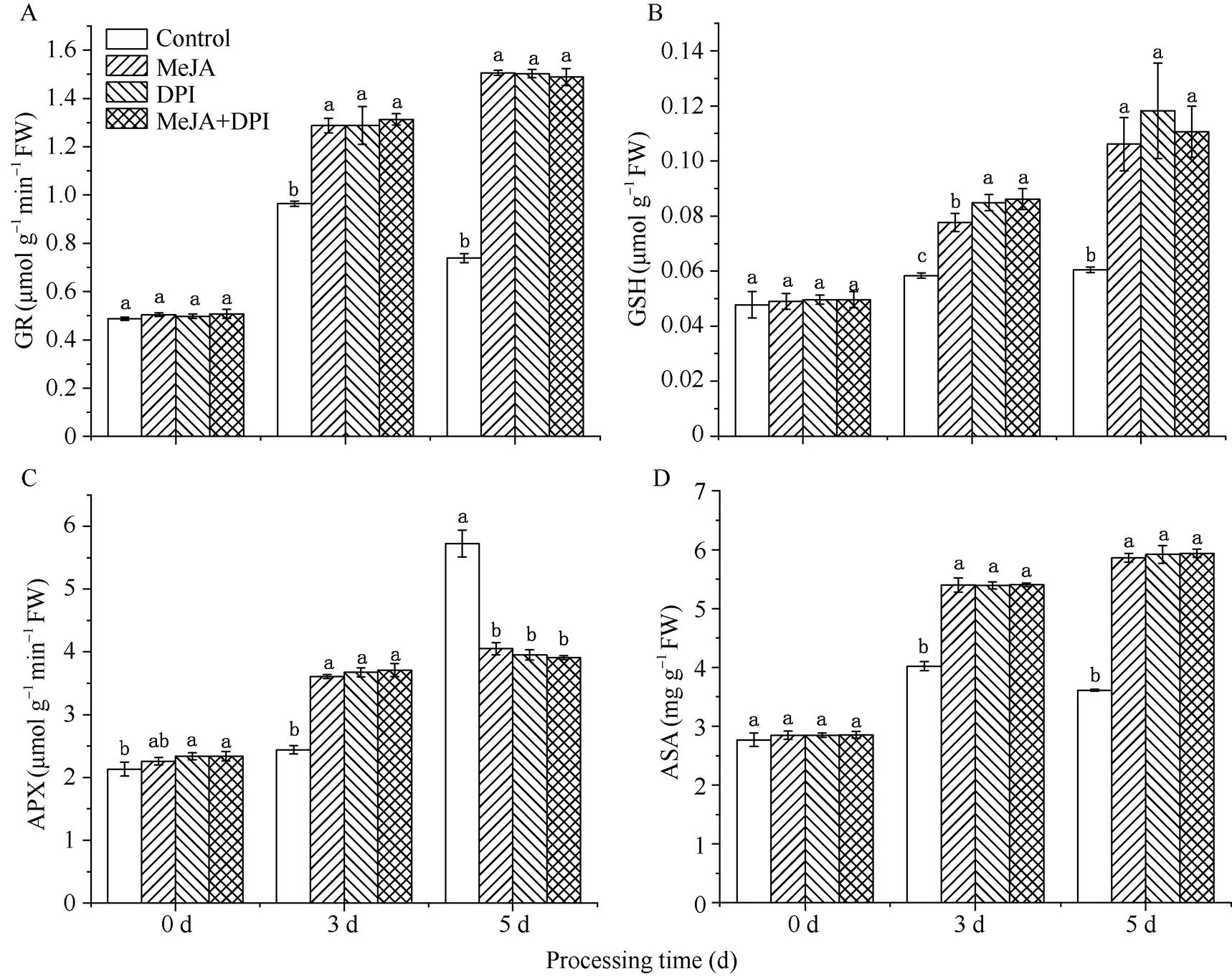
图6 低温下各处理的GR、GSH、APX、ASA含量
图柱上不同小写字母表示在0.05水平差异显著。
Bar superscripted by different letters are significantly different at< 0.05.
3 讨论
近年来由于茉莉酸甲酯参与植物发育和防御信号传导而被广泛关注。茉莉酸通路受到外界复杂信号的调节, 经研究发现, 茉莉酸类化合物与其他植物激素信号途径之间存在调节植物响应的相互作用, 并能避免多种非生物胁迫的影响[23]。Battal等[24]发现低温下施用一定浓度茉莉酸甲酯能够诱导玉米的生理和分子的变化。Fan等[25]发现1 μmol L–1的MeJA可通过减少储存期间的PPO活性来抑制冷害指数和重量损失来维持采后豇豆的感官品质。本试验结果表明, 10 μmol L–1的MeJA处理烟草幼苗, 通过对内源激素水平的调控和对活性氧的消除机制, 促进了脱落酸和生长素的合成, 增强了细胞膜的可塑性, 有效提高了烟草幼苗的耐冷性。
在低温胁迫下烟草有着高敏感特征, 使其幼苗的鲜重、干重和最大叶面积都显著降低, 烟草的生长受到抑制。冷害随着时间的延长对细胞造成的伤害会进一步加大。通常导致细胞结构损伤, 丧失细胞完整性, 因此细胞膜通透性、相对电解质渗漏和丙二醛含量被用作冷害的定量指标[26]。在本研究中发现, MeJA能显著降低冷害下烟草的相对电导率的指数, 尤其在低温下喷施10 μmol L–1的MeJA能使叶片受损率减少, 使冷害引起的生长抑制得到缓解, 这表明喷施合适浓度的MeJA能提高烟草幼苗抗低温胁迫的能力。这与先前关于用MeJA处理其他植株的报道一致[27]。
ABA是重要的抗寒信号分子, 并且可以维持种子休眠、调节生长[28]。IAA对植物生长发育起重要作用, 其含量的增加能够增强细胞壁的延展性, 增强细胞受外界的胁迫程度[29]。喷施茉莉酸甲酯能够促进烟草植株体内ABA和IAA的合成, 增加植株体内抗氧化酶的活性, 减少相对电导率和丙二醛的含量, 增加光合色素的含量。并随着外源茉莉酸甲酯浓度的升高, 出现了缓解低温效果的程度先增大后减小的现象, 说明外源茉莉酸甲酯同大部分外源物质一样具有剂量效应。在浓度为10 μmol L–1时缓解低温最有效。
H2O2在植物中有着较为复杂的作用。它既可以作为对细胞具有破坏性的毒性分子又可以作为信号分子发挥作用, 不同的作用取决于活性氧产生和清除的适当位置以及时间的平衡关系[30]。早期产生的H2O2可以引发防御反应, 而在MeJA诱导烟草抵御低温时是否启动了H2O2作为第二信使的传导途径不得而知。本试验在确定外源茉莉酸甲酯缓解低温的最适浓度基础上, 通过施用抑制H2O2积累的DPI发现, 代表着冷害指标的MDA含量较低, CAT活性升高。CAT是抗氧化酶系统中的一部分, 能直接消除H2O2, 这说明低温下MeJA不需要H2O2进行耐冷性的诱导, 也可判定低温下活性氧的积累会加大细胞膜等蛋白组分的损害。本试验与Shin外源水杨酸提高菠菜耐冻性[10]的研究结果不一致, 说明水杨酸和茉莉酸甲酯都作为生长调节剂在抗逆的机理上可能是有差别的。
在分解活性氧的机制中主要有两部分, 一是抗氧化酶系统机制, 包括SOD、POD和CAT; 二是非酶促的抗氧化机制, 包含ASA、APX、GSH、GR等。植物中的活性氧水平可以通过两部分的协同作用被调节。保护酶体系在缓解胁迫方面有重要的作用, SOD是膜保护的第一层防线, 可以将O2–转化为H2O2, 继而POD、CAT发挥作用将H2O2转化为H2O和O2。而在非酶促的抗氧化机制中, GSH和ASA在维持细胞氧化还原和抗氧化保护中发挥重要作用, GR能通过NADPH将GSSG还原为GSH。GSH是ASA合成关键酶的底物, 在ASA的作用下, APX可以将H2O2还原成水, 从而减少H2O2的含量。试验表明, 在MeJA和DPI的处理下, 与H2O2清除有关的指标CAT含量和ASA-GAH循环含量都显著上升, 减轻了低温对烟草幼苗造成的氧化应激。这说明抑制NADPH氧化酶的DPI也能通过提高非酶促抗氧化防御系统的含量来减少H2O2的含量。进一步说明H2O2更多的是作为活性氧毒性积累而不是第二信使的身份进行信号传导。
4 结论
MeJA作为频繁参与非生物胁迫和病原体防御反应的生物相关组分, 能够有效地抑制烟草幼苗在低温胁迫损伤。H2O2并没有作为第二信使参与由MeJA介导的信号传导。MeJA缓解低温胁迫主要的生理机制是调控植株内的激素水平和减少活性氧的危害, 其喷施浓度以10 μmol L–1效果最好, 并随着浓度的变化表现出高抑低促的效果。
[1] Fan T F, Cheng X Y, Shi D X, He M J, Yang C, Liu L, Li C J, Sun Y C, Chen Y Y, Xu C, Zhang L, Liu L H. Molecular identification of tobaccothat mediated ammonium root-influx with high affinity and improved plant growth on ammonium when overexpressed in Arabidopsis and tobacco., 2017, 264: 102–111.
[2] Augspurger C K. Reconstructing patterns of temperature, phenology, and frost damage over 124 years: spring damage risk is increasing., 2013, 94: 41–50.
[3] Menéndez A B, Rodriguez A A, Maiale S J, Rodriguez K M, Jimenez B J F, Ruiz O A. Polyamines Contribution to the Improvement of Crop Plants Tolerance to Abiotic Stress. Springer New York, 2013, pp 113–136.
[4] Ma X, Chen C, Yang M, Dong X C, Lyu W, Meng Q W. Cold-regulated protein (SlCOR413IM1) confers chilling stress tolerance in tomato plants., 2018, 124: 29–39.
[5] Per T S, Khan M I R, Anjum N A, Masood A, Hussain S J, Khan N A. Jasmonates in plants under abiotic stresses: crosstalk with other phytohormones matters., 2018, 145: 104–120.
[6] Cai Y, Cao S, Yang Z, Zheng Y. MeJA regulates enzymes involved in ascorbic acid and glutathione metabolism and improves chilling tolerance in loquat fruit.,2011, 59: 324–326.
[7] Qi X N, Xiao Y Y, Fan Z Q, Chen J Y, Lu W J, Kuang J F. A banana fruit transcriptional repressor MaERF10 interacts with MaJAZ3 to strengthen the repression of JA biosynthetic genes involved in MeJA-mediated cold tolerance.,2016, 120: 222–231.
[8] Wani S H, Kumar V, Shriram V, Sah S K. Phytohormones and their metabolic engineering for abiotic stress tolerance in crop plants., 2016, 4: 162–176.
[9] 娄亚楠, 王召军, 杨欣玲, 张洪映, 牛德新, 杨永锋, 崔红. 茉莉酸甲酯对烟草分泌型和非分泌型腺毛形态发生的影响. 中国烟草学报, 2018, 24(2): 24–29.Lou Y N, Wang Z J, Yang X L, Zhang H Y, Niu D X, Yang Y F, Cui H. Effects of methyl jasmonic acid on morphogenesis of tobacco glandular and non-glandular trichomes., 2018, 24(2): 24–29 (in Chinese with English abstract).
[10] Shin H, Min K, Arora R. Exogenous salicylic acid improves freezing tolerance of spinach (L.) leaves., 2017, 81: 192–200.
[11] 杨新良, 陈也君, 胡高云, 李乾斌. NADPH氧化酶及其抑制剂的研究进展. 药学学报, 2016, 51: 499–506.Yang X L, Chen Y J, Hu G Y, Li Q B. Research progress of NADPH oxidases and their inhibitors., 2016, 51: 499–506 (in Chinese with English abstract).
[12] 韩锦峰, 岳彩鹏, 刘华山, 苗红梅, 王德勤, 岳红波. 烤烟生长发育的低温诱导研究: I. 苗期低温诱导对烤烟顶芽发育及激素含量的影响. 中国烟草学报, 2002, 8(1): 27–31.Han J F, Yue C P, Liu H S, Miao H M, Wang D Q, Yue H B. Low temperature induction of growth and development of flue-cured tobacco: I. Effects of low temperature induction at seedling stage on shoot bud development and hormone content in flue-cured tobacco., 2002, 8(1): 27–31 (in Chinese with English abstract).
[13] 郑凤君, 华南金秋, 张立猛, 李江舟, 计思贵, 林杉. 长宽法测定幼苗期烟草叶面积的校正系数. 中国烟草科学, 2015, 36(6): 13–16.Zheng F J, Hua N J Q, Zhang L M, Li J Z, Ji S G, Lin S. Revision of the length-width method correction coefficient in measuring leaf area of tobacco plants at the seedling stage., 2015, 36(6): 13–16 (in Chinese with English abstract).
[14] Köhle H, Jeblick W, Poten F, Blaschek W, Kauss H. Chitosan-elicited callose synthesis in soybean cells as a ca-dependent process., 1985, 77: 544–551.
[15] Lichtenthaler H K, Buschmann C. Chlorophylls and Carotenoids: Measurement and Characterization by UV-VIS Spectroscop. John Wiley & Sons, Inc, 2001. p 1230.
[16] Veselov S Y, Kudoyarova G R, Egutkin N L, Gyuli-Zade V Z, Mustafina A R, Kof E M. Modified solvent partitioning scheme providing increased specificity and rapidity of immunoassay for indole-3-acetic acid., 2010, 86: 93–96.
[17] Jabs T, Dietrich R A, Dangl J L. Initiation of runaway cell death in an Arabidopsis mutant by extracellular superoxide., 1996, 273: 1853–1856.
[18] Dhindsa R S, Matowe W. Drought tolerance in two mosses: correlated with enzymatic defence against lipid peroxidation., 1981, 32: 79–91.
[19] Pinheiro H A, Damatta F M, Arm C, Fontes E P B, Loureiro M E. Drought tolerance in relation to protection against oxidative stress in clones ofsubjected to long-term drought., 2004, 167: 1307–1314.
[20] Law M Y, Charles S A, Halliwell B. Glutathione and ascorbic acid in spinach () chloroplasts. The effect of hydrogen peroxide and of Paraquat., 1983, 210: 899.
[21] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts., 1981, 22: 867–880.
[22] Foyer C H, Halliwell B. The presence of glutathione and glutathione reductase in chloroplasts: a proposed role in ascorbic acid metabolism., 1976, 133: 21–25.
[23] Ghasemi P A, Sajjadi S E, Parang K. A review (research and patents) on jasmonic acid and its derivatives., 2014, 347: 229–239.
[24] Battal P, Erez M E, Turker M, Berber I. Molecular and physiological changes in maize () induced by exogenous NAA, ABA and MeJA during cold stress., 2008, 45: 173–185.
[25] Fan L, Wang Q, Lyu J, Gao L, Zou J H, Shi J Y. Amelioration of postharvest chilling injury in cowpea () by methyl jasmonate (MeJA) treatments.(Amsterdam), 2016, 203: 95–101.
[26] Cao S F, Zheng Y H, Wang K T, Rui H J, Tang S S. Effect of methyl jasmonate on cell wall modification of loquat fruit in relation to chilling injury after harvest., 2010, 118: 641–647.
[27] Li D M, Guo Y K, Li Q, Zhang J, Wang X J, Bai J G. The pretreatment of cucumber with methyl jasmonate regulates antioxidant enzyme activities and protects chloroplast and mitochondrial ultrastructure in chilling-stressed leaves.(Amsterdam), 2012, 143: 135–143.
[28] Li X J, Yang M. Abscisic acid pretreatment enhances salt tolerance of rice seedlings: proteomic evidence., 2010, 1804: 929–940.
[29] De Smet I, Voss U, Lau S, Wilson M, Shao N, Timme RE, Swarup R, Kerr I, Hodqman C, Bock R, Bennett M, Jürqens G, Beeckman T. Unraveling the evolution of auxin signaling., 2011, 155: 209–221.
[30] Mittler R. Oxidative stress, antioxidants and stress tolerance., 2002, 7: 405–410.
Exogenous MeJA improves cold tolerance of tobacco by inhibiting H2O2accumulation
MA Xiao-Han, ZHANG Jie, ZHANG Huan-Wei, CHEN Biao, WEN Xin-Yi, and XU Zi-Cheng*
College of Tobacco Science, Henan Agricultural University, Zhengzhou 450002, Henan, China
Methyl jasmonate (MeJA) is an elicitor evolving in a variety of physiological and biochemical processes. To explore the effects of exogenous MeJA on tobacco seedlings under low temperature conditions, we used the tobacco variety “Yuyan 10” and sprayed four concentrations (1, 10, 100, 1000 μmol L–1) of MeJA for 3 days on plants. Under low temperature with the treatment under normal temperature as positive and that under low temperature on negative control. The growth indicators, relative electrolyte permeability, photosynthetic pigment content, antioxidant enzyme activity and hormone content of each treatment were measured, showing that the treatment with 10 μmol L–1methyl jasmonate could reduce the damage of tobacco seedlings caused by low temperature. The effect of H2O2was then verified by applications of DPI, 10 μmol L–1MeJA, and DPI+MeJA with the same material and growth period, while low temperature treatment was used as a control. The contents of H2O2, O2–, CAT, MDA, and ASA-GSH cycle were determined. In conclusion, H2O2in tobacco plants mainly exists as a poison molecule instead of a second messenger under the treatment of exogenous methyl jasmonate combined with low temperature.
low temperature stress; tobacco seedlings; MetJA; H2O2conduction
2018-07-02;
2018-10-08;
2018-11-07.
10.3724/SP.J.1006.2019.84090
许自成, E-mail: zichengxu@126.com
E-mail: maxiaohan1994@126.com
本研究由中国烟草总公司河南省公司科技攻关项目(201641170024100, 201641170024099)资助。
This study was supported by the China National Tobacco Corporation’s Henan Provincial Science and Technology Research Project (201641170024100, 201641170024099).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20181106.1631.005.html
