黑龙江省五常市结核分枝杆菌基因型及传播特征
2019-03-18彭英唐鹭裴新发张学志林百丰陈丽于艳玲李发滨
彭英 唐鹭 裴新发 张学志 林百丰 陈丽 于艳玲 李发滨
作者单位:150036 哈尔滨,黑龙江省结核病预防控制中心
结核分枝杆菌(MTB)中有一类具有相似遗传背景的北京基因型菌株,这些菌株分布广泛,在世界各地都发现有北京基因型菌株的流行,在中国地区,北京基因型菌株具有相当高的密度,超过80%的MTB属于北京基因型菌株[1]。通过对北京基因型菌株的分布和传播规律的研究,可以揭示其对分子流行病学的影响。
近年来,分子生物学的发展极大地促进了感染性疾病的流行病学研究,重复性好、分辨率高的分子分型方法主要依赖于MTB基因组的重复序列,包括插入序列(insertion sequence,IS) 6110、数目可变串联重复序列-分枝杆菌散在重复单位(variable number tandem repeats-mycobacterial interspersed repetitive units,VNTR-MIRU)等。其中以PCR为基础的间隔区寡核苷酸分型(spacer oligonucleotide typing,Spoligotyping)是用于鉴定MTB家族遗传机构的重要技术,特别是在区分北京基因型和非北京基因型方面,但是该技术操作过程繁琐,结果判读较复杂[2];可变数目串联重复序列(variable number tandem repeat,VNTR)分析是以PCR技术为基础的基因分型方法,该技术的分辨率更高,结果更易分析,且具有很高的重复性,特别是其数字化的结果展现形式使得不同实验室之间的结果相互比较[3]。 基于MTB插入重复单位和数目可变的串联重复序列基因分型方法受到越来越广泛的重视,大大扩大了基因分型适用范围。本研究通过对黑龙江省五常市收集的MTB 7位点VNTR基因多态性分析,初步探究当地MTB的传播特征,为当地有效控制结核病提供有效的工具。
资料和方法
一、一般资料
菌株来源于2009年6月至2010年10月黑龙江省五常市结核病门诊收集的固体罗氏分离培养阳性的121株MTB。121株MTB分离株的患者男84例、女37例,男∶女=2.27∶1。年龄范围17~85岁,<40岁 41 例,40~岁 50 例,≥60 岁30例。初治119例,复治2例。对所有入选患者采用比例法药物敏感性试验(简称“药敏试验”)检测其耐药性,用RD105缺失基因检测和7个位点可变数目串联重复序列(variable number of tandem repeats,VNTR)进行分子分型,H37Rv标准株由中国疾病预防控制中心国家结核病参比实验室提供,培养基购自珠海贝索生物技术有限公司。
1.主要仪器:GeLDoc2000nin凝胶成像系统和PCR仪由美国Bio-Rad公司生产;DYY-6B型水平电泳仪由北京六一仪器厂生产。
2. 主要试剂:MTB分型鉴定试剂盒(含 MTB 鉴 定 、16S rRNA、QUB-11b、QUB-18、QUB-26、MIRU26、QUB11a、Mtub21、VNTR3820等组分)购自北京康为世纪生物科技有限公司。
二、研究方法
(一)药敏试验
采用传统的比例法药敏试验对4种一线抗结核药物异烟肼、利福平、链霉素、乙胺丁醇进行检测,培养基内药物终浓度分别为 0.2、40、4、2 μg/ml。耐药百分比=(含药培养基上生长的菌落数/对照培养基上生长的菌落数)×100%,以耐药百分比>1%定义为耐药。
(二)MTB菌型分析
针对人型MTB特异性序列设计引物MTB1和 MTB2,根据结核分枝杆菌复合群特异性IS6110设计引物IS6110-P1和IS6110-P2,分别扩增361 bp和245 bp 两条带,来鉴别该检测菌株是否为结核分枝杆菌复合群。
引物序列:MTBl:ATAGGGAATGCTCGGCAAC;MTB2:CAACATCGACGCAGTACCC;IS6110-P1:TGAGGGCATCGAGGTGGC;IS6110-P2:GCGTAGGCGTCGGTGACAAA。
(三) “北京基因型菌株”鉴定
差异区域105(RD105)的缺失是北京基因型菌株所特有的[4],通过检验该区域的缺失来鉴定样本是否为北京基因型菌株,北京基因型菌株分型通过PCR对RD105缺失区进行扩增,扩增产物进行琼脂糖凝胶电泳,使用100 bp DNA ladder 作为分子量标志,在紫外灯下观察扩增片段长度,扩增产物在1495 bp的条带是非北京基因型菌株,786 bp条带的为北京基因型菌株。
(四)VNTR位点的选择
按照文献[5] 要求筛选MTB 7个VNTR基因位点,引物由复旦大学设计、北京康为世纪公司合成。引物序列见表1。
(五)MTB DNA模板的制备
将收集到的MTB阳性菌株接种于L-J培养基,37 ℃孵育培养2~4周至菌落生长,从固体培养基上刮取结核分枝杆菌 1~2 环重悬于400 μl TE 缓冲液 (pH值为8.0)中,80 ℃ 30 min灭活,煮沸10 min,13 400×g离心2 min,取上清,-20 ℃冷冻保存备用。
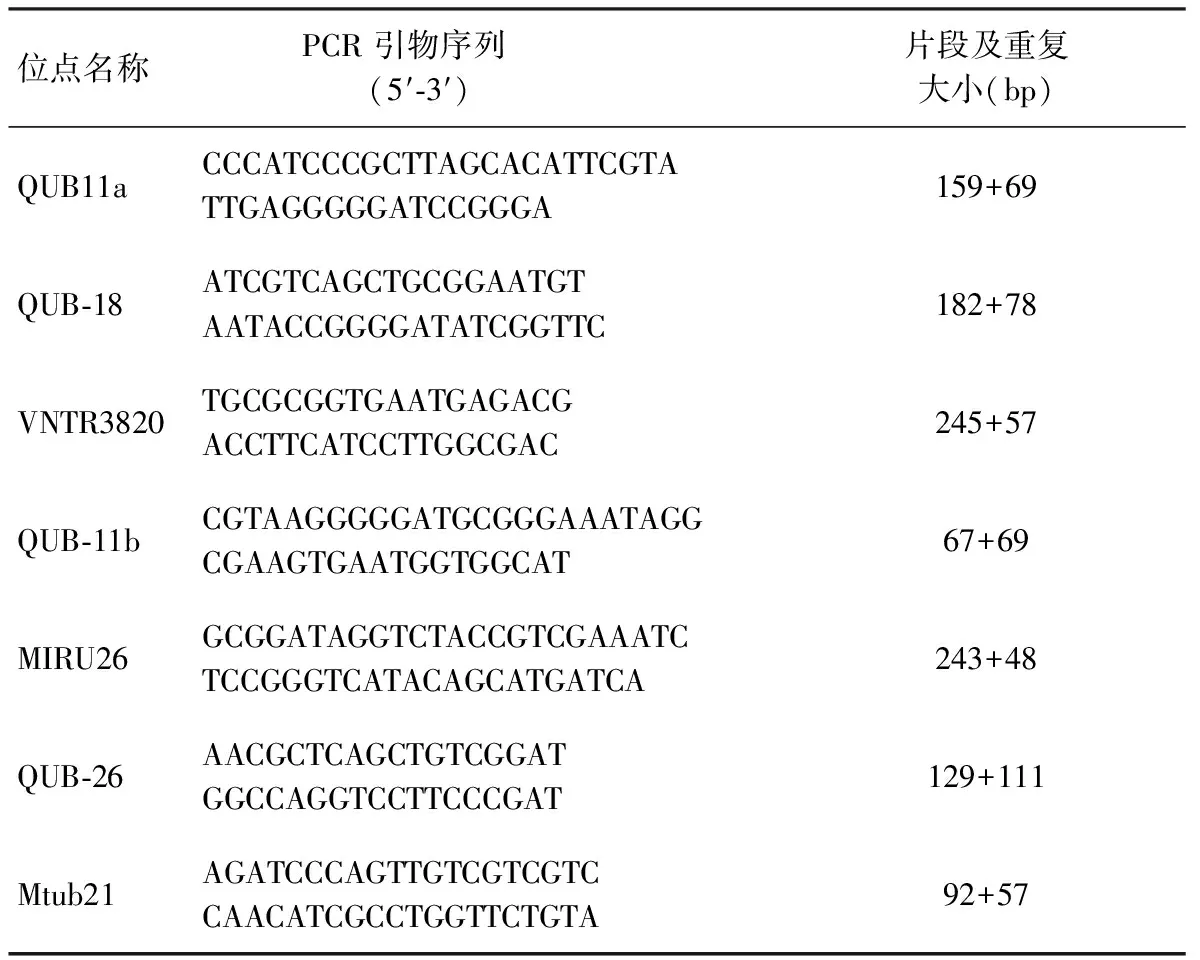
表1 MTB 7个VNTR基因位点的PCR引物序列
(六)PCR扩增
20 μl PCR反应体系中,模板DNA 1 μl,2×Taq PCR Master mix(北京康为世纪生物科技有限公司) 10 μl,ddH2O 8 μl,上下游引物各 0.5 μl。
扩增条件:除VNTR 3820位点的PCR扩增条件不同外,其他6个位点的PCR扩增条件均一致。
VNTR3820位点PCR扩增条件:预变性94 ℃ 5 min,然后94 ℃ 30 s,57 ℃ 30 s,72 ℃ 90 s,25个循环后,72 ℃延伸7 min。
其他6个位点PCR扩增条件:预变性94 ℃ 5 min,然后94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,25个循环后,72 ℃延伸7 min。
(七)琼脂糖凝胶电泳
PCR产物经2%琼脂糖凝胶[含4 μl/80 ml溴化乙锭(EB)DNA染料]恒电压(5 V/cm)电泳1.5 h,通过DNA Marker和H37Rv标准菌株的VNTR位点重复单元的重复次数作为标准参照,根据扩增片段大小计算出被测菌株VNTR 位点的重复单元数。
三、统计学处理
数据录入Excel 2003软件,采用SPSS 20.0软件进行统计学分析。北京基因型和非北京基因型菌株对一线抗结核药物的耐药率组间差异比较采用χ2检验,以P<0.05为差异有统计学意义。聚类分析先用Gel-Pro analyzer 3.1软件精确确定实验获得的每条DNA条带分子量大小,将指纹图谱数字化后,再根据每个特异性位点重复单元的大小及特异引物扩增产物边缘序列的长短进一步确定每个特异位点重复单元的重复次数,获得针对每个菌株的数字编码,在此基础上再运用Bionumerics 5.0软件进行聚类分析。聚类分析所获基因群按患者年龄、性别及治疗分类(初治与复治)进行分组,组间差异采用Fisher精确概率检验,以P<0.05为差异有统计学意义。
计算实验菌株成簇率:实验结果完全相同的菌株定义为一簇,成簇率为成簇菌株占总试验菌株的百分率,即:成簇率=成簇菌株数/总菌株数 × 100%。
Hunter-Gaston分辨指数(Hunter-Gaston Index,HGI):各个VNTR位点重复序列的总体分辨指数计算公式如下:
N为菌株总数,s为所有基因型数目,nj为第j个基因型的菌株数。HGI<0.3为分辨率低,0.3~0.6为分辨率中,>0.6为分辨率高。
近期感染率最小估计值计算公式如下:近期感染率=(nc-c)/n×100%;其中nc指成簇的菌株,c代表菌株成簇数,n代表菌株总数。
结 果
一、实验菌株对药物的敏感性及其与北京基因型的关系
本研究共纳入121株结核分枝杆菌菌株,其中北京基因型101株,占83.5%(101/121);非北京基因型20株,占16.5%(20/121)。121株菌株对异烟肼、利福平、乙胺丁醇、链霉素的耐药率分别为5.8%(7/121)、3.3% (4/121) 、5.0%(6/121)、15.7%(19/121)。其中北京基因型菌株对上述药物的耐药率分别为5.0%(5/101)、3.0% (3/101) 、5.9%(6/101)、17.8%(18/101);非北京基因型菌株对上述药物的耐药率分别为10.0%(2/20)、5.0% (1/20) 、5.0%(1/20)、未检出对乙胺丁醇耐药0.0%(0/20)。北京基因型菌株和非北京基因型菌株的总耐药率分别为31.7%(32/101)、20.0%(4/20),两者比较差异无统计学意义(χ2=1.090,P=0.296)。121株菌株中耐多药率为2.5%(3/121),其中2株为北京基因型,1株为非北京基因型。北京基因型和非北京基因型耐多药率分别为2.0%(2/101)和5.0%(1/20),两者比较差异无统计学意义(χ2=0.531,P=0.460)。见表2。
二、7位点VNTR基因分型技术检测结果
7位点VNTR基因分型技术检测结果表现为高度多态性,HGI值为0.513~0.786;7位点VNTR基因分型技术检测中,QUB11a、QUB-11b、VNTR3820 3个位点属于高分辨率位点, HGI值分别为0.786、0.672、0.637;其余4个位点QUB-26、QUB-18 、MIRU 26、Mtub21均为中等分辨率位点,HGI值分别为0.583、0.566、0.527、0.513。
三、聚类分析
由图1 可见,121株MTB经聚类分析后,分为3个大的基因群(Ⅰ群、Ⅱ群、Ⅲ群),81个基因型。其中Ⅰ群占14.9%(18/121),含15个基因型;Ⅱ群76.9%(93/121),含59个基因型,说明Ⅱ群为主要流行群;Ⅲ群占8.2%(10/121),含7个基因型。

图1 121株MTB菌株的聚类分析图
由表3 可见,7位点VNTR基因分型技术检测结果将121株MTB菌株分为17个簇和64个单独基因型,每个簇包括2~14株临床分离株不等,最大的簇由14株MTB菌株构成,所占比较高为11.6%(14/121), 121株MTB菌株中,成簇菌株57株,成簇率为 47.1%(57/121),近期感染率最小估计值为33.1%(40/121);其余64株菌株为单独基因型。
四、患者年龄、性别、初复治结核病与121株MTB菌株基因型的关系
121株MTB菌株经聚类分析分为3个大的基因群。按患者年龄、性别及治疗分类(初治与复治)进行分组,各组均以Ⅱ群为主,组间差异均未见统计学意义(表4)。
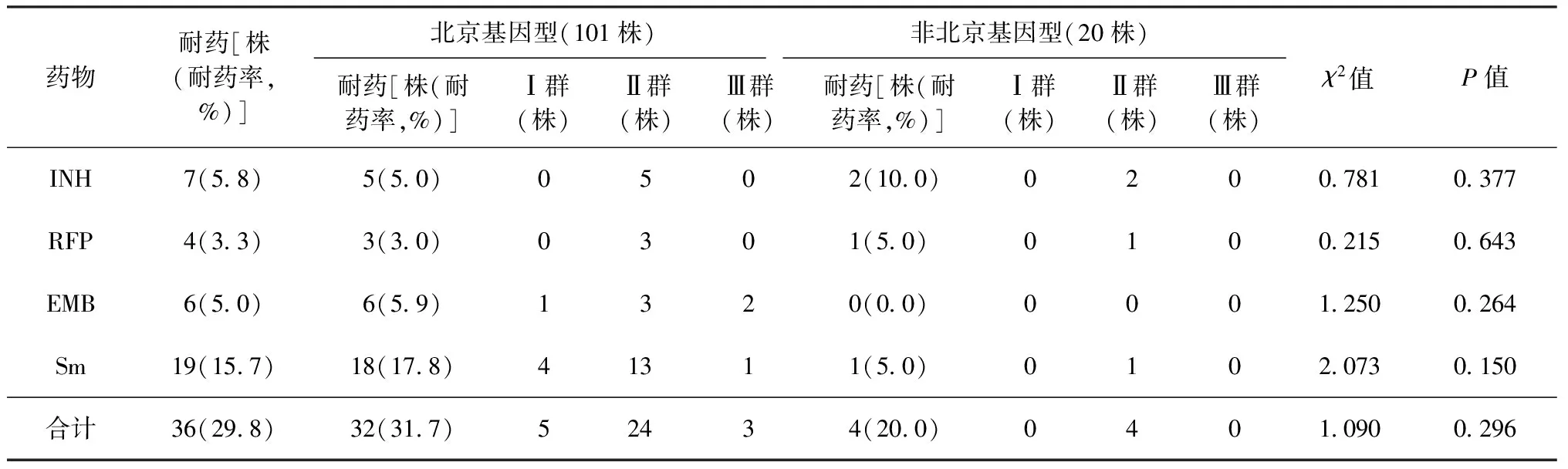
表2 121株MTB对不同抗结核药物的耐药性和VNTR特征分布

表3 121株MTB菌株的基因型分布情况
注近期感染率最小估计值=(nc-c)/n×100%。其中“nc”指成簇的菌株株数,“c”代表菌株成簇个数,n代表菌株总数。成簇率=成簇菌株数/总菌株数 × 100%
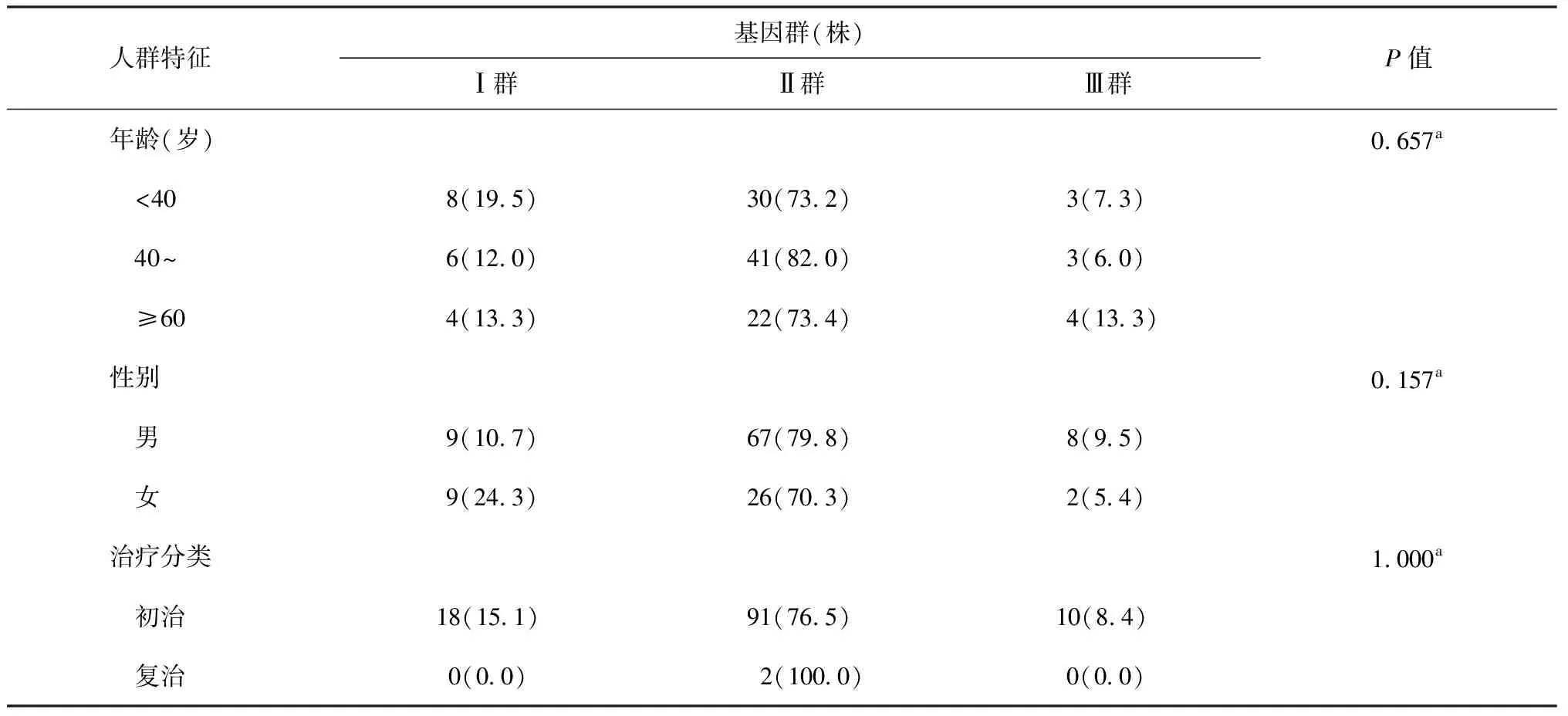
表4 不同人群特征与121株MTB菌株基因型的关系
注表中括号内数值为“构成比(%)”;a:Fisher精确概率检验
讨 论
基因分型方法研究结核病已经成为分子流行病学研究的一个热点,它能够初步判断结核病传播相关危险因素、预测可能的暴发流行、追踪传染源,以及区分结核病患者为内源性复发和外源性再感染等[6]。
我国是全球结核病高负担国家之一,北京基因型是我国的主要流行菌株,通过对 2007 年在全国 31 个省耐药基线调查收集的菌株研究结果显示,我国62.2%的MTB菌株为北京基因型[7];该型菌株在我国北方地区达到76.5%,南方地区为 53.2%[8]。本研究结果显示,121株结核分枝杆菌中北京基因型菌株有101株,占83.5%(101/121);非北京基因型菌株20株占16.5%(20/121)。由此可见,北京基因型菌株也是黑龙江省五常市主要流行株,这与目前大多数研究一致。
本研究北京基因型菌株和非北京基因型菌株的耐药率分别为31.7%(32/101)、20.0% (4/20),两者比较差异无统计学意义(P>0.05);北京基因型和非北京基因型耐多药率分别为2.0%(2/101)和5.0%(1/20),两者比较差异无统计学意义(P>0.05)。目前许多关于结核分枝杆菌在不同省份的分子流行病学的研究报告均显示北京基因型占主要的地位,但北京基因型的流行是否会引起结核病的耐药目前没有定论[9-12]。
VNTR 基因分型研究中,位点的选择很重要。国内多个课题组也在探索适合我国MTB流行菌株基因型特点的VNTR组合,但目前不同研究推荐的VNTR组合差异较大,最少仅有3个位点(QUB-11b、QUB26、QUB4156),最多的有24个位点,至今尚没有获得广泛认可的VNTR组合[13]。Zhang等[14]研究 45个 MIRU-VNTR位点在北京基因型菌株中的分型能力, 推荐了 VNTR-7和 VNTR-16位点两种分型方法;杨洪毅等[15]研究也表明VNTR-7位点与VNTR-16位点比较虽分辨能力略低, 成簇率较高, 但可以节约成本和缩短时间, 较适用于大规模调查或快速检测的初筛;7位点VNTR基因分型技术用于北京基因型的分析, 有较高的分辨能力, 操作简便, 适用于结核病控制工作中北京家族菌株占优势地区的分子流行病学研究。本研究采用了具 有较高分辨率的 7个VNTR 位点基因分型技术,结果显示其对黑龙江省五常市的 MTB 菌株有很高的分辨能力。
分子流行病学研究中,感染有相同基因型的MTB菌株具有“成簇性”,表明患者可能是近期被同一传染源所感染;而基因型表现为“唯一性”的未成簇MTB菌株,提示患者发病可能是由于内源性复燃所致,与周围环境的传播关系不大。本研究121株菌株中,成簇菌株57株,近期感染率最小估计值为33.1%(40/121),反映了这些成簇菌株在黑龙江省五常市形成了近期传播。本研究显示,121株MTB菌株经聚类分析分为3个大的基因群。按患者年龄、性别及治疗分类(初治与复治)进行分组,各组均以Ⅱ群为主,组间差异均未见统计学意义。成簇菌株和耐药菌株主要分布在Ⅱ群中所占比率最高,分别为49.5%(46/93)和77.8%(28/36),且Ⅱ群又以北京基因型菌株为多,后续要重点监控和追踪北京基因型菌株,确定耐药原因作为研究的重点。
本研究表明,7位点的VNTR基因分型技术对于黑龙江省五常市具有很好的分辨率,适用于开展对MTB的分子流行病学研究。后续研究将围绕上述菌株进行全基因组测序等工作,探究这些菌株传播的分子生物学机制。在此基础上,扩大样本量检测,结合其他分子生物学方法进一步对黑龙江省流行菌株及其他各型菌株的耐药性、耐药基因、耐药位点进行研究,在长期的抗结核治疗过程中,定期有效追踪 MTB 的药敏试验、确定耐药原因作为研究的重点,这对本地区有效防控结核病具有重要意义。
