结直肠癌发病相关的lncRNA筛选及GAPLINC对HCT116细胞的作用
2019-03-16罗育其温敏杰于海涛
罗育其 温敏杰 于海涛
广州市第一人民医院南沙医院普通外科(广州511457)
CRC患者的临床表现缺少特异性,主要表现为腹痛、便血和大便习惯改变,其确诊有赖于肠镜检查[1],但目前CRC的早期诊断率低,影响其治疗效果。lncRNA在表观遗传水平、转录水平和转录后水平上对基因的表达进行调控,具有重要的生物学意义,其异常表达往往与肿瘤的发生发展有关[2-3]。PCR基因芯片技术可实现对基因表达差异的高通量筛选,具有灵敏、可靠的特点,是研究肿瘤基因表达异常的有效工具[4]。因此,本研究拟根据文献报道,通过lncRNA PCR芯片筛选CRC相关差异性表达的lncRNA,并挑选差异表达较明显的lncRNA进行大样本的临床标本及功能验证。
1 材料与方法
1.1 临床标本准备
3对lncRNA PCR筛选标本和21例CRC组织标本均取自于2011年7月—2015年9月广州市第一人民医院普通外科患者手术标本,肿瘤组织取自非中央坏死部分,正常结直肠黏膜组织取自于距肿瘤边缘5 cm以上,标本-80℃低温保存。
1.2 lncRNA PCR芯片实验
组织标本的总RNA提取采用Trizol法,试剂盒购于Invitrogen公司,相关操作按试剂盒说明书进行。提取的总RNA的浓度和纯度送往上海英拜科技生物有限公司进行质检。根据文献报道、Emsable数据库、Reseq和UCSC基因浏览器内的相关资源,确定84个于人类肿瘤发病相关的lncRNA制备成lncRNA PCR芯片(由上海英拜生物科技有限公司合成)。将提取的RNA反转录为cDNA,所用的试剂盒为RT2 First Strand Kit(330401,Qiagen,Hilden,Germany),然后将cDNA溶于100μL的双蒸水中,在lncRNA PCR芯片上每孔滴加1μL的cDNA溶液进行实时定量PCR(Real-time quantitative PCR,RT-qPCR)检测,lncRNA PCR芯片上每个微孔中含有不同目的基因的引物,RT-qPCR反应采用RT2 SYBR Green Mastermix试剂盒(Qiagen,330401),所有操作均按试剂盒说明书进行,PCR的反应条件为:95℃,聚合酶激活/变性10min;95℃,15s扩增,60°C,1min收集荧光(40循环)。根据肿瘤标本和正常对照标本Ct值比较得出基因表达的差异。
1.3 21对临床标本验证GAPLINC的表达差异
经lncRNA芯片实验确定候选研究lncRNA GAPLINC后,在21对临床标本中利用RT-qPCR进一步验证其表达差异。总RNA的提取和反转录为cDNA的方法与上一步骤相同。通过Primer6软件设计引物,GAPLINC引物序列为:GAPLINC-F5'-GCTTCTCTGCGTTCACACAC-3';GAPLINC-R5'-TTCACAGAACTGCATACACATCA-3',由上海生工生物工程公司合成。RT-qPCR的的参数为:95℃,聚合酶激活/变性10min;95℃,15s扩增,60°C,1min收集荧光(40循环)。所得的Ct值除以内参基因GAPDH的Ct值,得到校正后的表达量。
1.4 HCT116细胞培养
实验所需的CRC细胞株HCT116购自于中科院上海细胞库,细胞置于含10%胎牛血清RPMI 1640培养基中,5%CO2和95%空气培养箱中培养;恒温37℃,湿度95%,培养瓶细胞生长融合75%~85%时传代,每天观察一次,隔天换液。
1.5 GAPLINC表达质粒和siRNA细胞转染
克隆GAPLINC全长序列到pcDNA3.0载体,由上海英拜生物科技有限公司完成;由上海吉码生物科技有限公司合成GAPLINC小干扰RNA(siRNA)。利用Lipofectamine™2000试剂盒进行细胞转染,转染siRNA前一天将细胞铺至六孔板中,每孔约2×105个细胞。24小时后,观察细胞密度达到80%~90%左右时,使用Lipofectamine™2000将目的siRNA及阴性对照siRNA转染进细胞中。用不含血清和抗生素的RMPI1640分别稀释Lipofectamine™2000、质粒和siRNA,常温孵育5min。将稀释好的质粒和siRNA和Lipofectamine™2000混匀,常温孵育20min。孵育好的混合物均匀滴加到孔板中。转染24~48 h后吸去培养基,用1×PBS洗三遍,彻底清除未转进细胞的质粒和siRNA,收获细胞,进行荧光定量PCR检测转染和沉默效率。
1.6 细胞迁移、侵袭(Transwell)实验
细胞迁移:实验前先将Transwell chamber(购于CORNING公司)放在37℃培养箱中温育,消化待测细胞,用PBS和无血清培养基先后洗一次,用无血清培养基重悬细胞,计数,调整浓度为2×105/mL。在下室(即24孔板底部)加入600~800μL含10%血清的培养基,上室加入100~150μL细胞悬液,放入培养箱。24 h后用镊子小心取出chamber,吸干上室液体,移到预先加入约800μl甲醇的孔中,室温固定30min。取出chamber,吸干上室固定液,移到预先加入约800μL结晶紫染液的孔中,室温染色15~30min。轻轻用1×PBS冲洗浸泡3次,每次5min,取出chamber,吸去上室液体,用湿棉棒小心擦去上室底部膜表面上的细胞;用小镊子小心揭下膜,底面朝上晾干,移至载玻片上用中性树胶封片;显微镜下取9个随机视野计数,统计结果。
细胞侵袭实验步骤同迁移实验,使用胶原包被好的chamber(transwell biocoat)。
1.7 细胞凋亡检测
将不同处理48 h后的各组细胞消化下来,使用预冷的PBS缓冲液洗细胞两次,再用1×Binding Buffer缓冲液制成1×106/mL的细胞悬液。流式试管中加入100μL细胞悬液,按下表加入5μL Annexin V与5μL核酸染料PI:

表1 细胞凋亡实验处理
轻轻混匀,室温避光处放置15min。各试验管中分别加入1×Binding Buffer缓冲液400μL。1小时内上流式细胞仪检测。根据检测结果统计PI+Annexin-V+细胞占所有细胞的百分比。
1.8 统计方法
结果采用均数±标准差表示,全部数据采用SPSS19.0统计软件分析,多组间均数比较采用方差分析;两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA PCR芯片检测结果
为了筛选CRC相关的lncRNA,本研究选用3例临床样本,取肿瘤组织(T)和癌旁对照组织(N),利用人lncRNA PCR芯片进行检测。总共观察了肿瘤相关的84个基因,结果提示有21个lncRNA在肿瘤组织中低表达,3个lncRNA在肿瘤组织中高表达,60个lncRNA表达无差异(图1)。在这些差异性表达的lncRNA中,GAPLNC在肿瘤组织中表达量增加(倍增数>3,P<0.05),且各样本中表达量相对稳定,因此选择GAPLNC为候选lncRNA,进一步研究其在CRC中的发生发展机制。
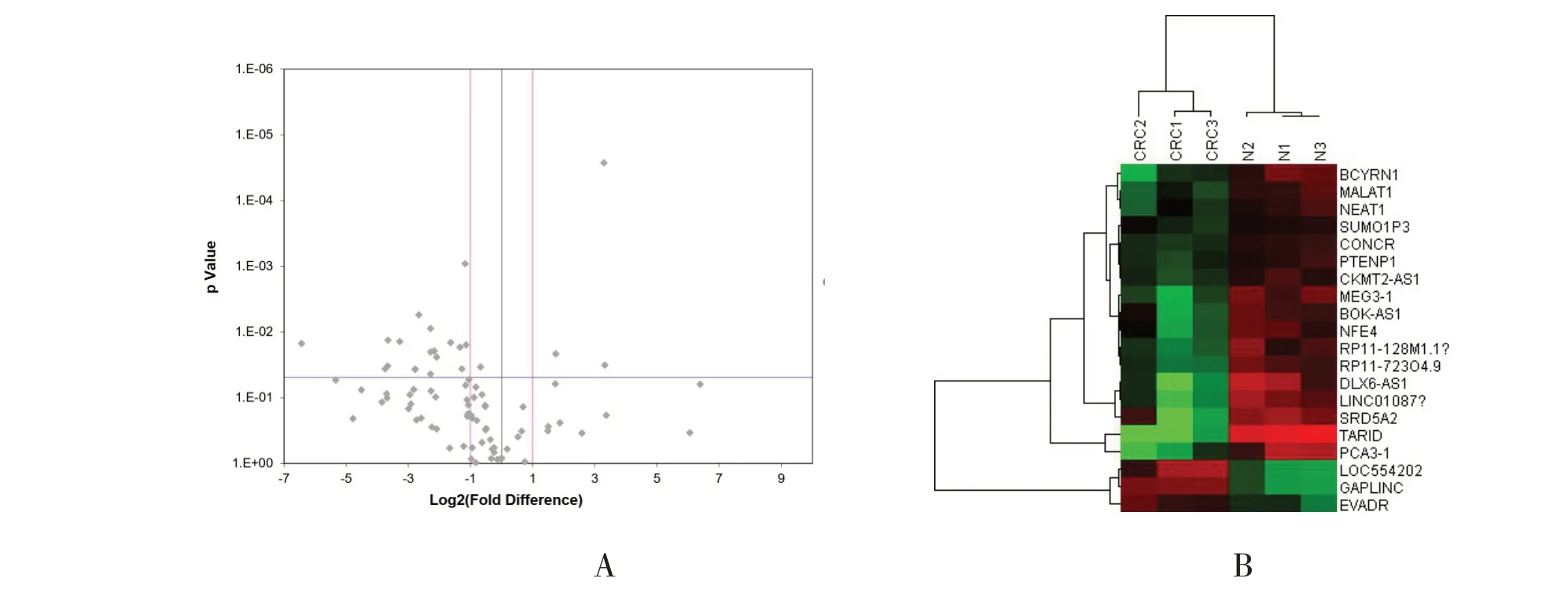
图1 lncRNA芯片各基因表达的差异(A 84个lncRNA的表达情况;B lncRNA表达差异的可视化热图,红色表示表达增加,蓝色表示表达减少。)
2.2 21对临床配对标本验证GAPLNC表达情况
为了进一步验证GAPLNC在CRC组织与癌旁正常对照组织表达差异,本研究选用21对临床样本进行验证,结果提示GAPLNC在肿瘤组织中表达增加(t=3.56,P=0.0013,图2A)。应用受试者工作特征曲线(receiver operating characteristic,ROC)评价正常组织和CRC组织的区分度,结果提示ROC曲线下面积(area under curve,AUC)为0.893,P<0.05,具有良好的敏感度和特异度(图2 B)。

图2 21对临床样本GAPLINC表达情况(A正常组织和肿瘤组织GAPLINC的表达差异;B GAPLINC的ROC曲线)
2.3 增加或抑制GAPLINC的表达对CRC细胞凋亡的影响
CRC细胞株HCT116转染GAPLINC表达质粒或siRNA后,RT-qPCR检测表明,GAPLINC在细胞内表达增高或降低(图3);将pCDNA3.1-GAPLINC转染HCT116细胞,处理48 h后用流式细胞术检测细胞凋亡程度,结果提示细胞凋亡受到明显抑制,与对照组相比,细胞凋亡比例降低,有统计学意义(4.1±1.1%vs 12.37±2.08%,t=6.08,P=0.0037,图3)。GAPLINC siRNA转染CRC细胞,RT-qPCR结果提示,siRNA抑制CAPLINC表达效果良好(图2);siRNA转染细胞48 h后,与对照组比较,流式细胞术检测提示CRC细胞凋亡比例显著增加(31.13±5.60%vs 12.37±2.08%,t=5.443,P=0.0055,图3)。

图3 HCT116细胞转染GAPLINC表达质粒和si RNA后GAPLINC的表达情况
2.4 增加或抑制GAPLINC的表达对CRC细胞迁移及侵袭能力的影响
HCT116细胞转染GAPLINC表达质粒后,与对照组比较,其细胞迁移、侵袭能力增高(图5),有统计学意义(表2),GAPLINCsiRNA转染细胞,实验结果表明,抑制GAPLINC表达后,CRC细胞迁移、侵袭能力得到抑制(图5,表2)。
3 讨论
CRC的治疗取得了长足的进步,目前仍采用手术治疗为主的综合治疗,术后的肿瘤复发是影响治疗效果的一个主要因素。对于Ⅰ和Ⅱ期患者而言,其5年生存率可达到75%~95%,而Ⅲ期患者5年生存率只有30%~50%。因此,为进一步改善CRC患者治疗效果,实现CRC的早期诊断显得尤为重要。目前可用来筛查诊断CRC的手段有限,而国内50%的CRC患者均为Ⅱ期以上,使CRC的治疗效果大打折扣。因此,探寻CRC特异的分子标志物、影响CRC发生发展的相关分子用于早期诊断或靶向治疗具有重要意义[5]。
基因的表达在各个层次受到各种分子物质的调控,lncRNA因其长度大于200 nt,具有与编码RNA类似的结构,可与同源DNA(转录lncRNA的基因及序列相似的基因)序列结合、亦可与同源RNA序列结合、还因其可折叠成复杂的二级结构,可以蛋白质相互结合,在基因表达过程中起着重要作用[6-7]。目前已有大量的lncRNA被证实可能与CRC的发生发展有关,如HOXB-AS3、lncRNA-422、CLMAT3及LOC554202等[8-9]。本研究结合文献报道,选择84个与肿瘤发生发展密切相关的lncRNA,制备lncRNA PCR芯片,进行CRC发病相关的lncRNA筛选。芯片实验结果表明,CRC组织中存在大量的lncRNA表达异常,84个lncRNA中有24个lncRNA存在差异性表达,有统计学意义,其中21个表达下降,3个表达增加。lncRNA在CRC表达差异主要表现为表达量降低;这些表达下降的lncRNA多具有抑癌基因的功能,如PCAT29具有抑制细胞分裂的作用;TARID可使肿瘤抑制因子TCF21去甲基化而发挥抑癌作用[8]
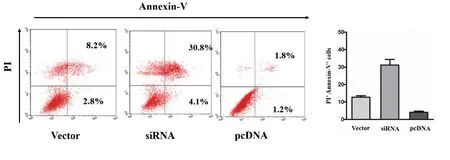
图4 HCT116细胞转染GAPLINC表达质粒后siRNA后细胞凋亡改变

图5 HCT116细胞转染GAPLINC表达质粒及siRNA后细胞迁移、侵袭能力的改变(HE染色,×400;A细胞迁移情况;B细胞侵袭情况)

表2 增加或抑制GAPLINC表达后HCT116细胞迁移和侵袭能力的改变
LncRNA PCR芯片筛选结果显示,GAPLINC在CRC组织表达稳定增高,被选定为下一步临床标本验证及功能实验的lncRNA。GAPLINC基因位于人类18号染色体短臂上,长924 bp,转录后RNA长度为643 nt[10]。研究表明,在常氧状态下,GAPLINC具有促进细胞生长及延缓死亡的作用,它还有助于细胞在缺氧状态下生存;Bcl-2/Bax比例是调节细胞凋亡的“分子开关”,GAPLINC通过结合miR-211抑制抗凋亡因子Bcl-2的表达,而沉默GAPLINC则增加Bax的表达,减少Bcl-2的量,进而使Bcl-2/Bax比例降低,促进细胞凋亡进程[11-12]。因此,GAPLINC具有促进胃癌细胞的增殖和侵袭,与肿瘤的分期及患者的预后不良密切相关[13]。本研究通过lncRNA芯片实验确定候选研究lncRNA为GAPLINC后,对其差异性的表达进行了大样本的临床标本验证,结果与胃癌组织类似,在CRC组织中GAPLINC亦高表达,构建ROC曲线,其AUC为0.892,有统计学意义,表明GAPLINC对区分正常组织和CRC组织具有良好的特异度和敏感度,也可利用其对CRC的癌组织及癌旁正常对照组织进行区分。此外,本研究实验结果表明,转染GAPLINC表达质粒增加GAPLINC在CRC细胞内表达后,CRC细胞细胞凋亡比例下降;此外,GAPLINC过度表达后,CRC的迁移、侵袭能力增强;相反地,构建siRNA转染CRC细胞抑制GAPLINC的表达后,CRC细胞的细胞凋亡比例增加,细胞迁移及侵袭能力减弱,这表明GAPLINC在CRC中发挥着促癌作用。因此,GAPLINC在CRC发生发展过程中可能起着重要的作用,具有潜在的临床意义。
