胸腺肽β4对H2O2诱导的兔角膜基质细胞氧化应激损伤及继发细胞凋亡的抑制作用△
2019-03-15刘菁华郝朋李轩
刘菁华 郝朋 李轩
角膜是人体重要的屈光介质,由于其位于眼球前部,直接与外部环境接触,因此较易遭受外界有害物质的侵害。氧化应激是指机体内氧化与抗氧化反应失衡导致产生过量的活性氧(reactive oxygen species,ROS),其中常见的ROS包括超氧阴离子(O2-)、羟基(·OH)及过氧化氢(H2O2)等。机体内ROS过量会对DNA、蛋白及脂肪酸造成一定的损伤[1]。有研究证实,在角膜损伤(如化学损伤、紫外线照射等)及部分角膜疾病(如干眼症、大泡性角膜病变等)的角膜组织中可检测到氧化应激反应标记物,且此时角膜的抗氧化能力减弱[2-4]。说明角膜在受到某些损伤及疾病侵害时发生了氧化应激并刺激角膜组织产生大量的ROS及一氧化氮,导致有毒物质增多,最终加剧角膜组织的损伤[5]。因此,缓解及修复角膜氧化应激损伤对部分角膜病及角膜损伤的治疗具有重要意义。
胸腺肽β4(thymosin β4,Tβ4)是胸腺肽家族的一员,在正常人体中的分布最为广泛。Tβ4作为一种肌动蛋白结合蛋白,其主要作用是通过与肌动蛋白结合来抑制激动蛋白与肌丝的结合[6]。现已有大量研究证实,Tβ4具有促进细胞迁移、促增殖、抗炎及抗凋亡的作用[7-9]。我们前期研究证实,Tβ4对体外培养的兔角膜上皮细胞的氧化应激损伤及继发凋亡具有抑制作用[10]。角膜基质层是组成角膜的主要部分,其结构的完整及功能的稳定对维持正常角膜功能至关重要,目前尚未有研究证实Tβ4对角膜基质细胞氧化应激损伤及继发凋亡有抑制作用。本研究使用体外培养的兔角膜基质细胞,应用H2O2诱导其发生氧化应激损伤,在此基础上探讨Tβ4对兔角膜基质细胞氧化应激损伤及继发凋亡的抑制作用。
1 材料与方法
1.1材料
1.1.1实验动物取清洁级健康成年新西兰大白兔(天津医科大学实验动物中心)5只,体质量2.0~2.5 kg,无眼部外伤及疾病,角膜屈光介质透明。实验动物的使用均遵循国家科学技术委员会颁布的《实验动物管理条例》。
1.1.2主要试剂及仪器主要试剂:Tβ4、DMEM/F-12细胞培养基、胎牛血清(fetal bovine serum,FBS)、青链霉素混合液(青霉素10×103U·mL-1,链霉素10×103μg·mL-1)(美国Gibco公司);2.5 g·L-1胰蛋白酶(美国Biotopped公司);细胞增殖/毒性检测试剂盒(cell counting kit-8,CCK-8)(日本DOJINDO研究所);活性氧检测试剂盒(北京索莱宝科技有限公司);TUNEL细胞凋亡原位检测试剂盒(美国Sigma公司);半胱氨酸蛋白酶-3(Caspase-3)ELISA检测试剂盒(南京建成生物工程研究所);总RNA提取试剂盒、实时定量PCR引物(北京赛百盛基因技术有限公司);MMLV逆转录酶、Taq DNA聚合酶(美国Promega公司);SYBR Premix Ex Taq Ⅰ(日本Takara公司)。主要耗材及仪器有:CO2培养箱(德国Heraeus公司);倒置相差显微镜(日本Nikon公司);酶标仪(美国Thermo公司);Realplex2荧光定量PCR仪(德国Eppendorp公司)。
1.2方法
1.2.1兔角膜基质细胞的培养采用空气栓塞法将大白兔处死后迅速摘出眼球。用生理盐水将眼球表面的血污及动物毛发仔细冲洗干净,之后将眼周组织剪去。显微镜下用眼科剪沿角巩膜缘内1 mm处剪下角膜,并使用含青链霉素混合液的PBS冲洗数次,浸泡15 min,后续操作严格遵守无菌原则。将浸泡后的角膜组织转移至体视显微镜下,使用无菌手术刀片将角膜上皮及内皮刮除干净,把剩余的角膜基质组织切成2 mm×2 mm的小块并转移至预先用FBS处理的细胞培养瓶中。30 min后组织块底部与培养瓶贴紧,加入含FBS、青链霉素混合液及泰乐菌素的DMEM/F-12培养液放入CO2培养箱(体积分数5% CO2,37 ℃)中培养。见有细胞从组织块周边迁出时,可将组织块移出并更换培养液继续培养。当细胞达80%~90%的细胞单层融合时,即可用胰蛋白酶消化细胞并传代。
1.2.2实验分组根据实验目的将细胞分为以下3组:正常组、H2O2组、治疗组。选取传代后处于对数生长期的兔角膜基质细胞,用不含FBS的DMEM/F-12培养液饥饿细胞过夜。为建立兔角膜基质细胞氧化应激模型,H2O2组细胞用200 μmol·L-1的H2O2处理4 h,随后更换为不含FBS的DMEM/F-12培养液继续培养细胞48 h。治疗组细胞则是在H2O2处理后换用含终浓度为1 μg·mL-1Tβ4的无FBS的DMEM/F-12培养液继续培养48 h。同时把按常规方法培养的兔角膜基质细胞设立为正常组。
1.2.3CCK-8法检测细胞活性采用CCK-8法检测各组细胞活性。将兔角膜基质细胞按10×106个·L-1的浓度接种于96孔细胞培养板中。24 h后细胞贴壁并基本单层融合,饥饿处理后分别处理各组细胞并再加设一空白组(空白组孔中不接种细胞,只有不含FBS的DMEM/F-12培养液)。按分组条件处理细胞后,弃培养液并向孔中加入CCK-8溶液(每孔100 μL),培养箱中孵育2 h,使用酶标仪在波长450 nm处读各孔吸光度(A490)值。细胞活性=(实验组A值-空白组A值)/(正常组A值-空白组A值)×100%,每个分组设6个复孔,重复3次。
1.2.42’,7’-二氯荧光黄双乙酸盐探针检测细胞ROS水平应用2’,7’-二氯荧光黄双乙酸盐探针检测各组细胞的ROS水平。以100×106个·L-1的浓度接种兔角膜基质细胞到24孔细胞培养板中进行培养,24 h后细胞贴壁并基本单层融合。饥饿处理后按分组条件分别处理各组细胞。用不含FBS的DMEM/F-12培养基按11000比例稀释2’,7’-二氯荧光黄双乙酸盐探针(稀释至10 μmol·L-1)制得探针稀释工作液。各组细胞按分组条件处理后,弃掉原培养液并向每孔加800 μL探针稀释工作液,将培养板放入CO2培养箱中孵育20 min。PBS洗涤细胞3次,将多余的探针洗去。显微镜下计数绿色荧光着染细胞数(488 nm激发波长,525 nm发射波长)。各组细胞ROS水平=视野内阳性细胞数/视野内细胞总数×100%。每孔取3个视野,每组设3个复孔,重复3次。
1.2.5实时荧光定量PCR检测细胞中过氧化氢酶和锰超氧化物歧化酶mRNA的相对表达量根据需检测的目标基因序列合成扩增所需引物(见表1)。按500×106个·L-1的密度接种角膜基质细胞于6孔细胞培养板中进行培养,24 h后细胞贴壁且基本单层融合。饥饿处理后根据分组条件分别处理各组细胞。按总RNA提取试剂盒说明书提取细胞总mRNA,逆转录合成cDNA并于-20 ℃保存。实时荧光定量PCR反应体系如下:SYBR Green 10.0 μL、无菌去离子水8.0 μL、10.0 μmol·L-1的上下游引物各0.5 μL 及cDNA 1.0 μL。按以上体系使用荧光定量PCR仪将各组cDNA进行扩增,采用两步法,以GAPDH作为内参基因,应用2-ΔΔCt法计算各组细胞目标基因的相对表达量。反应步骤为:95 ℃预变性3 min,95 ℃变性15 s,62 ℃退火延伸45 s,共45个循环。熔解曲线分析条件为:95 ℃反应15 s,60 ℃反应1 min,95 ℃反应15 s,最后4 ℃冷却降温。每组设3个复孔,至少重复3次。
表1相关引物序列

引物名称上游引物序列下游引物序列GAPDH5’-CCACTTTGTGAAGCTCATTTCCT-3’5’-TCGTCCTCCTCTGGTGCTCT-3’过氧化氢酶5’-CTGTTCATCCAGAAGAAAGC-3’5’-CTGCACAAACGTGTGAATCG-3’锰超氧化物歧化酶5’-TATTCCACTGCTGGGGATTG-3’5’-ACATTCTCCCAGGTGATCAC-3’
1.2.6TUNEL染色检测细胞凋亡率采用TUNEL染色检测各组细胞的凋亡水平。按100×106个·L-1在24孔细胞培养板中接种细胞进行培养,24 h后细胞贴壁并基本单层融合。饥饿处理后按分组条件分别处理各组细胞。室温条件下用40 g·L-1多聚甲醛固定细胞1 h,含体积分数3%H2O2的甲醇封闭细胞20 min,在2~8 ℃条件下含体积分数0.1%Triton X-100的1 g·L-1柠檬酸钠通透细胞3 min。按试剂盒说明书配制TUNEL工作液并加入孔中,37 ℃条件下暗室加湿反应1 h。PBS洗净多余TUNEL工作液,观察前用10 μg·mL-1DAPI(4’,6-二脒基-2-苯基吲哚二盐)对细胞核进行染色。显微镜下计数绿色着染的阳性细胞个数。细胞凋亡率=视野中阳性细胞个数/视野中细胞总数×100%。每组设3个复孔,每孔选取3个视野,重复3次。
1.2.7ELISA法检测细胞中Caspase-3蛋白的表达将兔角膜基质细胞按500×106个·L-1的浓度接种于6孔细胞培养板中进行培养,24 h后细胞贴壁且基本单层融合。饥饿处理后按分组条件分别处理细胞。严格按照说明书要求进行操作,按说明书要求制备细胞提取液,将细胞提取液、浓度梯度稀释标准品及相关抗体药品加入包被了抗体的检测板中,孵育后使用酶标仪450 nm读值(A450),570 nm下读校准值(A570)。将各组校准后A值(A450-A570)代入标准曲线中,计算得到各组Caspase-3的质量浓度。每组设3个复孔,重复3次。
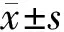
2 结果
2.1兔角膜基质细胞的形态细胞培养至第3天时,可见组织块周边有角膜基质细胞迁出,贴壁并逐渐延伸生长。移出组织块继续培养至7 d时,可见兔角膜基质细胞呈多角形。细胞呈单层融合时进行传代,传代后细胞生长状态良好,规则排列呈束状。
2.2各组细胞活性比较正常组细胞活性为(100.00±0.00)%、H2O2组(66.41±9.28)%、治疗组(82.54±7.72)%,3组间细胞活性总体比较差异有统计学意义(F=52.260,P<0.01)。组间两两比较,H2O2组细胞活性明显低于正常组,差异有统计学意义(P<0.01)。治疗组细胞活性明显高于H2O2组,差异有统计学意义(P<0.01)。
2.3各组氧化应激损伤情况分析结果
2.3.1各组细胞活性氧水平荧光显微镜下观察到各组细胞着染情况(图1),经计算得正常组细胞ROS水平为(4.12±0.93)%、H2O2组(77.84±6.98)%、治疗组(59.48±8.92)%。与正常组相比,H2O2组细胞呈现明显的强阳性着染。采用行×列χ2检验对3组细胞活性氧水平进行总体比较,差异有统计学意义(P<0.01)。两两比较结果显示,H2O2组细胞的ROS水平明显高于正常组,差异有统计学意义(P<0.01);治疗组细胞的ROS水平明显低于H2O2组,差异有统计学意义(P<0.01)。

图1 荧光显微镜下观察各组细胞着染情况(×10)。A:正常组;B:H2O2组;C:治疗组
2.3.2各组细胞内过氧化氢酶和锰超氧化物歧化酶mRNA的相对表达量三组细胞过氧化氢酶及锰超氧化物歧化酶mRNA的相对表达量总体比较,差异有统计学意义(F=8.918,P=0.001;F=11.975,P<0.01)。H2O2组细胞过氧化氢酶及锰超氧化物歧化酶mRNA的相对表达量较正常组均明显下降,差异均有统计学意义(均为P<0.05);治疗组细胞过氧化氢酶及锰超氧化物歧化酶mRNA的相对表达量较H2O2组均显著升高,差异均有统计学意义(均为P<0.05)。见表2。
2.4各组细胞凋亡情况分析结果
2.4.1各组细胞凋亡率正常组细胞凋亡率为(6.81±1.48)%、H2O2组(76.14±6.12)%、治疗组(39.04±7.47)%;经行×列χ2检验,结果显示3组细胞凋亡率总体比较,差异有统计学意义(P<0.01)。其中H2O2组细胞凋亡率明显高于正常组,差异有统计学意义(P<0.01);治疗组细胞凋亡率明显低于H2O2组,差异有统计学意义(P<0.01)。见图2。
表2各组细胞内过氧化氢酶和锰超氧化物歧化酶mRNA的相对表达量

组别n过氧化氢酶 mRNA锰超氧化物歧化酶 mRNA正常组31.00±0.001.00±0.00H2O2组30.59±0.37∗0.64±0.28∗治疗组32.16±1.37#2.06±1.07#F值8.91811.975P值<0.01<0.01
注:与正常组比较,*P<0.05;与H2O2组比较,#P<0.05
2.4.2各组细胞内Caspase-3蛋白的含量正常组细胞内Caspase-3蛋白的质量浓度为(0.46±0.09)ng·mL-1、H2O2组(0.95±0.08)ng·mL-1、治疗组(0.56±0.17)ng·mL-1。3组细胞内Caspase-3蛋白的质量浓度总体比较,差异有统计学意义(F=39.932,P<0.01)。组间两两比较结果显示,H2O2组细胞内Caspase-3蛋白的质量浓度较正常组明显升高,差异有统计学意义(P<0.01);治疗组细胞内Caspase-3蛋白的质量浓度明显低于H2O2组,差异有统计学意义(P<0.01)。

图2 荧光显微镜下观察各组细胞凋亡水平(×10)
3 讨论
角膜是人体最重要的屈光元件之一,可分为五层,其中角膜基质层主要由胶原纤维及角膜基质细胞构成,其厚度占整个角膜的90%,故角膜基质的透明度及正常结构直接影响到角膜的屈光视觉功能[11]。氧化反应是一种基本的生化反应,在正常机体衰老的过程中不可避免,在损伤或疾病的情况下机体局部氧化及抗氧化的平衡被打破,氧化应激产生的过量ROS会对局部组织造成损伤。本研究中,H2O2组细胞活力较正常组显著下降,说明一定浓度的H2O2对兔角膜基质细胞造成了一定的损伤,与此同时,我们应用2’,7’-二氯荧光黄双乙酸盐探针对细胞内活性氧水平进行了检测。结果显示,与正常组细胞相比,H2O2组兔角膜基质细胞内ROS水平明显升高。因此说明兔角膜基质细胞经一定浓度H2O2诱导后发生了氧化应激反应并对细胞造成损伤。
Tβ4因其促进伤口愈合、抗炎及抗凋亡的作用而成为治疗很多疾病的新选择。本研究发现,治疗组兔角膜基质细胞在加入一定浓度的Tβ4之后,细胞活性较H2O2组有显著提高,且其ROS水平与H2O2组相比较也有了显著的下降,证明Tβ4能有效清除细胞内因氧化应激产生的ROS,于是我们对其清除ROS的可能机制进行了进一步探讨。正常角膜基质层功能的维持与角膜上皮细胞、基质细胞和内皮细胞在基质外环境中分泌的相关蛋白及细胞因子有关。过氧化氢酶和锰超氧化物歧化酶为机体内主要的过氧化物酶,可以分解过氧化物从而达到抗氧化的作用。有研究证实,在人角膜上皮细胞的氧化应激模型中,过氧化氢酶和锰超氧化物歧化酶mRNA的相对表达量下降,而Tβ4可上调二者的表达[12]。我们在兔角膜基质细胞氧化应激模型中也检测了过氧化氢酶和锰超氧化物歧化酶mRNA的相对表达量,结果显示H2O2组细胞中过氧化氢酶和锰超氧化物歧化酶mRNA的相对表达量较正常组均显著下降,说明细胞内氧化及抗氧化的平衡被打破且无法代偿,而在Tβ4治疗组细胞中,过氧化氢酶和锰超氧化物歧化酶mRNA的相对表达量较H2O2组升高,提示在兔角膜基质细胞的氧化应激损伤模型中,Tβ4亦可上调过氧化氢酶和锰超氧化物歧化酶的表达,从而帮助机体加快清除过氧化物以减轻损伤。
除此之外,本研究还发现经TUNEL染色后,H2O2组细胞凋亡率较其他组显著增高,说明H2O2诱导产生的氧化应激反应使细胞继发凋亡。经Tβ4处理后,治疗组细胞凋亡率显著下降,证实了Tβ4的抗凋亡作用。目前大量研究表明Caspase-3蛋白与细胞凋亡密切相关,是一种促凋亡因子[13-14]。为探讨Tβ4在角膜基质细胞中的作用机制,我们检测了各组细胞中Caspase-3的蛋白浓度,结果显示与正常组相比,H2O2组的兔角膜基质细胞Caspase-3蛋白的质量浓度明显升高,而治疗组细胞的Caspase-3蛋白质量浓度与H2O2组相比显著下降,该结果与TUNEL染色的结果相符。说明H2O2组细胞因Caspase-3蛋白的表达上调造成细胞凋亡,而Tβ4可有效下调细胞内Caspase-3蛋白的表达从而抑制细胞凋亡。
综上所述,经一定浓度H2O2处理后可使体外培养的兔角膜基质细胞发生氧化应激反应并进一步继发细胞凋亡。Tβ4可有效减轻兔角膜基质细胞氧化应激损伤并抑制细胞凋亡,该作用与Tβ4对细胞内Caspase-3、过氧化氢酶和锰超氧化物歧化酶表达的调节有关,但调节涉及的具体通路还需进一步研究。
