白介素1受体相关激酶1(IRAK1)和NF-κB在苯扎氯铵诱导的干眼症小鼠角膜和结膜组织中的表达△
2019-03-15杜婧李勇高金荣刘建国李晶魏升升
杜婧 李勇 高金荣 刘建国 李晶 魏升升
干眼症,又称角结膜干燥症,是一种由多种因素引起的泪液和眼表疾病,主要表现为由泪液质和量或动力学异常引起的泪膜稳定性下降和眼表损害,伴有眼部干涩、红肿、异物感等眼表不适和视力障碍[1]。干眼症多发于60岁以上的女性,其病因和临床表现各异,发病机制尚不明确。目前临床上主要应用泪液替代品缓解患者干眼症状,但均不能有效根治干眼症[2]。炎症反应、细胞凋亡、性激素水平变化等均与干眼症的发生相关,其中炎症反应被认为是干眼症发病机制中最为重要的因素[3-4]。
白介素-1受体相关激酶1(interleukin-1 receptor-associated kinase 1,IRAK1)是一种丝氨酸-苏氨酸激酶,具有介导Toll样受体(toll-like receptors,TLR)和IL-1信号通路的作用,这些信号通路对调控免疫应答和炎症过程至关重要。IRAK家族成员IRAK4与接头蛋白MyD88结合后进一步吸引IRAK1结合至该复合体上,IRAK1被IRAK4磷酸化后高度活化,从该复合体上解离,结合并促进肿瘤坏死因子受体相关因子TRAF6磷酸化,进而活化下游NF-κB、MAPK等信号通路[5]。本研究探讨IRAK1和NF-κB在苯扎氯铵诱导的干眼症小鼠角膜和结膜组织中的表达,为研究干眼症的炎症机制和治疗提供依据。
1 材料与方法
1.1材料
1.1.1实验动物及分组选取6~8周龄SPF级雄性C57BL/6小鼠60只,由空军军医大学动物实验中心提供。裂隙灯显微镜下检查小鼠眼部无异常、泪液分泌量正常。实验前适应性饲养1周,饲养条件:清洁、通风、温度为23 ℃±1 ℃,相对湿度为45%±5%,12 h昼/夜交替,常规饲料喂养。将小鼠分为对照组(15只)和干眼症模型组(45只)。对照组小鼠不做处理,干眼症模型组小鼠用苯扎氯铵诱导建模。
1.1.2主要试剂苯扎氯铵(美国Sigma公司),泪液检测酚红棉线(天津晶明新技术发展有限公司),荧光素钠注射液(广西梧州制药股份有限公司),抗小鼠IRAK1和NF-κB/p65单克隆抗体(美国Abcam公司),AlexaFluor®594荧光标记二抗、TRIZOL试剂(美国Invitrogen公司),First Strand cDNA逆转录试剂盒和qPCR试剂盒(日本Takara公司),PCR引物由西安擎科泽西公司合成。
1.2方法
1.2.1干眼症小鼠模型建立向干眼症模型组小鼠双眼各滴入5 μL 0.75 g·L-1的苯扎氯铵溶液,每天2次,持续7 d,诱导小鼠干眼模型。实验开始后1周、2周和4周分别在裂隙灯下观察并记录小鼠眼表形态并进行后续实验。对照组小鼠在饲养4周时进行后续实验。
1.2.2酚红棉线法测定泪液分泌量给小鼠腹腔注射10 g·L-1戊巴比妥钠,使其麻醉固定,轻拉小鼠下眼睑暴露下结膜囊,将酚红棉线一端约1 mm置于下睑内侧1/3结膜囊内,15 s后取出,测量被泪液浸湿的酚红棉线红色部分长度,每眼重复测量3次取平均值并记录。测试完成后协助闭合小鼠眼,避免过度暴露及眼表刺激。
1.2.3泪膜破裂时间测量将1 μL 10 g·L-1液态荧光素钠滴至小鼠结膜囊并闭合眼睑使荧光素钠均匀涂布于角膜表面,在裂隙灯下通过钴蓝光观察,3次瞬目后,以最后1次瞬目后开始计时直至角膜出现第一个黑斑的时间即为泪膜破裂时间(break-up time,BUT),每眼重复测3次并计算平均值。
1.2.4角膜和结膜HE染色造模后1周、2周和4周时,在上述泪液动力学指标检测结束后处死干眼症模型组小鼠,每个时间点15只小鼠(对照组小鼠于实验结束时处死),4只用于HE染色,5只用于免疫荧光染色,6只用于PCR检测。迅速取下包括上下眼睑在内的整个眼球,40 g·L-1多聚甲醛固定24 h以上,常温下由低浓度至高浓度梯度酒精脱水各2 h,二甲苯透明后浸蜡、包埋,平行于眼轴方向切片,厚度为3 μm。按照操作说明书进行HE常规染色,染色后脱水透明,最后用中性树胶封片,光学显微镜下观察结膜和角膜组织的病理学变化。
1.2.5免疫荧光染色取新摘取的眼球组织,预冷生理盐水冲洗后用滤纸吸干表面水分,然后将眼球浸没于OCT包埋剂中并调整眼球位置,液氮迅速冷冻使其固化,-80 ℃保存备用。冰冻切片机上以6 μm厚度连续切片,然后贴附于载玻片上,室温下干燥约20 min,-80 ℃保存备用。染色时将切片取出晾干后置于冷丙酮中固定10 min。磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤3次后以体积分数为0.2% 的TritonX-100透膜20 min。PBS再次冲洗后用20 mg·mL-1牛血清白蛋白孵育封闭1 h。弃去封闭液,加入用10 mg·mL-1牛血清白蛋白稀释的IRAK1(1100)和NF-κB(1100)蛋白一抗,4 ℃孵育过夜。次日PBS浸洗组织切片3次后,加入AlexaFluor®594(1500)荧光标记二抗,室温下避光孵育1 h。PBS浸洗后用DAPI复染细胞核,荧光显微镜下观察拍照。
1.2.6qRT-PCR检测取新鲜分离的小鼠角膜和结膜组织剪成细小的碎片,匀浆后每20 mg组织中加入200 μL TRizol裂解液提取组织总RNA,测得RNA浓度和吸光度比值A260/A280为1.9~2.2。取 1 μg 总RNA利用TaKaRa逆转录试剂盒将其反转录成cDNA,并以其作为PCR扩增的模板。以GAPDH作为内参,各待测基因引物序列如下:IRAK1,上游引物:5’-GTACCGAGCAGTCATGAGAAATA -3’,下游引物:5’-AGCTGTTCCACCTCTGTTAAG-3’;NF-κB,上游引物:5’-GCTCAAGATCTGCCGAGTAAA-3’,下游引物:5’-GTCCCGTGAAATACACCTCAA-3’;IL-6,上游引物:5’-CTGCAAGAGACTTCCATCCAG-3’,下游引物:5’-AGTGGTATAGACAGGTCTGTTGG-3’;IL-1β,上游引物:5’-GAAGAAGAGACGGCTGAGTTT-3’,下游引物:5’-TCACTCTGGTAGGTGTAAGGT-3’;GAPDH,上游引物:5’-AACTTTGGCATTGTGGAAGG-3’,下游引物:5’-GGATGCAGGGATGATGTTCT-3’。应用SYBR Premix Ex Taq II试剂盒进行PCR扩增,反应条件为预变性94 ℃ 5 min;94 ℃变性10 s,60 ℃退火30 s,共40个循环;后延伸72 ℃ 10 min。每一个样品设置三个重复,利用2-ΔΔCt方法计算基因相对表达量。
1.3统计学分析采用均数±标准差表示检测数据,两样本均数比较采用独立样本t检验,用SPSS 19.0软件进行数据分析,以P<0.05为差异有统计学意义。
2 结果
2.1各组小鼠泪液分泌的变化干眼症模型组小鼠造模后1周和2周时,酚红棉线湿长降低,与对照组相比,差异均有统计学意义(均为P<0.05);造模4周时,酚红棉线湿长逐渐恢复,与对照组相比差异无统计学意义(P>0.05)。此外,干眼症模型组小鼠BUT在造模后1周和2周增加了1.2~1.3倍,与对照组相比差异均有统计学意义(均为P<0.05);而4周时,BUT降低至正常水平,与对照组相比差异无统计学意义(P>0.05)。表明苯扎氯铵诱导干眼症小鼠模型构建成功,且在造模后的1周和2周时,干眼症症状最为严重,而后逐渐缓解。见表1。
表1两组小鼠泪液分泌参数的变化

指标对照组干眼症模型组1周2周4周酚红棉线湿长/mm4.03±0.932.80±0.60∗2.96±0.46∗3.85±0.54BUT/s2.02±0.154.56±0.35∗4.67±0.64∗2.21±0.19
注:与对照组相比,*P<0.05
2.2各组小鼠结膜和角膜HE染色结果图1显示对照组和造模后不同时间点干眼症模型组结膜和角膜HE染色结果。可见与对照组小鼠相比,干眼症模型组小鼠结膜上皮细胞数增加,细胞排列欠整齐,同时伴有缺损;角膜上皮细胞排列紊乱、细胞数量明显增加,细胞形态不规则,细胞核小而扁平;角膜基质层胶原纤维排列紊乱、肿胀,成纤维细胞数增多且体积增大。对照组角膜上皮细胞、基质胶原纤维排列整齐。
2.3各组小鼠结膜和角膜组织中炎症因子mRNA表达水平干眼症模型组小鼠结膜组织IL-6 mRNA表达水平在造模后2周高于对照组,但差异无统计学意义(P>0.05);4周时表达量比对照组增加了1倍,差异有统计学意义(P<0.05);干眼症模型组小鼠角膜组织中IL-6 mRNA表达量在造模后2周高于对照组,差异有统计学意义(P<0.01)。干眼症模型组小鼠结膜组织中IL-1β mRNA在造模后1周和2周均高于对照组,差异均有统计学意义(均为P<0.05);4周时下降,与对照组相比差异无统计学意义(P>0.05);而角膜组织中IL-1β mRNA在造模后1~4周内均高于对照组,差异均有统计学意义(P<0.05)。见表2。
2.4各组小鼠眼部IRAK1表达和分布免疫荧光染色结果显示,对照组小鼠角膜组织中IRAK1主要表达于角膜基质层,上皮层细胞中IRAK1表达极微弱。干眼症模型组小鼠IRAK1在角膜基质层的表达在造模后1周和2周时均明显增加,同时1周时角膜上皮层IRAK1表达增加,2周时减少;而在造模后4周时IRAK1在角膜基质层和上皮层均仅有微弱表达(图2)。同时干眼症模型组小鼠角膜组织中IRAK1 mRNA的表达水平在造模后1周和2周时均高于对照组,差异均有统计学意义(均为P<0.05),4周时降低;而结膜组织中IRAK1 mRNA表达水平在造模后1周和2周时与对照组相比无明显变化(均为P>0.05),4周时低于对照组,差异有统计学意义(P<0.05)。见表3。
表2各组小鼠结膜和角膜组织中炎症因子mRNA的表达水平
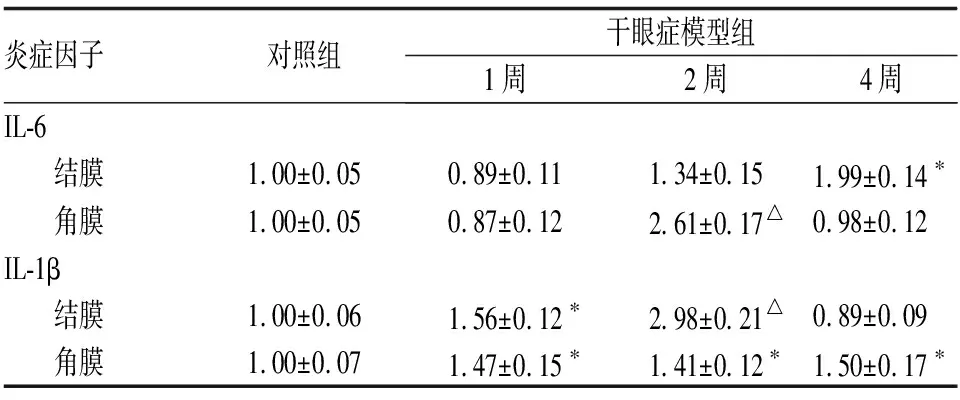
炎症因子对照组干眼症模型组1周2周4周IL-6 结膜1.00±0.050.89±0.111.34±0.151.99±0.14∗ 角膜1.00±0.050.87±0.122.61±0.17△0.98±0.12IL-1β 结膜1.00±0.061.56±0.12∗2.98±0.21△0.89±0.09 角膜1.00±0.071.47±0.15∗1.41±0.12∗1.50±0.17∗
注:与对照组相比,*P<0.05,△P<0.01

图1 对照组和不同时间点干眼症模型组小鼠结膜和角膜HE染色结果
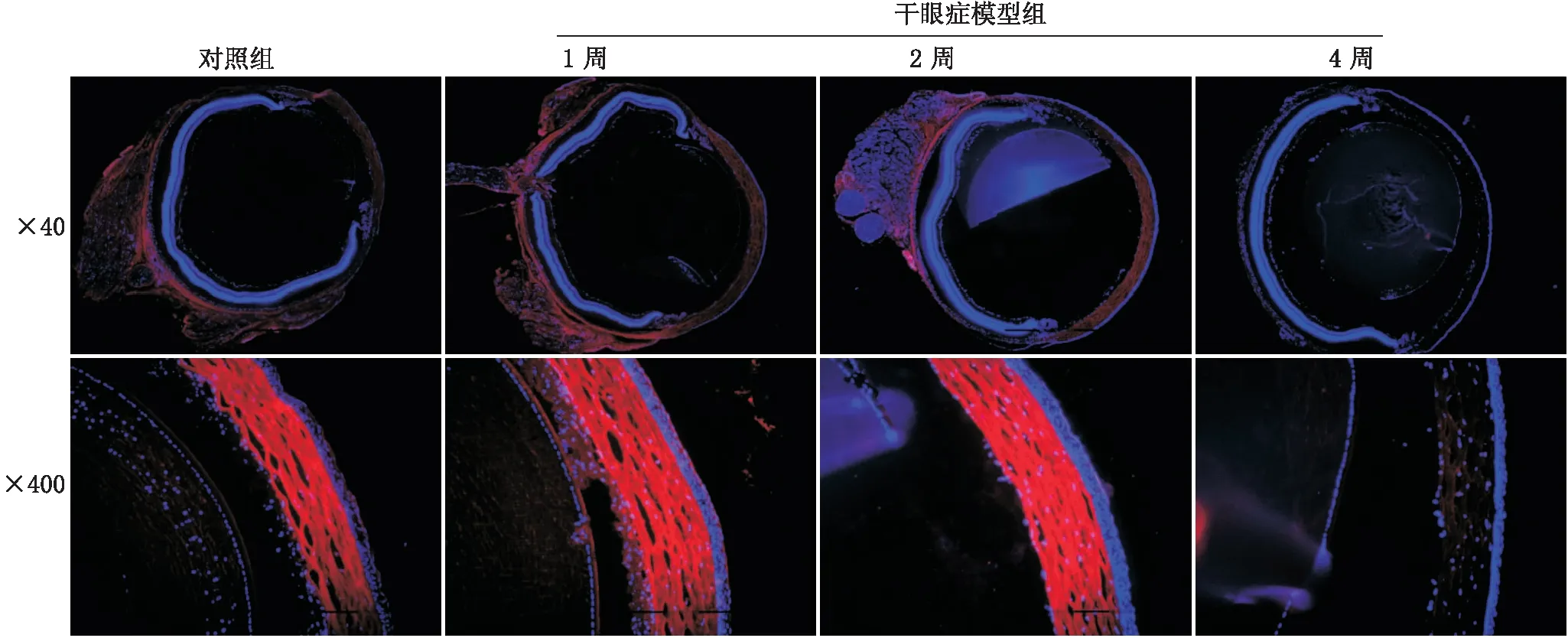
图2 对照组和干眼症模型组小鼠角膜组织IRAK1免疫荧光染色结果。红色示IRAK1,蓝色示DAPI
2.5各组小鼠眼部NF-κB的表达和分布免疫荧光染色结果显示,对照组小鼠角膜组织中NF-κB主要表达于角膜上皮细胞胞质中,在基质层中表达较少。干眼症模型组小鼠角膜组织中NF-κB在造模后1周和2周时也主要表达于上皮细胞中,且NF-κB逐渐发生核转位,在造模后2周时NF-κB在核中集聚明显,此时基质层中NF-κB也相对增加,而4周时NF-κB的表达几乎不可见(图3)。干眼症小鼠角膜组织中NF-κB mRNA表达水平在造模后1周和2周时均高于对照组,差异均有统计学意义(均为P<0.05),4周时降低;而结膜组织中NF-κB mRNA表达水平仅在造模后2周时高于对照组,差异有统计学意义(P<0.01)。见表4。

图3 对照组和干眼症模型组小鼠角膜组织NF-κB免疫荧光染色结果。红色示NF-κB,蓝色示DAPI
表3各组小鼠结膜和角膜组织中IRAK1的mRNA表达水平

组织对照组干眼症模型组1周2周4周角膜1.00±0.093.43±0.18△1.71±0.14∗1.13±0.12结膜1.00±0.080.99±0.150.98±0.120.29±0.17∗
注:与对照组相比,*P<0.05,△P<0.01
表4各组小鼠结膜和角膜组织中NF-κBmRNA表达水平

组织对照组干眼症模型组1周2周4周角膜1.00±0.063.81±0.18△1.82±0.12∗1.44±0.17结膜1.00±0.081.11±0.152.64±0.18△0.76±0.16
注:与对照组相比,*P<0.05,△P<0.01
3 讨论
干眼症的发病机制目前尚未明确,治疗手段也无法彻底改变干眼症慢性、反复发作的病程,所以从分子水平上探讨干眼症的发病机制将为干眼症的针对性治疗提供依据[6]。本研究发现,IRKA1和NF-κB在苯扎氯铵诱导的干眼症小鼠角膜和结膜组织中早期表达均增加,同时伴随有炎症因子水平的升高,证实IRKA1和NF-κB可能参与干眼症发生和发展过程。
目前建立干眼症动物模型的方法包括:营养因素剥夺、环境因素干扰、毒性物质和药物诱导、改变动物性激素分泌水平以及手术摘除泪腺等。虽然这些建模方法可以从多方面模拟人体干眼症的病理过程,但并没有一种方法能完全反映干眼症的复杂机制和病程[7]。本研究利用0.75 g·L-1苯扎氯铵诱导出蒸发过快型C57BL/6小鼠干眼症模型,这是目前应用较为广泛的一种方法。相关研究显示,苯扎氯铵滴眼造模方法易造成眼表上皮损伤,适合短期重度干眼症的造模,同时该方法造成的小鼠干眼症症状类似于人类干眼疾病,且相关组织病理改变也与人类干眼症接近,包括泪膜稳定性受损、眼表炎症、角膜上皮细胞凋亡以及杯状细胞丢失和鳞状上皮化生等[8-9]。
眼表(角膜、结膜和睑板腺)和主泪腺构成的眼表功能单位对泪膜起主要调控作用,干眼症发生时任何眼表功能单位都有可能受到影响[8]。本研究主要关注干眼症小鼠模型角膜和结膜组织中炎症相关分子的表达变化和潜在作用。IRAK1蛋白结构含有一个丝氨酸/苏氨酸激酶结构域,一个保守的死亡结构域以及一个长的C末端结构,其中死亡结构域介导其与接头分子MyD88的相互作用,在信号转导中执行重要功能,同时富含丝氨酸、苏氨酸和脯氨酸的结构域可促进其自身发生磷酸化、泛素化而降解[10]。IRAK1是最早发现的IRAK家族成员,最初被认为是IL-1信号通路中的重要成员。当前研究表明,IRAK1可被磷酸化、泛素化、类泛素化和乙酰化,因修饰不同而功能各异[11]。IRAK与人体多种炎性疾病和免疫缺陷性疾病的发生有关。本实验小鼠干眼症发展过程中,IRAK1的表达在苯扎氯铵造模后2周内明显增加,而在造模后4周时,仅有很微弱的表达。我们考虑造模后前2周增加的IRAK1参与角膜剧烈的炎症反应,而随着角膜干眼症状的减轻,IRAK1表达急剧下降,这可能与IRAK1发生自身降解从而防止过度的炎症反应有关,这可能是IRAK1调控炎症反应的一个重要负反馈调节机制。有报道显示,IRAK1在Sjögren综合征患者外周血单核细胞中的表达降低[12-13]。此外,本研究发现IRAK1的早期表达主要分布于角膜基质层中,上皮细胞中仅少量表达。角膜基质层约占整个角膜厚度的90%,是由基质细胞和细胞外基质构成的一种高度有序排列的致密结缔组织。角膜基质细胞是弥散分布于基质层之间的一群间充质细胞来源的静息细胞,能通过树枝状突起相互连接成细胞网络,并高表达晶状体球蛋白,活化后可转化为成纤维细胞,因而在角膜基质的结构维持及损伤修复中发挥重要作用[14]。高表达于角膜基质细胞中IRAK1有可能与角膜基质细胞的活化、炎症负反馈调节、角膜基质重建等过程有关,但由于角膜基质细胞在干眼症发生发展中的作用尚不明确,IRAK1在基质细胞中执行的功能仍需进一步探究。
IRAK1参与TLR和IL-1R两个受体家族的信号级联反应,IRAK1缺陷则抑制TLR7和TLR9活化后炎症因子IL-6、IL-12、TNF-α的产生[15]。TLR活化后与MyD88相互作用可直接募集IRAK1、IRAK4、TRAF6形成复合物,最终引起转录因子NF-κB和AP-1激活而引起炎症反应[16]。本研究发现NF-κB主要表达于正常角膜上皮细胞质中,而苯扎氯铵造模后的干眼症小鼠NF-κB发生核转移,证实NF-κB在炎症反应中的重要作用。同时在上皮层也有IRAK1的少量表达,推测上皮细胞的NF-κB可能与IRAK1活化诱导有关。
