小麦条锈菌效应蛋白Hasp58抑制植物免疫的功能分析
2019-03-15陈增菊汤春蕾赵梦鑫康振生王晓杰
陈增菊,王 婷,汤春蕾,赵梦鑫,康振生,王晓杰
(西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
小麦条锈菌(Pucciniastriiformisf. sp.tritici)为活体专性寄生真菌,其引起的小麦条锈病破坏性极强,给小麦生产造成重大损失[1-2]。效应蛋白由病原物分泌,可转运进寄主植物细胞内,通过改变寄主植物细胞的结构和代谢途径调控寄主的防御反应,促进病菌的成功侵染或触发寄主的防卫反应[3]。
病原真菌定殖于寄主植物后,被寄主的免疫系统识别,触发寄主植物的最初防御反应。病原相关分子模式(pathogen-associated molecular patterns,PAMPs )包括细菌的鞭毛蛋白、真菌细胞壁的几丁质等病原菌保守分子[4-5]。病原真菌与寄主植物接触后,其几丁质聚合物与植物细胞中的几丁质酶识别,触发寄主植物的第一道防御反应。类似于这类由模式识别受体(PRRs)触发的第一道防卫反应被称为PAMPs引起的免疫反应(PAMPs-triggered immunity,PTI)[6]。该过程使寄主植物产生一系列快速响应机制,包括活性氧及胼胝质等物质的积累,这些响应程序共同促进了抗菌化合物的积累,抑制病原菌的侵染[7]。
虽然PTI作为防止病原菌侵染的第一道屏障发挥着关键作用,但病原菌会产生相应的毒性因子使寄主植物感病。为了抵抗病原菌进一步侵染,寄主植物产生第二道屏障即效应蛋白诱导的免疫反应(effector-triggered immunity,ETI)。该免疫反应由抗病蛋白识别效应蛋白引起,触发寄主局部的细胞坏死或超敏(HR)等反应[8]。寄主植物自身可产生坏死阻遏病原菌蔓延,诱发寄主一系列的变化,激活下游防卫基因的表达,激发植株自身系统性获得抗性[9-10]。植物病原菌的许多效应蛋白均可抑制寄主植物的PTI或者ETI,说明病原菌效应蛋白对调控寄主免疫反应具有重要作用[11-13]。
由于小麦条锈菌毒性小种变异快,容易导致抗病品种抗病性“丧失”,造成病害流行,因而对小麦条锈菌毒性机制以及小麦与条锈菌互作机制的研究是目前亟待解决的问题[14]。本研究从小麦条锈菌吸器转录组中获得一个在吸器特异诱导表达的分泌蛋白(效应蛋白)基因Hasp58,在烟草细胞胞内瞬时表达该效应蛋白以明确其毒性功能;用烟草的细胞定位明确其空间表达特征;用细菌的三型分泌系统在小麦中瞬时表达该效应蛋白以明确其是否抑制植物免疫反应,了解效应蛋白Hasp58在条锈菌致病和生长发育过程中的毒性功能,为揭示该效应蛋白的致病机理及制定新的抗病策略奠定基础。
1 材料与方法
1.1 材 料
烟草品种为本氏烟(Nicotianabenthamiana),由西北农林科技大学植物保护学院吴云峰教授馈赠。小麦品种分别为携带抗病基因YrSu的水源11以及对条锈菌高度感病的明贤169;小麦条锈菌CYR23生理小种;工程菌株为大肠杆菌(Eschrichiacoli)JM109和Top10(LB 37 ℃培养);农杆菌菌株(Agrobactriumtumefacien)GV3101(LB 28 ℃培养);载体材料为重组马铃薯X病毒(PVX)载体pGR106和用于烟草细胞定位试验的pCAMNIA1302;均由本实验室保存。荧光假单胞菌菌株EtHAn(KB 28 ℃培养)和用于细菌III型分泌系统介导的小麦瞬时表达的pEDV6载体,由华盛顿州立大学Scot H. Hulbert教授馈赠。
1.2 小麦条锈菌 Hasp58的序列预测及扩增
使用SignalP 4.1 Server软件(http://www.cbs.dtu.dk/services/SignalP/)预测效应蛋白Hasp58的信号肽。用Primer Premier 5设计Hasp58相关引物(表1),以条锈菌生理小种CYR32侵染的小麦叶片的cDNA为模板分别扩增Hasp58相关序列。基因扩增体系为12.5 μL的2×Taq MasterMix(CWBIO),11.5 μL的H2O,0.5 μL的正向引物,0.5 μL的反向引物。扩增程序为95 ℃3 min;95 ℃30 s,55 ℃30 s,72 ℃ 2 min,40 cycles;72 ℃10 min。
1.3 载体构建及浸染烟草
以pGR106-Hasp58-F和pGR106-Hasp58-R扩增Hasp58全长;构建pMD18-T-Simple载体;用Cla I(Fermentas)和Sal I(Fermentas)对pGR106和含有目的基因的pMD18-T-Simple重组载体进行酶切,获得含有酶切位点的目的基因与pGR106;用T4 DNA Ligase将酶切开的目的基因与酶切开的pGR106连接,构建重组载体Hasp58-pGR106。重组载体电转至农杆菌感受态Gv3101及侵染烟草参照Rajput等的方法[15]。Avr1b-pGR106、GFP-pGR106、BAX-pGR106载体构建方法同Hasp58-pGR106载体构建。
1.4 效应蛋白Hasp58的烟草细胞定位分析
以pCambia1302-Hasp58-NcoI-F和pCambia1302-Hasp58-SpeI-R扩增Hasp58全长(编码蛋白为Hasp58),以pCambia1302-Hasp58-nosp-NcoI-F和pCambia1302-Hasp58-SpeI-R扩增Hasp58-nosp(未含有Hasp58信号肽序列,编码蛋白为Hasp58-nosp,为缺失信号肽缺失体),构建pCAMNIA1302重组载体Hasp58-pCAMNIA1302、Hasp58-nosp-pCAMNIA1302(载体构建方法同1.3),在烟草细胞中表达融合蛋白Hasp58-GFP、Hasp58-nosp-GFP。农杆菌感受态Gv3101的制备与转化及侵染烟草参照Cheng等[16]的方法。48 h后撕取烟草下表皮,0.8 mol·L-1山梨醇侵泡15 min进行质壁分离,OlympusBX-53荧光显微镜观察。
1.5 效应蛋白Hasp58对寄主PTI和ETI瞬时表达效应测定
以pEDV6-Hasp58(nosp)-F和pEDV6-Hasp58(nosp)-R扩增Hasp58-osp,构建pEDV6重组载体(Hasp58nosp-pEDV6)(载体构建方法同1.3)。重组载体转化至荧光假单胞EtHAn参照Cheng等[17]的方法。所得荧光假单胞EtHAn培养液用10 mM MgCl2溶液处理,处理方法参照Cheng等[17]的方法。将处理好的菌液用10 mM MgCl2溶液稀释至OD600为1.0,室温放置2 h。
1.5.1 胼胝质(Callose)积累的观察
用处理好的荧光假单胞菌EtHAn侵染小麦明贤169,25 ℃培养。24 h后采集叶片,用无水乙醇∶冰醋酸(1∶1)脱色液脱色、水饱和氯醛透明、0.05%苯胺蓝染液染色,荧光显微镜观察胼胝质积累。每个样品随机选取50个1 mm2的视野,统计胼胝质的点数,三次生物学重复。
1.5.2 活性氧积累、细胞坏死及条锈菌菌丝发育的观察
用处理好的荧光假单胞菌EtHAn侵染小麦水源11,24 h后接种条锈菌无毒性生理小种CYR23,接种后24 h、48 h采集叶片。
将所采集叶片于3,3-二氨基联苯(3,3′-diaminobenzidine,DAB)中光照6~8 h染色;浸泡于脱色液中脱色,在水饱和氯醛溶液中透明;显微镜观察H2O2积累和细胞坏死情况。每个样品统计30个侵染点,三次生物学重复。
将所采集叶片脱色、透明后,加入1.0 M的KOH溶液,121 ℃高压灭菌5 min,ddH2O冲洗2次,50 mM的Tris-HCl(pH 7.0)缓冲液浸泡30 min,WGA-Alexa 488荧光染料染色30 min,50 mM的Tris-HCl缓冲液和ddH2O冲洗,浸泡于50%甘油中保存,显微镜观察菌丝长度及菌落面积。每个样品统计30个侵染点,三次生物学重复。
2 结果与分析
2.1 Hasp58的序列分析
在吸器特异诱导表达的分泌蛋白(效应蛋白)基因Hasp58的cDNA序列全长1 026 bp(图1),编码342个氨基酸(图2)。使用Signal P 4.1 Server对Hasp58预测,发现其信号肽位于N端的1~26个氨基酸的位置(图2)。
2.2 Hasp58抑制细胞坏死的毒性功能分析
用携带重组载体(基因-pGR106)的农杆菌侵染烟草,24 h后注射入BAX(小鼠细胞调亡前体蛋白),6 d后照相。如图3所示,空载体PVX和eGFP为阴性对照,均不抑制坏死;大豆疫霉的Avr1b为阳性对照,抑制BAX诱导的坏死。效应蛋白Hasp58抑制BAX诱导的PCD,说明其具有潜在的毒性功能。

表1 试验用引物Table 1 Primers used in this test

图1 Hasp58的cDNAFig.1 cDNA of Hasp58

下划线部分为信号肽 The underlined part is the signal peptide.
图2Hasp58的氨基酸序列
Fig.2AminoacidsequenceofHasp58
2.3 Hasp58的烟草细胞定位分析
将缺失信号肽Hasp58-nosp和Hasp58分别与GFP在烟草细胞中融合表达。如图4,质壁分离后,GFP在烟草细胞细胞质及细胞核有分布,Hasp58-nosp-GFP和Hasp58-GFP均在胞质中分布,说明Hasp58定位在烟草细胞胞质。
2.4 Hasp58表达后寄主植物的胼胝质沉积分析
将Hasp58nosp-pEDV6在荧光假单胞菌EtHAn中表达后,细菌通过其三型分泌系统将Hasp58nosp分泌到小麦明贤169叶片中,胼胝质作为PTI的代表。胼胝质的分布情况如图5,统计结果如图6。DsRed和AvrRpt2分别作为阴性对照和阳性对照。如图6所示,与阴性对照dsRed对比,用含有重组蛋白Hasp58菌液处理的小麦明贤169,其叶片胼胝质点数显著性降低,说明该效应蛋白可以抑制小麦的PTI反应。

图3 Hasp58可以抑制BAX诱导的PCDFig.3 Hasp58 inhibits BAX-induced PCD

图4 Hasp58定位在胞质(红色箭头为质壁分离位点)Fig.4 Localization of Hasp58 in cytoplasm(red arrows indicate the plasmolysis sites)
2.5 Hasp58表达后寄主植物的活性氧积累、细胞坏死及条锈菌菌丝发育分析
同2.4,小麦条锈菌Hasp58及对照蛋白表达后,活性氧积累和细胞坏死面积统计结果如图8和图9,菌丝长度以及菌落面积大小如图10。同对照dsRed对比,注射效应蛋白Hasp58 48 h后,小麦叶片细胞坏死面积和活性氧积累显著减少,表明效应蛋白Hasp58可以抑制小麦的ETI反应。同对照dsRed相比,注射效应蛋白Hasp58 48 h后,条锈菌的菌丝面积显著性增加,注射该效应蛋白48 h和24 h后的菌丝长度及24 h后的菌丝面积均增加,表明效应蛋白Hasp58可以促进条锈菌的生长。

图5 荧光显微镜下AvrRpt2、dsRed和效应蛋白Hasp58的胼胝质积累(标尺:200 μm)Fig.5 Callose deposition of AvrRpt2,dsRed and effector Hasp58 under fluorescence microscope(bars:200 μm)

**:与dsRed差异在0.01水平显著。
**:Significant difference with dsRed at 0.01 level.
图6AvrRpt2、dsRed和效应蛋白Hasp58胼胝质积累差异
Fig.6DifferenceofcallosedepositsofdsRed,AvrRpt2andeffectorHasp58
3 讨 论
效应蛋白是一类由病原菌分泌的小分子蛋白,通过抑制寄主的免疫反应促其致病,是病原物侵染寄主的关键毒性因子。目前,许多病原物的效应基因被鉴定并确定功能,仅少数锈菌的效应基因被鉴定,被鉴定的锈菌效应蛋白主要来自亚麻锈菌等其他几种锈菌[18-19]。Hasp58为小麦条锈菌吸器特异诱导表达的分泌蛋白,为新挖掘的效应基因编码蛋白,研究其在小麦条锈菌致病过程中的作用可为制定新的抗病策略奠定基础。
BAX诱导产生的PCD与植物产生的HR相似,近年来被广泛用于效应蛋白的毒性功能研究[20-22]。本研究借助烟草瞬时表达系统,发现条锈菌效应蛋白Hasp58能够抑制烟草PCD,确定其潜在的毒性功能。

图7 效应蛋白Hasp58抑制小麦的ETI反应的组织学观察(标尺:200 μm)Fig.7 Histological observation of Hasp58 suppressing ETI(bars:200 μm)

*:Hasp58与阴性对照dsRed差异在0.05水平显著。下图同。
*:Difference between the Hasp58 and the negative control dsRed was significant at 0.05 level. The same in figures 9 and 10.
图8条锈菌效应蛋白Hasp58对小麦ETI反应活性氧积累的影响
Fig.8EffectofPsteffectorHasp58ontheaccumulationofactiveoxygeninETIreaction

图9 条锈菌效应蛋白Hasp58对小麦ETI反应HR积累的影响Fig.9 Effect of Pst effector Hasp58 on the accumulation of HR in ETI reaction
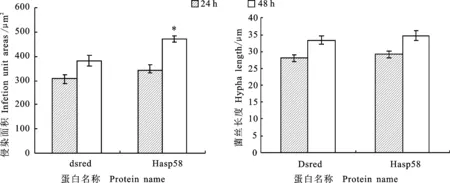
A:菌丝面积;B:菌丝长度。A:Hypha area; B:Hypha length.
病原菌效应蛋白分为胞内效应蛋白和胞外效应蛋白,胞内效应蛋白可以被转运进寄主细胞中发挥功能[23]。含有RXLR和CRN基序的卵菌效应蛋白可以转运进寄主细胞胞内[24]。本试验通过烟草的细胞定位实验确定Hasp58定位在植物细胞胞内,说明其在细胞胞内定位并具有潜在的转运功能。
PTI是病原分子相关模式诱导的免疫反应,为先天抗病性,是寄主防御病原物的第一层屏障。卵菌和细菌的许多效应基因均可以通过不同的机制抑制寄主的PTI[25-26]。细菌的某些效应基因编码效应蛋白的靶标为PTI防卫信号通路的相关蛋白[27]。小麦条锈菌效应蛋白PSTha5a23在小麦与条锈菌互作中抑制寄主的PTI[17]。Hasp58为条锈菌吸器分泌蛋白,说明病原菌已经突破寄主的第一道屏障,产生吸器,分泌Hasp58发挥功能。本研究结果表明,Hasp58可抑制寄主的PTI,这可能是因为Hasp58在突破寄主第一道屏障前通过靶标病原物的相关蛋白传递信号,发挥抑制寄主PTI的毒性功能。
ETI是寄主防御病原物的第二层屏障,病原物的效应基因编码产物可以通过靶标相关蛋白,激活相关信号通路,抑制寄主的ETI反应[12,28]。本研究发现,Hasp58可以抑制寄主的ETI并促进自身侵染,推测其可能通过靶标寄主防御信号通路的蛋白发挥其抑制寄主ETI的毒性功能。本研究结果可为揭示小麦条锈菌致病机理及制定防治小麦条锈菌策略奠定基础。
