微小RNA-29a及细胞基质金属蛋白酶2在脓毒症中的作用▲
2019-03-14龙春艺廖品琥
陈 翔 黄 莹 龙春艺 廖品琥
(右江民族医学院研究生院,广西百色市 533000,电子邮箱:chenxiang8667@163.com)
脓毒症是感染引起的全身炎症反应综合征,其发病率及病死率均高,已成为ICU的首要问题[1]。脓毒症的主要病理机制为:促炎反应与抗炎反应的失衡,导致细胞外基质(extracellular matrix,ECM)的重塑,并进一步造成细胞损伤[2]。但其具体机制尚未完全阐明。金属蛋白酶(matrix metalloproteinase,MMP)是一类可以降解ECM的蛋白酶家族,其中MMP-2可以通过分解ECM的主要成分Ⅳ型胶原和明胶,参与ECM重塑[3]。在血清中MMP-2水平与脓毒症预后之间存在相关性[4]。
微小核糖核酸(micro ribonucleic acid,miR)直接或间接参与脓毒症的发生发展,可以作为脓毒症诊断标志物和治疗靶标[5]。其中miR-29a可以通过广泛抑制纤维蛋白酶原和调控ECM相关基因表达,参与肝硬化等疾病进程,而纤维蛋白酶原与细胞和ECM发生黏附密切相关[6],提示miR-29a可能参与调控细胞增殖和黏附。然而miR-29a在脓毒症中的作用和潜在机制尚不清楚。
迄今为止,尚无文献明确报告关于miR-29a和MMP-2在脓毒症患者血清和细胞模型中表达水平及相关性。本研究通过探讨miR-29a和MMP-2在脓毒症发生发展中的作用,探索miR-29a的可能调控机制,为临床诊断和治疗脓毒症提供理论依据。
1 材料与方法
1.1 血清标本来源 选择2017年9月至2018年3月在右江民族医学院附属医院ICU治疗的40例脓毒症患者(脓毒症组),均符合脓毒症3.0诊断标准[1],其中男性23例,女17例,年龄(45.97±16.40)岁。另选同期在该院体检的40例健康者作为对照组,其中男性21例,女性19例,年龄(44.93±17.30)岁。两组的年龄、性别比较,差异无统计学意义(P>0.05)。本研究经我院伦理委员会批准同意,患者及家属对研究知情并签署同意书。
1.2 仪器与试剂 DU530型超微量紫外分光光度计购自德国Beckman公司,ABI 7500型实时荧光定量聚合酶链反应仪购自美国 Bio-Rad 公司,Multiskan MK3型酶标仪购自美国Thermo Fisher Scientific公司,伯乐1658001型Western 电泳仪及转膜仪购自美国 Bio-Rad公司,JS-680B型全自动凝胶成像系统购自上海培清科技有限公司。MMP-2酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国R&D公司(批号:000257),杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)购自美国Gibco公司(批号:10099-141),细胞增殖检测试剂购自美国Thermo Fisher Scientific公司(批号:U87654),PCR引物、血清miR提取试剂盒、反转录试剂盒和荧光定量试剂盒均购自北京天根科技公司(批号:DP503、KR201、FP411),miR-29a抑制剂、模拟物和对照物购自上海吉码公司(批号:1307028、1307046、1307021),脂质体2000购自美国Thermo Fisher Scientific公司(批号:11668-027),细胞裂解液购自索莱宝生物公司(批号:PC0019),MMP-2一抗购自美国Abcam公司(批号:AB86607)。RAW 264.7细胞购自上海中国科学院细胞库。脂多糖购自美国Sigma公司(批号:1010A032)。
1.3 血清MMP-2蛋白及血清miR-29a表达水平的检测 使用乙二胺四乙酸抗凝管采集脓毒症组(于治疗前检测)及对照组研究对象的静脉血5 ml,置于离心机4℃、3 000 r/min离心15 min,取上层血清置于1.5 ml EP管,4℃、12 000 r/min离心30 min后,将上层血清转移至另一1.5 ml EP管中,置于-80℃冰箱保存。按照ELISA试剂盒说明书检测血清MMP-2表达水平。取200 μl血清,用离心柱法提取总RNA,按照试剂盒说明书进行反转录和荧光定量PCR。以U6为内参, 采用2-△△Ct法进行分析。
1.4 MMP-2的生物信息学分析 应用靶基因预测软件 TargetScan7.1(http://www.targetscan.org/)及miRanda(http://www.miranda.org/)对MMP-2靶基因进行预测,取任两者预测数据交集再结合miTarbase(http://mirtarbase.mbc.nctu.edu.tw/)中已经证实的靶基因用于后续分析。
1.5 过表达miR-29a的RAW 264.7细胞增殖情况 取对数生长期的RAW 264.7细胞,以4×103个/200 μl接种于96孔板中,用含10%胎牛血清的DMEM培养基于37℃、5% CO2条件下培养12 h。将细胞分为miR-29a对照物组和miR-29a模拟物组,在培养孔中分别加入miR-29a对照物/脂质体2000混合液、miR-29a模拟物/脂质体2000混合液,转染6 h后弃去培养液。每组设3个复孔,分别于干预21 h、45 h、69 h、93 h时加入10 mg/ml的CCK-8 试剂10 μl,3 h后即干预结束时(共干预24 h、48 h、72 h、96 h)弃液,每孔加入100 μl二甲基亚砜,静置孵育30 min,于490 nm波长下测定每孔的吸光度(A)值。
1.6 不同浓度脂多糖刺激下RAW 264.7细胞MMP-2表达情况 取浓度为0 μg/ml、 1 μg/ml、5 μg/ml、10 μg/ml脂多糖分别刺激RAW 264.7细胞24 h,免疫印迹试验法测定MMP-2蛋白的表达水平。根据所得结果,筛选脓毒症细胞模型的最适宜脂多糖浓度,并进行后续的转染实验。
1.7 过表达miR-29a的脓毒症细胞模型MMP-2表达情况 RAW 264.7细胞置于含10% 胎牛血清的DMEM培养基,在37℃、5% CO2条件下培养24 h。将RAW 264.7细胞接种于六孔板(1.0×105个/孔)中过夜。将细胞分为脂多糖组、脂多糖+miR-29a抑制物组、脂多糖+miR-29a模拟物组和脂多糖+miR-29a对照物组,在含有细胞的1 500 μl培养基的培养孔中分别加入磷酸缓冲盐溶液、miR-29a抑制物/脂质体2000混合液、miR-29a模拟物/脂质体2000混合液、miR-29a对照物/脂质体2000的混合液;培养6 h后,将含混合液的培养基移去,更换新鲜培养基,加入10 μg/ml脂多糖,将培养板置于37℃培养箱中培养24 h后免疫印迹试验法测定MMP-2蛋白的表达。
1.8 免疫印迹试验法测定MMP-2蛋白的表达 取不同浓度脂多糖刺激后24 h和转染后24 h的各组细胞,加入细胞裂解液后提取蛋白,并用二喹啉甲酸法检测蛋白浓度,取60 μg蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电泳结束后转膜至聚偏二氟乙烯膜,室温封闭1 h,加入MMP-2一抗4℃孵育过夜,TBST清洗3次,10 min/次。加入二抗室温孵育1 h,TBST清洗3次,10 min/次。洗膜结束后用凝胶成像系统进行显影。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参。一抗MMP-2、GAPDH、二抗稀释比例分别为1 ∶1 000、1 ∶5 000、1 ∶5 000。
1.9 统计学分析 采用SPSS 21.0软件进行统计学分析。计量资料以(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,重复测量计量资料比较采用重复测量方差分析;采用Pearson相关分析进行相关性分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组MMP-2及miR-29a的表达水平 脓毒症组血清MMP-2表达水平高于对照组,而miR-29a的相对表达水平低于对照组(均P<0.05),见表1 。脓毒症组患者血清miR-29a与MMP-2的表达水平呈负相关(r=-0.332,P<0.001) 。

表1 两组MMP-2和miR-29a表达水平比较(x±s)
2.2 生物信息学分析结果 MMP-2与miR-29a序列高度互补,MMP-2可能为miR-29a的靶基因,见表2。

表2 生物信息学分析预测结果
2.3 miR-29a对照物组与miR-29a模拟物组RAW 264.7细胞增殖比较 两组增殖水平比较差异有统计学意义(F组间=66.799,P组间=0.001),其中72 h时miR-29a模拟物组的增殖水平低于miR-29a对照物组(P<0.05);两组增殖水平均随时间延长而升高(F时间=355.962,P时间<0.001);分组与时间有交互效应(F交互=12.467,P交互<0.001)。见表3。

表3 miR-29a对照物组与miR-29a模拟物组不同时间点细胞增殖水平比较(x±s)
注:与miR-29a对照物组比较,*P<0.05。
2.4 不同浓度脂多糖刺激下RAW 264.7细胞MMP-2表达情况 0 μg/ml脂多糖、 1 μg/ml脂多糖、5 μg/ml脂多糖、10 μg/ml脂多糖刺激下RAW 264.7细胞MMP-2蛋白相对表达水平依次升高(均P<0.05),见表4。因此,将10 μg/ml作为建立脓毒症细胞模型的最适宜脂多糖浓度,并进行后续的转染实验。
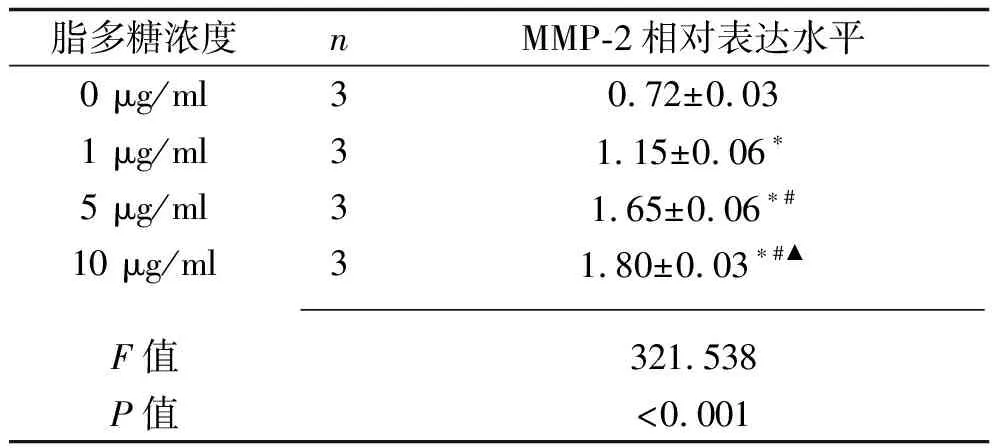
表4 不同浓度脂多糖刺激24 h后MMP-2相对表达量比较(x±s)
注:与0 μg/ml脂多糖比较,*P<0.05;与1 μg/ml脂多糖比较,#P<0.05;与5 μg/ml脂多糖比较,▲P<0.05。
2.5 不同miR-29a表达水平的脓毒症细胞模型MMP-2表达情况比较 与脂多糖组及脂多糖+miR-29a对照物组比较,脂多糖+miR-29a抑制物组MMP-2蛋白相对表达水平升高,而脂多糖+miR-29a模拟物组的MMP-2蛋白相对表达水平降低(均P<0.05),脂多糖+miR-29a抑制物组MMP-2蛋白相对表达水平高于脂多糖+miR-29a模拟物组(P<0.05)。见表5。
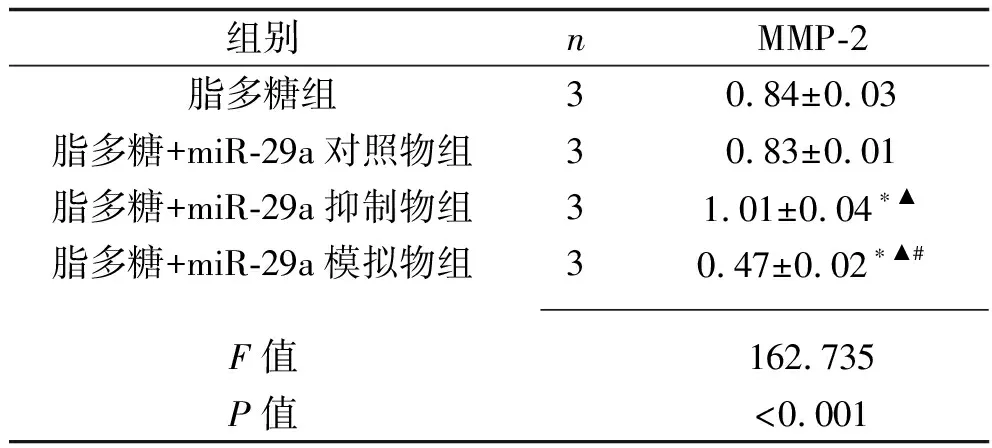
表5 4组细胞MMP-2蛋白相对表达水平比较(x±s)
注:与脂多糖组比较,*P<0.05;脂多糖+miR-29a对照物组比较,▲P<0.05;与脂多糖+miR-29a抑制物组比较,#P<0.05。
3 讨 论
MMP-2可以通过直接降解或间接影响细胞因子参与ECM的生理和病理重塑。MMP-2在正常细胞中的表达量极低,与金属蛋白酶组织抑制剂处于动态平衡,维持ECM的正常形态和功能。而在脓毒症患者中MMP-2表达的改变造成MMP与金属蛋白酶组织抑制剂间失衡,同时激活的MMP-2还可通过切除MMP酶原的前肽使其激活产生正反馈放大效应,最终导致ECM降解,造成细胞损伤[7]。既往研究表明,脓毒症大鼠心脏组织中MMP-2的表达水平改变可能导致心肌抑制和ECM重塑[8],但其具体作用仍存在争议。
本研究结果显示,脓毒症患者血清MMP-2表达水平和脓毒症细胞模型(10 μg/ml脂多糖)中MMP-2表达水平升高(P<0.05)。其他学者也发现,存活组脓毒症患者MMP-2水平低于非存活组患者,认为MMP-2可能参与脓毒症的进程,可作为脓毒症诊断和治疗标志物[8]。但MMP-2在脓毒症进展过程中的变化情况及临床作用仍存在争议。研究显示,与健康对照组相比,严重脓毒症患者MMP-2水平上升但差异无统计学意义,且与临床预后无关[9]。导致本研究结果与该研究结果相悖的原因可能有:(1)选取研究对象不同:该研究选取严重脓毒症患者且患者在不同的疾病阶段入组,并受到药物治疗等影响,异质性较高,而本研究样本选取的是脓毒症初次确诊24 h后的血液标本,异质性较低。(2)MMP-2检测方式差异:该研究观察到的是血清有活性的MMP-2蛋白表达升高,而本研究检测的是MMP-2蛋白总量,未单独检测有活性的MMP-2;然而活性MMP-2蛋白表达升高可能是MMP-2总蛋白升高的局部变现之一,并不能完全代表MMP-2的总体水平。有关MMP-2在脓毒症中的作用研究较少,具体机制有待进一步研究。
MiR-29a可以通过广泛抑制纤维蛋白酶原和调控ECM相关基因表达,参与肝硬化等疾病的进程[10-11]。既往研究表明miR-29a可能为脓毒症患者死亡的独立危险因素[12],然而miR-29a在脓毒症中的作用尚未阐明。为了进一步研究miR-29a在脓毒症中的作用,本研究应用PCR检测脓毒症患者血清miR-29a表达情况,结果显示脓毒症组血清miR-29a相对表达水平下降(P<0.05),提示miR-29a可能参与脓毒症的发生,但具体机制不明。本研究通过转染miR-29a构建了miR-29a过表达细胞模型,结果显示72 h时miR-29a模拟物组的增殖水平低于miR-29a对照物组(P<0.05),提示过表达miR-29a可以抑制细胞增殖。这意味着miR-29a可能通过调控细胞周期参与脓毒症进程。
在血管平滑肌细胞中,miR-29模拟物可以通过直接靶向于MMP-2调控细胞凋亡[13]。此外,钙化的动脉组织中miR-29a对MMP-2有直接调控作用[14],而在结直肠癌患者血清中,miR-29与MMP-2相互联系,共同参与疾病进展[15]。这些研究结果提示miR-29a可以在不同水平层次上参与调控MMP-2及疾病进程。但目前miR-29a表达水平及其对MMP-2与脓毒症的影响仍需进一步研究。本研究的相关性分析结果显示,脓毒症患者血清miR-29a与MMP-2表达呈负相关(P<0.05);此外,通过生物信息学分析并应用miRanda和TargetScan软件预测调控MMP-2的miR,发现MMP-2与miR-29a序列高度互补,MMP-2可能是miR-29a的靶基因。为了进一步探索两者之间的调控机制,本研究将miR-29a转染RAW 264.7细胞后观察脂多糖刺激下MMP-2蛋白表达情况,结果显示与脂多糖组及脂多糖+miR-29a对照物组比较,脂多糖+miR-29a抑制物组MMP-2蛋白相对表达水平升高,而脂多糖+miR-29a模拟物组的MMP-2蛋白相对表达水平降低(均P<0.05),即miR-29a过表达的脓毒症模型细胞MMP-2蛋白的表达下调,而抑制miR-29a的表达后脓毒症模型细胞MMP-2蛋白的表达上调,这提示miR-29a可能通过调控MMP-2水平参与脓毒症进程。
综上所述,MMP-2及miR-29a均与脓毒症的发生密切相关,miR-29a可能通过调控MMP-2水平参与脓毒症。miR-29a或可成为脓毒症治疗的新靶点,及早对脓毒症患者进行以miR为靶点的干预治疗可能取得较好效果。而miR-29a调控MMP-2水平的具体机制尚未阐明,其是否通过此途径调节MMP-2表达参与脓毒症进程仍需进一步的研究。
