小型猪不停跳冠脉旁路移植模型建立初探
2019-03-13黄墨林郑远彪葛建军
王 鑫 黄墨林 张 锐 伟 俊 郑远彪 葛建军
冠状动脉旁路移植术(CABG)作为冠状动脉粥样硬化型心脏病(CHD)治疗的主要方法,由于取材的限制,通常选用大隐静脉作为桥血管的主要血管,因此使得内膜增生成为了静脉移植后通畅的主要障碍,虽然血管平滑肌细胞的迁移和增殖枢转会影响血管重塑过程,但尚未有系统预防静脉移植物内膜增生的治疗方法[1]。纵观当前国内外研究,多通过建立大鼠[2]、家兔[3]、狗[4]的颈静脉移植模型及小型猪的大隐静脉-颈内动脉模型[5~6]来寻找静脉移植物内膜增生的系统疗法,缺乏对完全模拟人类心脏不停跳冠脉搭桥手术动物模型构建的研究。众所周知,临床实践中,冠脉较颈动脉的分支更多,血流情况相对更复杂,冠脉旁路移植手术的难度也更大,单纯的颈静脉移植物内膜增生情况缺乏一定的代表性,因此,有针对性的模拟人类不停跳冠脉搭桥手术建立动物模型是十分有必要的。通过文献研究发现,猪的冠脉解剖更接近于人[7]。故本文创新性的选择小型巴马猪建立不停跳冠脉旁路移植模型,结合实践过程理清实验的思路、方法、遇到的问题及解决办法,总结经验,完成构建小型巴马猪建立不停跳冠脉旁路移植模型的初探,为建立成熟稳定的小型猪冠脉搭桥模型奠定理论及实践基础。同时也对CABG术后桥血管的再狭窄的研究及年轻临床医生练习不停跳冠状动脉旁路移植术产生一定的指导意义。
1 材料和方法
1.1 实验动物 经安徽医科大学动物实验伦理委员会批准后,采用简单随机抽样法从泰州小型猪生产基地选取30头健康小型巴马猪,雌雄不分,体重35~40 kg,术前正常喂养1周。
1.2 实验器械及药品 器械主要包含动物呼吸机1台,心电监护仪1台,电刀1台,负压吸引器1台,除颤仪1台,搭桥器械1套,组织剪、组织镊、止血钳、蚊氏钳若干,6/0及7/0 prolene线,普通丝线,气管插管、心表固定器,吹管等。药品主要包含舒泰(替来拉明+唑拉西泮)、盐酸赛拉嗪等。
1.3 实验过程
1.3.1 实验前准备 正常喂养1周,术前禁食12 h,禁水4 h,称重,准备手术台,准备多巴胺、利多卡因、阿托品等抢救药品。
1.3.2 麻醉 给予舒泰2.5 mg/kg,盐酸赛拉嗪2 mg/kg进行肌注麻醉。麻醉后给予手术区域备皮,固定后于耳缘静脉建立静脉通道,气管插管并连接呼吸机,参数:吸入氧浓度(FiO2)60%,通气频率(f)20次/分,潮气量8~10 mL/kg。并于后腿第二关节内侧切开行股动脉穿刺,检测动脉血压及血氧饱和度。
1.3.3 手术过程 ①手术区域消毒后于后腿关节外侧切开,采用“NO-TOUCH”技术分离大隐静脉,用0号或1号线结扎分支,离取约8~10 cm血管,用肝素水冲洗管腔后备用。②胸骨正中切开,分离组织后用胸骨劈刀劈开胸骨,分离组织并暴露心脏及主动脉,静推2 mg/kg肝素,于主动脉上选取合适位置缝合主动脉-大隐静脉,待心率血压稳定后,分离前降支,于合适位置缝合大隐静脉-前降支。止血,关胸,钢丝固定胸骨,缝皮。
1.3.4 术中管理 术中每小时追加一次舒泰(剂量为初始剂量的1/3)及肝素(剂量为初始剂量的1/2),持续泵入丙泊酚6~8 mL/h维持麻醉;同时加以青霉素10万单位/公斤静滴预防感染,500 mL生理盐水加入1 g氯化钾及1.25 g硫酸镁补充液体和电解质。
1.3.5 术后管理 术后单笼喂养观察,持续静脉补液,每天分两次静脉给予青霉素(10万单位/公斤),待3天后恢复自主进食,精神良好后可返回普通饲养笼。
1.3.6 静脉获取 术后4周麻醉,开胸(操作同前),分离黏连组织后取出桥血管,观察通畅情况。实验猪可通过心房注射KCL处死。
2 研究结果
本实验共选取30头巴马小型猪进行手术,因技术操作失误、术前准备不当、温度失衡等原因死亡8头,失败2头(见表1),成功20头。实验后期,经观察发现,术中实验猪血压心率稳定,桥血管充盈,血流丰富(见图1),4周后取出大隐静脉桥血管,肉眼可见桥血管通畅,血管与周围组织黏连(见图2、图3),HE染色光镜下见桥血管内膜中膜有明显增厚,细胞排列不规则(见图4)。
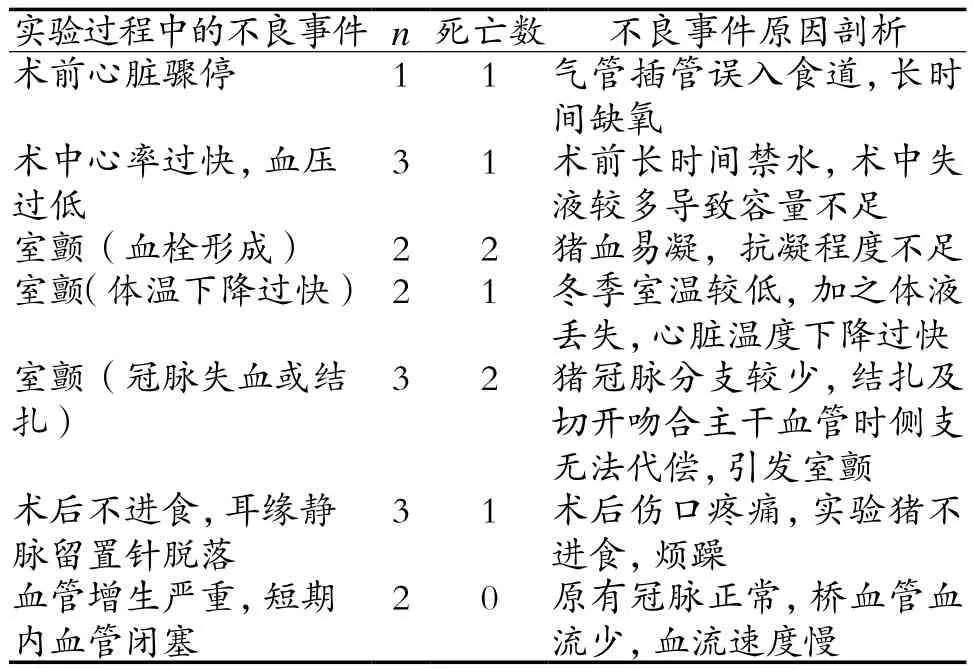
表1 实现过程中不良事件及出现原因剖析
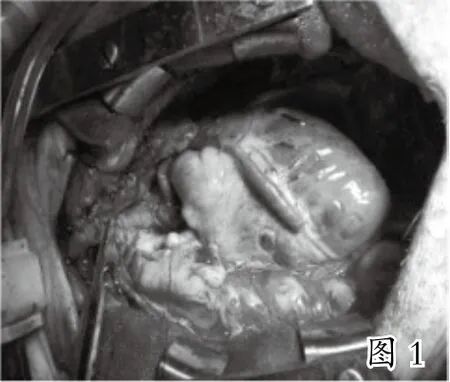

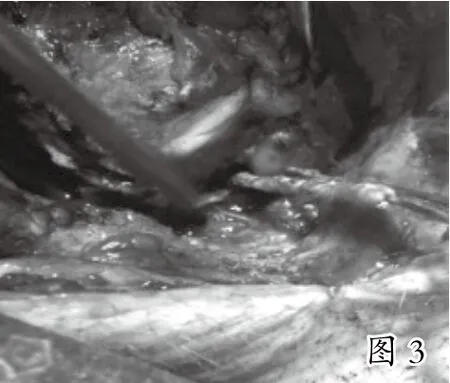
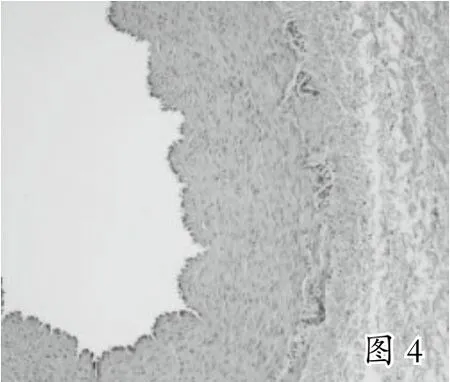
3 讨 论
3.1 实验动物的选取 通过文献研究及实验发现,猪类冠状动脉与人类冠状动脉的相似度较高。同时饲养简单,抗感染能力强,较为适宜进行动物实验研究。本实验在研究初期,曾选择普通肉用猪作为实验用猪,在实验使用3头猪后,发现普通肉用猪生长速度较快,短期内体重变化较大,不易控制且个体差异较大,遗传因素不稳定,术中耐受程度较低,麻醉和血管吻合过程中易发生窒息和室颤,考虑到此些因素易使研究结果产生偏倚,经实验总结、专题小组讨论、文献资料研究后我们更换实验用猪为巴马小型猪,更换实验动物后我们发现,实验情况得到了很大程度的改善。巴马小型猪为何更适宜作为实验用猪,通过实验总结我们发现,其具备以下几点优势:①巴马小型猪遗传因素稳定,一致性较好,其在我国作为实验用猪,已近亲培育20余年,广西巴马小型猪在21个微卫星位点的平均基因纯合率为55.5%,表明其近交程度高,平均PIC和平均杂合程度均较低,实验研究时组间差异较小,非常适合作为实验用猪。②巴马小型猪的生长速度较慢,成年猪体重为35~40 kg,短期内体重不会发生较大变化[8],能够保证实验过程样本的稳定性,利于实验的持续监测。③巴马小型猪的耐受程度高,术中对缺血缺氧的耐受程度明显高于普通肉用猪,利于实验的开展。④巴马小型猪生理生化指标相较于普通家猪和人类更为近似,其共有14项血液生理指标及18项血液生化指标和人类相似,更适合作为心血管系统研究的实验用猪[9]。但值得注意的是,小型巴马猪的生理结构和人不同,大隐静脉位于后腿外侧,因此可从一侧后腿第二关节取至根部,长度达10~15 cm即可。
3.2 实验难点及解决策略 巴马小型猪猪皮较厚,后肢粗短,股动脉较难触及,这就造成了我们在实验过程中遇到穿刺困难的难题,这很不利于我们在搭桥手术中对巴马小型猪的动脉血压进行持续动态监测,如果该问题得不到解决也将严重阻碍实验的进行。在多次尝试后,我们采取切开穿刺方法,后用带线缝合针固定,取得了较好效果,使得实验得以顺利开展。在器械的选择上,由于猪喉和猪口腔的特殊解剖关系,无猪类专用器械可用,实验初期插管较为困难,后经总结经验及多次练习后,我们应用成人大号弯喉镜沿嘴角进入,缩短距离,并以止血钳牵舌,协助暴露,但由于巴马猪的耳缘静脉较细,如果静脉留置针18G、20G、22G(国际型号)过粗则植入较为困难,静脉留置针26G(国际型号)过细则容易堵塞,均达不到补液要求,经换用不同型号的留置针后,最后发现24G(0.7 mm×19 mm,国际型号)型号留置针最为合适。如术中失血较多,可双侧耳缘静脉建立静脉通道,多通道同时补液。
与人类相比,巴马小型猪血液易凝,黏滞度较高,部分凝血活酶时间(APTT)为23.73 s(人类为30~45 s),凝结酶凝结时间(TT)为13.66 s(人类为16~18 s)[10],所以当动脉穿刺成功后应立即予以肝素水冲洗。同理,在开胸后立即予以肝素2.0~2.5 mg/kg静推,测ACT约300 s左右,并每隔1 h给予肝素,剂量为首次剂量的一半,以防止术中出现血栓,诱发心梗而除颤成功率较低的情况;小型巴马猪相较于人类具有更短的左冠状动脉和侧支,即使是回旋支动脉也无法到达后室间沟[11],至少90%的室间静脉流出物源自左前降支冠状动脉灌注的心肌的血液[12]。所以在吻合前降支时,如果缺血时间过长,很容易诱发心梗及室性心律失常,故吻合时如果发生心率大于160次/分或小于60次/分、血压波动明显、氧饱和度下降等情况,应立即静脉给予利多卡因(1~2 mg/kg),同时取利多卡因少量于心脏表面浸润,预防室颤发生。选择吻合口应尽量选择前降支末端,减少吻合时的缺血范围。若发生室颤,应立即给予5~10焦耳心表电除颤。
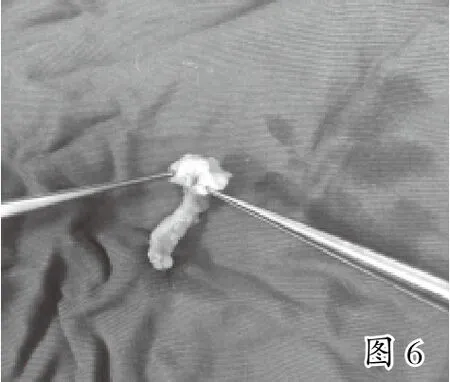
3.3 实验过程的纠偏 实验初期,我们仅对实验猪进行冠状动脉旁路移植术,对原正常冠脉不作处理,4周后取出桥血管,血管闭塞,内皮增生严重,血管狭窄,无血流通过(见图5),考虑如此短时间内导致的血管闭塞,可能是由于原冠状动脉无病变,导致桥血管血流不足引起的桥血管闭塞[7]。后我们采取丝线7号线完全结扎原冠脉,模拟冠心病冠脉情况,人工造成狭窄以增加桥血管血流量,4周后取出桥血管,发现情况得到明显改善,血管内膜增生情况较前有明显减轻(见图6),血流通畅,心脏跳动情况正常。但在桥血管建立后,结扎原冠脉时,心脏易发生心梗、室颤及室性心率失常,应特别注意。可能是由于缺血过程过快,心脏无法代偿所致。故可缓慢结扎前降支,增加心脏适应过程。

3.4 混杂因素的消除 心电图示波的时候,猪毛会阻碍电极片与皮肤的接触,影响示波,即使刮去猪毛,猪皮上的小绒毛也会使电极片接触不稳定,手术时间较长的情况下依旧容易脱落,因此后来我们采取电极片和缝合针直接连接,并将缝合针直接缝在四肢上,更加简单、有效。
巴马小型猪因术中失血、大量补充液体、开胸暴露心脏等原因使得心脏温度下降过快,冬季情况更为明显。如果因此导致室颤发生,在没有复温、保温设备的情况下,则复跳困难。故我们采取提高室内温度(25 ℃左右)、无菌铺单下铺设电热毯、术中补充加温液体等措施,取得了较好效果。部分实验巴马猪由于术后疼痛会出现烦躁、不进食、剐蹭静脉留置针和引流管等情况,如不及时处理,将导致术后无法补液、补充能量和使用抗生素,进而致使实验动物死亡。我们采取舒芬太尼5~10 µg加入500 mL生理盐水中静滴,青霉素5万单位/公斤,1日两次,在未进食情况下,每日需补液2000 mL/天。如烦躁情况较严重,可换至小笼(不影响呼吸)制动,固定四肢,可有效防止静脉留置针及引流管的脱落,还可减少伤口的撕裂和感染。待情况稳定,开始进食(一般2~3天)后换至普通笼中饲养。
4 研究展望
实验初期手术操作及实验人员之间的配合不够熟练,导致吻合远端血管的时间过长,增大了实验难度,同时由于初期探索阶段对混杂因素把握的不够全面,导致了部分实验巴马猪的死亡。除去这些导致巴马猪死亡原因,我们发现小型猪的不停跳旁路移植模型的建立是可行的。故在后期,我们在积累经验的基础上,亟需通过本文总结的经验加以优化,严格控制混杂因素,选取拥有较多的临床经验的实验人员,逐步减少术后不良事件的发生,增加该实验的稳定性。
