小分子RNA干扰磷脂酰肌醇3-激酶催化亚基α基因对人骨肉瘤Saos-2细胞增殖和侵袭能力的影响
2019-03-13王勤志徐立军李名武
王勤志,徐立军,李名武,周 聪
(鄂东医疗集团市中心医院创伤外科,湖北 黄石 435000)
骨肉瘤(osteosarcoma,OS)作为常见的骨科恶性肿瘤,好发于20岁以下人群,由于该肿瘤恶性程度高,侵袭能力强,多数患者临床确诊时已出现局部或远处转移[1]。随着诊疗手段的提高,OS患者5 a生存率显著提高[2],但易发生复发及转移,仍有较高的致死、致残率[3]。OS发生机制较为复杂,目前尚未完全清楚。因此,积极探讨OS相关发生机制对早期预防及临床治疗具有重要意义。磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)信号通路与细胞增殖、分化、生长、凋亡等过程密切相关,在多种恶性肿瘤的发生及进展过程中发挥关键性作用[4-5],磷脂酰肌醇3-激酶催化亚基α(phosphatidylinositol 3-kinase catalytic subunit alpha,PIK3CA)作为PI3K基因的P110α催化亚单位,是调控PI3K活化的重要基因,其异常表达可导致PI3K活化异常,与多种肿瘤的发生、发展关系密切[6]。本研究利用小分子干扰RNA(small interfering RNA,siRNA)技术下调人OS Saos-2细胞中PIK3CA基因表达,观察其对Saos-2细胞生物学行为的影响。
1 材料与方法
1.1细胞、试剂和仪器人OS Saos-2细胞购自美国ATCC公司,RPMI-1640培养基、体积分数10%胎牛血清均购自美国Gibico公司,TRIzol总RNA提取试剂盒、细胞裂解液、LipofectamineTM2000脂质体转染试剂均购自美国Invitrogen公司,反转录试剂盒和聚合酶链反应(polymerase chain reaction,PCR)试剂盒均购自日本TaKaRa公司,PIK3CA和内参引物均由上海生工生物公司设计合成,siRNA-PIK3CA、siRNA对照序列均由上海吉玛制药技术有限公司设计合成,四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)细胞增殖试剂盒购自上海哈灵生物试剂检测中心,膜联蛋白A5-异硫氰酸荧光素(annexin A5-fluorescein isothiocyanate,Annexin V-FITC)标记/碘化丙啶(propidium iodide,PI)细胞凋亡检测试剂盒、流式细胞仪购自美国BD公司,Transwell小室购自美国Corning Costar公司,鼠抗人PIK3CA单克隆抗体购自台湾Abnova公司,鼠抗人PI3K 单克隆抗体、兔抗大鼠磷酸化-mTOR(phosphorylation-mTOR,p-mTOR)多克隆抗体购自美国Abcam公司,兔抗鼠磷酸化-PI3K(phosphorylation-PI3K,p-PI3K)多克隆抗体购自美国Santa Cruz公司,兔抗鼠蛋白激酶B(protein kinase B,Akt)、磷酸化-Akt(phosphorylation-Akt,p-Akt)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin protein,mTOR)多克隆抗体均购自美国CST公司;酶标仪购自奥地利DIALAB公司,凝胶电泳系统购自美国Bio-Rad公司。
1.2实验方法
1.2.1细胞培养及分组处理将细胞置于含体积分数10%胎牛血清的RPMI-1640培养基中,于含体积分数5%CO2、37 ℃恒温培养箱中培养,待细胞生长至约80%融合时,胰蛋白酶消化后传代培养,取传 3~6代细胞进行实验。取对数生长期细胞,计数后接种于96孔板,随机将细胞分为siRNA-PIK3CA组、siRNA对照组和空白对照组。siRNA-PIK3CA组细胞转染siRNA-PIK3CA序列,正义链为5′-GGCUAAAGAAAGCCUUUAUTT-3′,反义链为5′-AUAAAGGCUUUCUUUAGCCTT-3′;siRNA对照组细胞转染siRNA对照序列,正义链为5′-UUGAUAACTUGAACAGAUAAT-3′,反义链为5′-CAUUUGUUCACGCUAUCAGTT-3′;空白对照组细胞不作任何处理。各组细胞转染后培养48 h完成后续实验。
1.2.2实时荧光定量PCR检测PIK3CAmRNA表达取各组转染后培养48 h细胞,胰蛋白酶消化后加入细胞裂解液,提取细胞中总RNA,紫外分光光度法检测总RNA纯度。利用反转录试剂盒反转录为模板单链cDNA,以cDNA为模板,每组设3个平行复孔进行PCR,操作步骤严格按照试剂盒说明书进行。PIK3CA上游引物序列为5′-CTCGAG-AAAGATAACTGAGAAAATGAAAGCTC-3′,下游引物序列为5′-TCTAGACCTTCTCCATCATTTCTATATA-TTTTGG-3′;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物序列为5′-GTGGACCTGACCT-GCCGTCT-3′,下游引物序列为5′-GGAGGAGTGG-GTGTCGCTGT-3′。PCR反应条件:95 ℃ 1 min,92 ℃ 30 s,92 ℃ 30 s,55 ℃ 30 s,75 ℃ 30 s,重复循环36次。采用2-△△Ct法计算各组细胞中PIK3CA mRNA相对表达量[7]。
1.2.3MTT法检测细胞增殖能力取各组转染细胞,胰蛋白酶消化后接种于96孔板,调整细胞密度为每孔2×103个,分别于培养24、48、72、96 h时,将MTT液加入各孔,继续培养4 h;取出培养板,弃培养液,加入二甲基亚砜,震荡15 min,使用酶标仪在450 nm波长处对各孔吸光度值进行检测,以吸光度值表示细胞增殖能力,吸光度值越大,细胞增殖能力越强。每孔各测3次,取均值[8]。
1.2.4流式细胞术检测细胞凋亡取各组转染后培养48 h细胞,胰蛋白酶消化,800 r·min-1离心 5 min,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤3次,用100 μL结合缓冲液重悬细胞,调整细胞密度为1×109L-1,加入5 μL Annexin V-FITC,再加入5 μL PI,摇匀后避光放置15 min,加入400 μL结合缓冲液,于60 min内上机进行检测。
1.2.5Transwell法检测细胞迁移能力取各组转染后培养48 h细胞沉淀,使用无血清培养基制成单细胞悬液,调整细胞密度为1×109L-1;取细胞悬液200 μL加入Transwell小室上室,将含体积分数10%胎牛血清的培养基加入小室下室,于含体积分数5% CO2、37 ℃恒温培养箱中培养24 h;取出小室,PBS洗涤3次,用棉签将小室上室细胞小心擦去,体积分数95%乙醇固定15 min,结晶紫染色,倒置显微镜下观察,随机选取10个视野,计数穿膜细胞数。实验重复3次,取均值[9-10]。
1.2.6Transwell法检测细胞侵袭能力将Matrigel胶预先铺于Transwell小室内,其余操作步骤同“1.2.5”项。
1.2.7Westernblot法检测PIK3CA、PI3K、p-PI3K、Akt、p-Akt、mTOR和p-mTOR蛋白表达取各组转染后培养48 h细胞,胰蛋白酶消化,细胞裂解液裂解,使用总蛋白提取试剂盒提取细胞中总蛋白,使用二喹啉甲酸蛋白浓度检测试剂盒检测总蛋白浓度。取30 μg总蛋白,进行聚丙烯酰胺凝胶电泳,电转移至聚偏二氟乙烯PVDF膜上,脱脂奶粉封闭2 h,加入一抗鼠抗人PIK3CA、PI3K单克隆抗体、兔抗鼠p-PI3K、Akt、p-Akt、mTOR多克隆抗体和兔抗大鼠p-mTOR多克隆抗体(稀释比例分别为1300、1800、1500、11 000、12 000、1500、11 000),4 ℃孵育过夜,含体积分数0.1%吐温-20的Tris缓冲生理盐水(Tris-buffered saline and 0.1% Tween-20,TBST)洗涤3次,加入电化学发光显色液显色,曝光、拍照,利用Image J图像分析软件进行分析,获得各转染组细胞中PIK3CA、PI3K、p-PI3K、Akt、p-Akt、mTOR和p-mTOR蛋白相对表达量[11-12]。
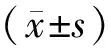
2 结果
2.13组细胞中PIK3CAmRNA和蛋白相对表达量比较结果见表1、图1和图2。siRNA-PIK3CA组细胞中PIK3CA mRNA和蛋白相对表达量均低于siRNA对照组和空白对照组,差异有统计学意义(P<0.05);siRNA对照组与空白对照组细胞中PIK3CA mRNA和蛋白相对表达量比较差异无统计学意义(P>0.05)。
表13组细胞中PIK3CAmRNA和蛋白相对表达量比较
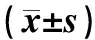

组别PIK3CA mRNAPIK3CA蛋白空白对照组1.85±0.180.67±0.13siRNA对照组1.82±0.170.65±0.11siRNA-PIK3CA组1.27±0.15ab0.31±0.09abF24.44446.301P0.0000.000
注:与空白对照组比较aP<0.05;与siRNA对照组比较bP<0.05。

1:siRNA-PIK3CA组;2:siRNA对照组;3:空白对照组。
图13组细胞中PIK3CAmRNA表达
Fig.1ExpressionofPIK3CAmRNAincellsofthethreegroups

1:siRNA-PIK3CA组;2:siRNA对照组;3:空白对照组。
图23组细胞中PIK3CA蛋白表达(Westernblot)
Fig.2ExpressionofPIK3CAproteinincellsofthethreegroups(Westernblot)
2.23组细胞增殖能力比较结果见表2。siRNA-PIK3CA组细胞转染后24、48、72、96 h时吸光度值均低于siRNA对照组和空白对照组,差异有统计学意义(P<0.05);siRNA对照组与空白对照组细胞转染后24、48、72、96 h时吸光度值比较差异无统计学意义(P>0.05)。
表23组细胞增殖能力比较
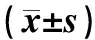

组别细胞增殖能力(吸光度值)24 h48 h72 h96 h空白对照组0.33±0.070.36±0.050.45±0.040.75±0.05siRNA对照组0.31±0.080.41±0.030.55±0.050.73±0.14siRNA-PIK3CA组0.19±0.06ab0.25±0.06ab0.35±0.04ab0.53±0.08abF6.38825.46027.7009.146P0.0100.0000.0000.003
注:与空白对照组比较aP<0.05;与siRNA对照组比较bP<0.05。
2.33组细胞凋亡率比较结果见图3。siRNA-PIK3CA组、siRNA对照组和空白对照组细胞凋亡率分别为(16.3±4.8)%、(6.9±2.1)%和(7.2±2.4)%,siRNA-PIK3CA组细胞凋亡率高于siRNA对照组和空白对照组,差异有统计学意义(P<0.05);siRNA对照组与空白对照组细胞凋亡率比较差异无统计学意义(P>0.05)。

A:siRNA-PIK3CA组;B:siRNA对照组;C:空白对照组。
图3流式细胞术检测3组细胞凋亡情况
Fig.3Cellapoptosisdetectedbyflowcytometryinthethreegroups
2.43组细胞迁移和侵袭能力比较结果见表3和图4。siRNA-PIK3CA组迁移细胞数和侵袭细胞数均少于siRNA对照组和空白对照组,差异有统计学意义(P<0.05);siRNA对照组与空白对照组迁移细胞数和侵袭细胞数比较差异无统计学意义(P>0.05)。
2.53组细胞中PI3K、p-PI3K、Akt、p-Akt、mTOR和p-mTOR蛋白相对表达量比较结果见表4和图5。siRNA-PIK3CA组细胞中PI3K、Akt、mTOR蛋白相对表达量均高于siRNA对照组和空白对照组,差异有统计学意义(P<0.05),而p-PI3K、p-Akt、p-mTOR蛋白相对表达量均低于siRNA对照组和空白对照组,差异有统计学意义(P<0.05);siRNA对照组与空白对照组细胞中PI3K、p-PI3K、Akt、p-Akt、mTOR和p-mTOR蛋白相对表达量比较差异无统计学意义(P>0.05)。
表33组迁移细胞数和侵袭细胞数比较
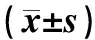

组别迁移细胞数侵袭细胞数空白对照组110.4±8.3123.4±7.5siRNA对照组107.6±7.8127.6±8.1siRNA-PIK3CA组76.8±5.9ab45.2±6.2abF19.41785.380P0.0000.000
注:与空白对照组比较aP<0.05;与siRNA对照组比较bP<0.05。

A、A1:siRNA-PIK3CA组;B、B1:siRNA对照组;C、C1:空白对照组。
图43组细胞迁移和侵袭能力(结晶紫染色,×200)
Fig.4Cellmigrationandinvasionabilityinthethreegroups(crystalvioletstaining,×200)
表43组细胞中PI3K、p-PI3K、Akt、p-Akt、mTOR和p-mTOR蛋白相对表达量比较
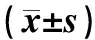

组别PI3K蛋白p-PI3K蛋白Akt蛋白p-Akt蛋白mTOR蛋白p-mTOR蛋白空白对照组0.57±0.090.70±0.090.45±0.080.63±0.110.51±0.040.89±0.14siRNA对照组0.58±0.100.72±0.110.46±0.100.61±0.090.52±0.050.87±0.12siRNA-PIK3CA组0.78±0.07ab0.32±0.08ab0.69±0.11ab0.28±0.07ab0.72±0.06ab0.41±0.08abF28.24440.55414.37746.15248.41512.530P0.0000.0000.0000.0000.0000.000
注:与空白对照组比较aP<0.05;与siRNA对照组比较bP<0.05。

1:siRNA-PIK3CA组;2:siRNA对照组;3:空白对照组。
图53组细胞中PI3K、p-PI3K、Akt、p-Akt、mTOR和p-mTOR蛋白表达(Westernblot)
Fig.5ExpressionsofPI3K,p-PI3K,Akt,p-Akt,mTORandp-mTORproteinincellsofthethreegroups(Westernblot)
3 讨论
OS作为预后较差的恶性肿瘤,早期转移及术后复发、转移是导致患者死亡的主要因素[13]。PI3K作为生长因子受体超家族信号通路中的关键性调控因子,不仅在细胞生长、分化、凋亡、迁移等正常生理功能中发挥重要的调节作用,而且在肿瘤细胞异常增殖、凋亡、迁移、侵袭及耐药、放射治疗耐受等过程中也发挥重要作用[14],PIK3CA作为调控PI3K活性的p110α催化亚基的编码基因,可通过异常高表达或基因突变而异常活化PI3K信号通路[15],在乳腺癌[16]、胃癌[17]、胶质瘤[18]等多种恶性肿瘤发生、发展中发挥重要作用。本研究利用siRNA技术特异性将人OS Saos-2细胞中PIK3CA基因沉默,结果显示,siRNA-PIK3CA组细胞中PIK3CA mRNA和蛋白相对表达量均低于siRNA对照组和空白对照组,说明Saos-2细胞中PIK3CA基因被特异性沉默。
本研究结果显示,siRNA-PIK3CA组细胞转染后24、48、72、96 h时吸光度值均低于siRNA对照组和空白对照组,说明特异性抑制PIK3CA基因表达可显著抑制Saos-2细胞增殖能力,提示PIK3CA基因与Saos-2细胞增殖能力密切相关。siRNA-PIK3CA组细胞凋亡率高于siRNA对照组和空白对照组,说明特异性沉默PIK3CA基因表达可促进Saos-2细胞凋亡。siRNA-PIK3CA组迁移细胞数和侵袭细胞数均少于siRNA对照组和空白对照组,说明特异性沉默PIK3CA基因表达可抑制Saos-2细胞迁移和侵袭能力。这些结果说明了PIK3CA基因异常表达与Saos-2细胞异常增殖、凋亡、迁移及侵袭密切相关,可能在OS发生及进展中发挥重要作用。有研究指出,PI3K/Akt/mTOR信号通路作为机体内重要的信号通路,在调控细胞增殖、生长、代谢、凋亡等过程中发挥重要作用[19-20]。本研究结果显示,siRNA-PIK3CA组细胞中PI3K、Akt、mTOR蛋白相对表达量均高于siRNA对照组和空白对照组,而p-PI3K、p-Akt、p-mTOR蛋白相对表达量均低于siRNA对照组和空白对照组,说明特异性沉默PIK3CA基因可能通过抑制PI3K/Akt/mTOR信号通路而减少细胞增殖、迁移、侵袭,增加细胞凋亡发生。
综上所述,下调PIK3CA基因可减少人OS细胞增殖,抑制细胞迁移及侵袭能力,增加细胞凋亡,其机制可能与抑制PI3K/Akt/mTOR信号通路有关。
