糖尿病大鼠前额叶部位淀粉样蛋白水平与自噬水平变化的关系研究*
2019-03-13马楼艳翟佳佳吕雅丽成蕊宁
马楼艳,李 洺,翟佳佳,吕雅丽,成蕊宁
西安市第九医院 老年病二科(西安 710054)
全球糖尿病患者人数迅猛增长,已成为中国重要的民生健康问题。糖尿病对其他疾病的影响也日益受到重视。目前,糖尿病已被视为阿尔茨海默病(Alzheimer's disease, AD )的独立危险因素[1],故明确糖尿病促进AD发病的机制,有利于早期预防AD的发生发展。前期研究[2]发现,STZ诱导的糖尿病大鼠海马部位存在自噬的激活,但是自噬流不通,溶酶体功能出现异常,最终导致Aβ清除障碍,海马神经元凋亡增加。前额叶和海马均是大脑参与学习与记忆的重要部位,既往研究[3]发现,糖尿病大鼠前额叶部位存在Aβ蛋白沉积,但糖尿病大鼠前额叶部位自噬水平的情况目前鲜有报道。本实验采用STZ诱导的糖尿病大鼠模型,研究糖尿病大鼠成模第8、10、12周时的认知功能,前额叶神经元的超微结构以及前额叶部位Aβ和自噬指标的表达情况,探讨糖尿病促进认知障碍发生的机制。
1 材料与方法
1.1 药物和试剂
链脲佐菌素(STZ),Morris水迷宫及水迷宫记录分析系统(中国医学科学院药物研究所研制),兔抗Aβ大鼠多克隆抗体(Abcame),兔抗大鼠Beclin-1、LC3Ⅰ、LC3Ⅱ和p62抗体,Trizol(TAKARA),Real-time PCR扩增反应体系(TAKARA),引物设计及合成(上海生工生物工程有限公司合成)(表1)。

表1 各引物序列
1.2 方法
1.2.1 动物 SPF级SD雄性大鼠90只,8~10周龄,体重180~200 g(西安交通大学动物实验中心)。动物适应性喂养1周后,采用随机数字表法将其随机分为正常组(n=45)和糖尿病组(n=45)。建立经典的STZ诱导的糖尿病大鼠模型:所有大鼠禁食12 h后,糖尿病组大鼠腹腔注射1%的STZ(65 mg/kg),正常对照组腹腔注射等剂量生理盐水,3 d后测大鼠尾静脉空腹血糖,血糖≥16.7 mmol/L,提示模型建立成功。
1.2.2 Morris水迷宫测试 分别于成模后第7、9、11周,训练3 d,第4天进行隐藏平台获得实验,分析潜伏期,考察学习能力。第5天撤去平台进行空间搜索实验,去除平台观察2 min内大鼠穿越中心区域的次数,测试记忆能力。
1.2.3 电镜观察 水迷宫测试结束后,每组取出5只大鼠,深度麻醉大鼠,采用心脏灌流的方法,留取大鼠前额叶标本,固定。标本制作良好后,在电镜下观察不同时期各组大鼠前额叶神经元的超微结构。
1.2.4 qRT-PCR 抽提前额叶组织的总RNA,按照PrimeScirpt RT Master Mix试剂盒说明书进行,将RNA逆转录为cDNA ;进一步按照SYBR® Premix Ex TaqTMII 试剂盒说明书建立实时荧光定量PCR的反应体系。反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 20 s,40 个循环,每个循环进行实时荧光检测,最末循环作熔链曲线分析。实验引物委托上海生工生物科技有限公司设计合成(表1)。
1.2.5 Western blot 提取前额叶组织总蛋白,将动物组织放置于1.5 mL的EP管中,进行裂解,用BCA法测定蛋白浓度,完成配置凝胶,上样,电泳,染色,转膜,封闭,分别孵育一抗、二抗,发光,显影,摄像等过程。进行条带灰度值分析及统计分析。
1.2.6 免疫组化 采用SP法免疫组织化学染色,处死大鼠,1%甲醛心脏灌注取脑,石蜡包埋连续切片,根据试剂盒说明检测Aβ、Beclin-1、LC3Ⅰ和LC3Ⅱ在大鼠前额叶部位的表达。具体步骤如下:常规石蜡切片脱蜡,高压锅煮沸修复抗原,3%过氧化氢灭活内源性酶,正常山羊血清封闭,滴加一抗过夜,37 ℃孵育1 h,加入山羊抗兔IgG、SP复合物,DAB显色,镜下控制反应时间,以阳性产物是棕黄色为度。苏木素复染,脱水透明,中性树脂封片,显微镜观察照相。每个标本随机选取3张切片,每张切片高倍镜下随机选取3个视野,采用ImageJ 6.0软件测定该区域Aβ、Beclin-1、LC3Ⅰ和LC3Ⅱ阳性染色神经元的平均吸光度值,取其平均吸光度值作为结果。
1.3 统计学方法
2 结果
2.1 Morris水迷宫测试结果
2.1.1 隐藏平台获得实验 与正常组大鼠比较,糖尿病组大鼠自第8周开始,出现逃避潜伏期增加(P<0.05),且随着时间的延长,第10周和第12周糖尿病大鼠逃避潜伏期较正常对照组均延长(P<0.001)(表2)。
2.1.2 空间搜索实验 与正常组大鼠相比,自第8周始糖尿病组大鼠穿越目标区域次数明显下降(P<0.05)(表2)。
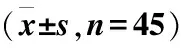
表2 各组大鼠在成模第8、10、12周时Morris水迷宫成绩
2.2 电镜结果
4 000倍电镜下可见糖尿病组大鼠前额叶神经元细胞间隙增宽,细胞水肿明显。40 000倍电镜下可见神经细胞结构紊乱,线粒体肿胀,内质网等细胞器结构模糊不清,核质固缩碎裂(图1)。

图1 电镜观察各组大鼠前额叶部位超微结构
注:A:正常组大鼠第8周时前额叶神经元的超微结构(×4 000);B:糖尿病组大鼠第8周时前额叶神经元的超微结构(×4 000);C:糖尿病组大鼠第10周时前额叶神经元的超微结构(×4 000);D:糖尿病组大鼠第12周时前额叶神经元的超微结构(×4 000);E:正常组大鼠第8周时前额叶神经元的超微结构(×40 000);F:糖尿病组大鼠第8周时前额叶神经元的超微结构(×40 000);G:糖尿病组大鼠第10周时前额叶神经元的超微结构(×40 000);H:糖尿病组大鼠第12周时前额叶神经元的超微结构(×40 000)
2.3 qRT-PCR检测结果
与正常组大鼠对比,第8周糖尿病组大鼠前额叶部位Aβ前体(amyloid precursor protein,APP)mRNA表达升高(P=0.037),Beclin-1 mRNA表达水平升高(P=0.008)。LC3Ⅰ mRNA在第8周和第10周时与正常组相比,差异无统计学意义(P>0.05),到第12周时表达水平明显下降(P=0.001)。LC3ⅡmRNA第8周时与正常组相比,表达水平升高(P=0.028),在第10周和第12周时表达水平均升高(P=0.011和P=0.019)(图2~3)。

图2Westernblot、免疫组化及qRT-PCR检测大鼠前额叶神经元Aβ、APPmRNA表达情况
注:A:qRT-PCR检测各组大鼠前额叶APP mRNA的表达;B: Western blot检测各组大鼠前额叶Aβ水平灰度值;C:免疫组化检测各组大鼠前额叶Aβ水平的光密度值。与正常组比较,*P< 0.05,**P< 0.01;与糖尿病组第8周比较,#P< 0.05,##P< 0.01,###P< 0.001

图3 Western blot、免疫组化及qRT-PCR检测各组大鼠前额叶神经元相关蛋白、mRNA表达情况
注:A:各组大鼠前额叶部位Beclin-1 mRNA表达情况;B: Western blot检测各组大鼠前额叶部位Beclin-1灰度值; C:免疫组化检测各组大鼠前额叶部位Beclin-1的光密度值;D:各组大鼠前额叶部位LC3Ⅰ mRNA表达情况; E:各组大鼠前额叶部位LC3ⅡmRNA表达情况;F:Western blot检测各组大鼠前额叶部位LC3Ⅱ/ Ⅰ灰度值比值;G:免疫组化检测各组大鼠前额叶部位LC3Ⅱ/Ⅰ的光密度值比值;H:Western blot检测各组大鼠前额叶部位p62灰度值。与正常组比较,*P< 0.05,**P< 0.01,***P< 0.001;与糖尿病组第8周比较,#P< 0.05,##P< 0.01,###P< 0.001
2.4 Western blot结果
与正常组大鼠相比,糖尿病组大鼠第8周时Aβ蛋白表达明显升高(P=0.005),第10周时Aβ蛋白表达较正常组升高(P=0.021),且高于第8周时糖尿病组的水平(P=0.035),第12周时Aβ蛋白表达升高明显(P=0.011),同样也高于第8周时糖尿病大鼠的表达水平(P=0.008)。且随着时间延长,Aβ蛋白表达逐渐升高(r2=0.961,P<0.001)。第8周时糖尿病大鼠前额叶部位Beclin-1蛋白表达升高(P=0.035),第10周时Beclin-1蛋白表达同样升高(P=0.005),第12周时Beclin-1蛋白表达与正常组相比升高更为明显(P<0.001)。LC3 Ⅱ/Ⅰ蛋白灰度值比较结果显示,第8周时糖尿病组大鼠前额叶部位LC3 Ⅱ/Ⅰ比值较正常组升高(P=0.005),到第10周时LC3 Ⅱ/Ⅰ比值较正常组升高(P=0.003),且高于第8周时LC3 Ⅱ/Ⅰ的表达(P=0.008),第12周时糖尿病组大鼠LC3 Ⅱ/Ⅰ比值明显高于正常组大鼠(P<0.001),且明显高于第8周时糖尿病组的水平(P<0.001)。两组大鼠前额叶部位p62蛋白水平在第8、10、12周时表达差异无统计学意义(P>0.05)(图3~4)。

图4Westernblot检测各组大鼠前额叶神经元相关蛋白的表达情况
2.5 免疫组化结果
2.5.1 Aβ阳性细胞表达 与正常组大鼠相比,糖尿病大鼠前额叶部位自第8周始可见大量的Aβ阳性细胞,光密度值明显高于正常组(P=0.008),第10周时前额叶部位Aβ阳性细胞的光密度值高于正常组(P=0.004),且同样高于第8周时Aβ表达(P=0.005)。第12周时糖尿病组Aβ阳性细胞的光密度值明显高于正常组(P=0.003),也高于第8周时糖尿病组Aβ的表达(P<0.001)。且随着糖尿病病程延长,Aβ阳性细胞数目明显增加(r2=0.960,P<0.001)(图2、图5)。

图5 免疫组化检测各组大鼠前额叶神经元Aβ的表达情况(×200)
注:A:正常组;B:糖尿病组第8周;C:糖尿病组第10周;D:糖尿病组第12周
2.5.2 Beclin-1阳性细胞表达 第8周时与正常组大鼠相比,糖尿病大鼠前额叶部位可见大量的Beclin-1阳性细胞,光密度值明显高于正常组(P=0.005);第10周时前额叶部位Beclin-1阳性细胞的光密度值高于正常组(P=0.003),且同样高于第8周时Beclin-1的表达(P=0.004)。第12周时糖尿病组Beclin-1阳性细胞的光密度值明显高于正常组(P<0.001),也高于第8周时糖尿病组Beclin-1的表达(P<0.001)(图3、图6)。

图6免疫组化检测各组大鼠前额叶神经元Beclin-1的表达情况(×200)
注:A:正常组;B:糖尿病组第8周;C:糖尿病组第10周;D:糖尿病组第12周
2.5.3 LC3Ⅰ阳性细胞的表达 与正常组大鼠相比,糖尿病大鼠前额叶部位在第8、10、12周时可见LC3Ⅰ阳性细胞数量减少(图7)。

图7免疫组化检测各组大鼠前额叶神经元LC3Ⅰ的表达情况(×200)
注:A:正常组;B:糖尿病组第8周;C:糖尿病组第10周;D:糖尿病组第12周
2.5.4 LC3Ⅱ阳性细胞的表达 与正常组大鼠相比,第8、10、12周时糖尿病大鼠前额叶部位可见大量的LC3Ⅱ阳性细胞(图8)。LC3Ⅱ和LC3Ⅰ蛋白光密度值的比值显示:第8周时,糖尿病大鼠前额叶部位LC3Ⅱ/Ⅰ比值高于正常组(P=0.005),第10周时同样高于正常组(P=0.027),但较第8周时LC3Ⅱ/Ⅰ比值差异无统计学意义(P=0.078;第12周时糖尿病组大鼠前额叶部位LC3Ⅱ/Ⅰ光密度比值高于正常组(P=0.031),同样高于第8周时糖尿病组LC3Ⅱ/Ⅰ光密度比值(P=0.041)(图3)。

图8免疫组化检测各组大鼠前额叶神经元LC3Ⅱ的表达情况(×200)
注:A:正常组;B:糖尿病组第8周;C:糖尿病组第10周;D:糖尿病组第12周
2.5.5 Aβ表达水平与自噬相关蛋白表达的相关性Western blot检测蛋白灰度值的结果显示,糖尿病组大鼠前额叶部位Aβ表达与Beclin-1表达呈正相关(r2=0.671 0,P<0.01);免疫组化结果显示,Aβ表达与Beclin-1表达呈正相关(r2=0.955 8,P<0.001);Western blot检测蛋白灰度值的结果显示,Aβ表达与LC3Ⅱ/Ⅰ的比值呈正相关(r2=0.799 2,P<0.01);免疫组化结果显示,Aβ表达与LC3Ⅱ/Ⅰ的比值表达呈正相关(r2=0.889 1,P<0.001)(图9)。

图9糖尿病组大鼠前额叶部位Aβ与自噬相关蛋白表达的相关性
注:A:Western blot结果中糖尿病大鼠前额叶部位Aβ与LC3Ⅱ/ Ⅰ灰度值的相关性;B:Western blot结果中糖尿病大鼠前额叶部位Aβ与Beclin-1灰度值的相关性;C:免疫组化结果中糖尿病大鼠前额叶部位Aβ与Beclin-1光密度值的相关性;D:免疫组化结果中糖尿病大鼠前额叶部位Aβ与LC3Ⅱ/ Ⅰ光密度值的相关性
3 讨论
自噬是指从粗面内质网的无核糖体附着区脱落的双层膜包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分,形成自噬体或自噬液泡,并与溶酶体融合形成自噬溶酶体,以实现细胞本身的代谢需要和某些细胞器的更新,完成对包裹物质的降解和循环再利用。自噬在细胞清除废物、结构重建、生长发育中起重要作用。自噬抑制后导致变性蛋白和失能细胞器等清除延迟以及异常蓄积,从而诱发相应的病理过程[4-5]。AD患者脑内存在Aβ的过度聚集,最近研究[6]显示,自噬是降解和清除异常聚集蛋白的主要机制。国外众多学者研究[7]发现,STZ诱导的糖尿病大鼠成模第8周时即出现认知功能下降,而且糖尿病大鼠成模第14周后的死亡率增加,故选取在成模第8、10、12周作为检测糖尿病大鼠的行为学和相关指标的时间点。本研究发现,STZ诱导的糖尿病大鼠在成模第8周时Morris水迷宫测试结果可见潜伏期延长,穿越目标区域次数减少,表现出空间学习能力下降,提示糖尿病大鼠出现明显认知功能障碍,这与国外研究结果一致。Aβ不能清除或者降解时,在脑内聚集并纤维化,进一步形成老年斑,这是AD发病的中心环节和重要病理学基础。前期研究[3]发现,STZ诱导的糖尿病大鼠海马及前额叶神经元部位Aβ蛋白沉积,合并认知障碍。本研究发现,前额叶神经元可见Aβ沉积,同时伴有自噬相关蛋白Beclin-1表达增加,LC3Ⅱ/Ⅰ比值升高,提示自噬激活。通常情况下,自噬水平激活,p62水平下降,清除异常聚集蛋白能力增加。但在本研究中,p62表达水平不变,同时Aβ沉积未改善,且Aβ表达与自噬相关蛋白的表达呈正相关性,提示可能自噬体包裹Aβ蛋白后,自噬流不通,导致Aβ清除障碍,大量Aβ沉积,进一步加重神经系统的损害,导致认知功能障碍。自噬体包裹异常蛋白后,会与溶酶体融合进一步消化分解,故推测自噬流不通的原因可能与溶酶体功能异常相关,导致蛋白聚集后的清除障碍。这需要进一步研究前额叶部位的溶酶体功能来明确,也是下一步研究重点。
