高滴度慢病毒制备及其感染人原代T细胞的条件优化*
2019-03-13欧阳寒梅代正群叶鑫宇
欧阳寒梅, 罗 丹,王 欣,刘 雯,游 露,代正群,杨 艳,叶鑫宇, 邹 强Δ
1.成都医学院 基础医学院(成都610500);2.成都医学院 科研实验中心 (成都610500)
CAR-T技术已经在癌症治疗中显示出广阔的发展前景,这种方法正在引发癌症免疫治疗的革命性转变。所谓CAR-T,即使用经遗传修饰的原代T细胞来表达嵌合抗原受体(CAR)基因,通过使用质粒转染,mRNA或慢病毒技术将CAR转导到T细胞中稳定表达以构建CAR-T细胞,回输到人体后靶向识别杀伤肿瘤细胞[1]。到目前为止,全球已经有两款针对血液性恶性肿瘤的自体型CAR-T上市,他们都是通过慢病毒转导的方法将目的基因转导进T细胞稳定表达,慢病毒对T细胞的转导效率是CAR-T技术的关键性步骤。慢病毒(lentivirus,LV)属于逆转录病毒科(Retrovidae),为RNA病毒,包括人免疫缺陷病毒(HIV)和猴免疫缺陷病毒(SIV)等。如今,LV技术已成为在体内外将外源基因传递到各种类型细胞中的最有效工具之一[2-5]。慢病毒转导基因的优点在于不仅能够感染多种分裂和非分裂细胞,还可以高效的将目的基因整合到宿主基因组并长期稳定表达[6]。LV载体设计中的许多不同修饰提高了其生物安全性和基因表达的效率。然而,LV的广泛应用依赖于对不同类型细胞的感染条件的优化[7]。其中,人原代T细胞的高效转导仍然具有挑战性,并且实现有效基因转导的方法通常昂贵且耗时[8]。为了建立高效稳定的制备高滴度病毒载体的方法及T细胞的高效转导方法,本研究拟探究高滴度慢病毒制备条件及T细胞高效转导条件,以提高T细胞基因转导效率,进一步为CAR-T疗法节约时间和成本。
1 材料与方法
1.1 材料
LV质粒系统:LV载体系统由pLP1、pLP2、pLP-VSVG和pLVX-EGFP组成(美国Thermo Fisher Scientific公司),pMD2.G,pSPAX2,pWPXL(Addgene公司,美国)。包装细胞系:人胚肾细胞293FT细胞(美国ATCC公司)。流式细胞仪(美国ACEA Biosciences公司,Inc)。宿主菌:质粒转化宿主菌为DH5a(诺唯赞公司,中国)。Jurkat细胞(美国ATCC公司)。人原代T细胞(人外周血中提取)。质粒无内毒素大提试剂盒(德国Qiagen公司,货号12362),转染试剂Lipofectamine®3000 Transfection Reagent(美国Thermo Fisher Scientific公司,货号L3000-015),细胞培养基础培养基为高糖DMEM和1640(美国Hyclone公司,货号SH30243.01B),细胞培养血清为胎牛血清(澳洲BOVOGEN公司,货号SFBS)。细胞因子IL-2(美国eBioscience公司,货号11-7021-71)、IL-7和IL-15(德国Cellgenix公司,货号1413-050)。
1.2 方法
1.2.1 纯化质粒 将pLP1、pLP2、pLP-VSVG和pLVX-EGFP四质粒分别转化到DH5a中,涂板后置于37 ℃培养箱培养12~16 h。挑取单个菌落于4 mL含氨苄的LB培养基中震荡培养12 h,然后接150 uL菌液于含氨苄的100 mL LB培养基的锥形瓶中震荡培养12~16 h,然后用QIAGENE 无内毒素提取试剂盒纯化质粒。
1.2.2 细胞培养 将293FT细胞按照 1.2×105cells/mL的密度传代于10 cm培养皿中,用含10%FBS的DMEM培养液于37 ℃、5% CO2培养箱中培养过夜,待细胞生长到80%~90%汇合时转染。
1.2.3 LV包装和浓缩 1)制备A管:将pLP1、pLP2、pLP-VSVG和pLVX-EGFP四种质粒和P3000 Reagent和适量的Opti-MEM混合。2)制备B管:将Lipofectamine 3000 Reagent与适量的Opti-MEM混合。将A管与B管混匀,室温孵育15~20 min。最后将孵育好的混合液滴加到细胞汇合度为80%~90%的培养皿中,混匀,37 ℃、5% CO2培养箱中培养。48 h时收集LV上清液,用0.45 μm的滤膜过滤病毒后用超滤管超滤浓缩病毒。
1.2.4 滴度检测 Jurkat细胞以100 000个/孔接种于96孔板中,每孔加100 uL含10%FBS培养基,第1孔中加入待测病毒原液20 uL,此后每孔依次按5∶1倍比稀释直到稀释625倍,最后一孔作空白对照。96 h后从测定滴度的孔中取20 uL细胞稀释20倍后用流式细胞仪检测器通道FL-1检测EGFP荧光表达率。病毒滴度计算:阳性率×细胞/孔×1 000/加入的病毒体积。
1.2.5 LV转导T细胞 采用不同类型的浓缩的和未浓缩的LV转导不同活化程度下的T细胞,转导后96 h检测转导效率,通过转导效率换算滴度。
1.2.6 包装系统对LV滴度的影响 采用二代和三代LV包装系统分别搭配二代和三代LV包装载体(共4组)制备LV后分别用Jurkat细胞测定滴度。
1.2.7 启动子对LV滴度的影响 采用第三代LV包装系统搭配不同启动子的LV载体(共两组)制备LV后用Jurkat细胞测定滴度。
1.2.8 冻融和在4 ℃置放不同天数对LV滴度的影响 冻融病毒1、2、3次后用Jurkat细胞测定滴度(滴度测定/次);病毒在4 ℃置放5 d,用Jurkat细胞测定滴度(滴度测定/天)。
1.2.9 磁珠活化T细胞对LV转导T细胞转导效率的影响 用LV分别转导加磁珠活化的T细胞和不加磁珠活化的T细胞(共两组);用LV感染不同磁珠量活化的T细胞(共4组),然后用流式细胞仪检测转导效率。
1.2.10 T细胞活化不同天数对LV转导效率的影响 T细胞活化后不同时相点转导LV(共4组),然后用流式细胞仪检测转导效率。
1.3 统计学方法
采用GraphPad Prism7软件进行统计分析,组间比较采用t检验,检验水准α除特别说明外均设定为0.05。
2 结果
2.1 不同LV包装系统对病毒滴度的影响
二代和三代LV包装系统搭配不同LV载体pLVX-EGFP和pWPXL制备慢病毒,然后用Jurkat细胞测定滴度,病毒滴度测定结果显示三代LV包装质粒搭配pLVX-EGFP制备病毒滴度较搭配pWPXL高(P<0.05),二代LV包装系统搭配pWPXL制备病毒滴度较搭配pLVX-EGFP高(P<0.05)(图1)。
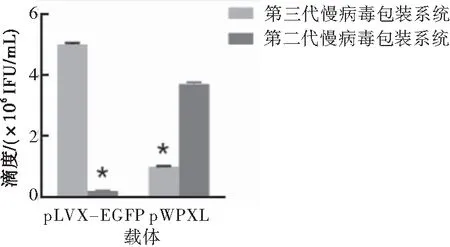
图1二代和三代LV包装系统搭配二代和三代慢病毒载体制备LV感染Jurkat细胞滴度
注:与三代慢病毒包装系统搭配pLVX-EGFP制备的病毒相比较,*P<0.05;与二代慢病毒包装系统搭配pWPXL包装的病毒相比较,*P<0.05
2.2 不同启动子对病毒滴度的影响
采用相同LV载体pLVX-EGFP,不同启动子EF-1a和CMV搭配三代LV包装质粒制备慢病毒感染T细胞,结果显示EF-1a启动子感染T细胞的滴度高于CMV启动子(P<0.05),故EF-1a启动子优于CMV启动子(图2)。
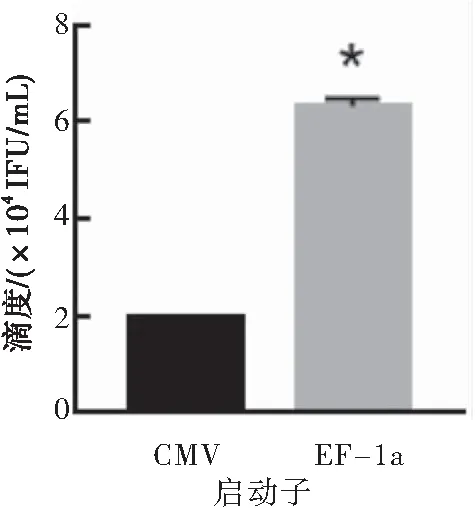
图2CMV启动子和EF-1a启动子搭配第三代LV包装系统包装慢病毒的滴度
注:与CMV启动子的载体搭配三代慢病毒包装系统制备的慢病毒相比较,*P<0.05
2.3 病毒反复冻融和在4 ℃置放不同天数后对滴度的影响
病毒在4 ℃置放1 d滴度无明显变化,置放2 d滴度下降46%,置放3 d滴度下降68%。病毒在-80 ℃冻融1次滴度下降8%,冻融两次滴度下降35%,冻融3次滴度下降71%。病毒在4 ℃置放2 d及以上和冻融两次及以上与无置放无冻融的病毒原液相比滴度下降较多(P<0.05),会较大地影响病毒活性,进而影响靶细胞的感染效率(图3)。
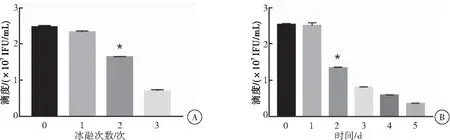
图3慢病毒循环冻融3次和在4℃存储5d的滴度
注:A:慢病毒循环冻融3次后分别检测病毒滴度,与无冻融病毒相比较,*P<0.05;B:慢病毒在4 ℃置放5 d后分别检测病毒滴度,与无置放的病毒相比较,*P<0.05
2.4 磁珠活化T细胞对T转导效率的影响
活化的T细胞比不活化的T细胞LV感染率高(P<0.05),不活化时T细胞感染率极低,由此推测活化的细胞有利于促进LV的转导。磁珠与细胞的比例在0∶1时感染率极低,在0.5∶1,1∶1,3∶1时感染率相差不大,差异无统计学意义(P>0.05),故磁珠与细胞比例在0.5∶1及以上对T细胞的感染率影响不大(图4)。

图4 磁珠活化T细胞对T转导效率的影响
注:A:慢病毒转导磁珠活化与不活化的T细胞后检测转导效率,与有磁珠活化的T细胞相比较,*P<0.05;B:慢病毒转导不同量的磁珠活化T细胞后检测转导效率
2.5 T细胞活化不同时相点转导LV对转导效率的影响
分别在T细胞活化后0、24、48、72 h转导LV,结果显示T细胞活化后24 h滴度较高,48、72 h滴度呈逐渐降低趋势,故活化后24 h为较佳感染时相点(P<0.05)(图5)。
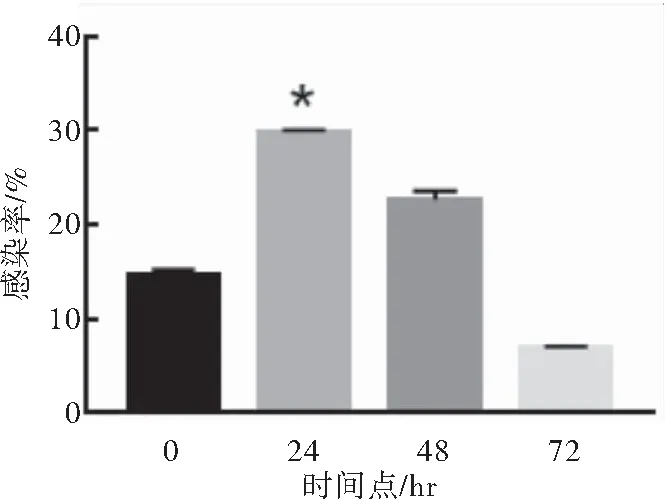
图5 T细胞活化后不同时相点的慢病毒转导效率
注:分别在T细胞活化后0、24、48、72 h转导慢病毒,与0、48、72 h相比较,*P<0.05
3 讨论
研究结果显示三代LV包装质粒搭配三代LV载体pLVX-EGFP和二代LV包装质粒搭配二代LV载体pWPXL病毒滴度较高,其中三代LV包装质粒搭配pLVX-EGFP病毒滴度较高。且三代LV载体较二代安全性更高,因为三代在二代的基础上删除了病毒tat基因,该基因对野生型人类免疫缺陷病毒1型(HIV-1)的复制至关重要;为了降低质粒扩增和病毒载体制备过程中重组的风险,将载体包装功能分成三个独立的质粒而不是两个质粒。改变3′LTR使载体“自失活”,以防止整合基因被重新包装;用异源外壳蛋白VSV-G代替天然HIV-1包膜蛋白,这些改造都使三代安全性更高,且三代滴度较二代高,因此推荐使用三代慢病毒包装系统。
CMV启动子和EF-1a启动子为载体中最常用的启动子,故本研究对比了二者对慢病毒表达效率的影响。研究结果显示,相同载体不同启动子(CMV启动子和EF-1a启动子)搭配LV包装质粒制备病毒,用Jurkat细胞检测病毒滴度,EF-1a启动子包装的病毒滴度及表达效率都高于CMV启动子,在T细胞上的表达结果亦是如此。Teschendorf C等的研究结果显示用EF-1α启动子产生稳定的HT-29克隆,其中>97%的所有细胞均匀地表达GFP。相反,在携带CMV启动子的克隆中,仅高达60%的细胞是GFP阳性的,细胞之间的表达水平变化很大。在体内,携带EF-1α启动子的肿瘤是均一的GFP阳性,而CMV启动子产生GFP表达呈散在的分布模式[9]。但是研究[10]结果表明在293T细胞上表达绿色荧光蛋白,CMV启动子优于EF-1a启动子。分析原因可能是由于不同启动子在不同细胞中驱动活性不一致,提示基因表达研究时应选取适宜的启动子以驱动目的基因的高效表达,本研究结果显示当目的基因在T细胞上表达时适宜选用EF-1a启动子。
LV收集和浓缩后的保存也是影响病毒活性的一个重要条件。研究[11]结果表明当病毒在4 ℃(t=1.3 d)储存或经历多次冻融循环(t= 1.1轮)时,浓缩和非浓缩慢病毒的感染效率迅速降低。因此本研究探索了病毒在4 ℃储存不同天数和在-80 ℃反复冻融滴度下降的具体情况。LV在4 ℃储存2 d病毒滴度下降46%,-80 ℃冻融两次滴度下降35%,进而导致病毒活性大大降低,进一步影响靶细胞感染率。因此不建议病毒反复冻融和在4 ℃储存太长时间,在4 ℃储存1 d和在-80 ℃冻融1次LV滴度下降低于10%,是可接受的范围。
本研究结果显示T细胞活化与否决定了LV能否转导T细胞。成熟的成人T细胞可分为2个不同的亚群,即记忆和幼稚T细胞。天然T细胞作为基因治疗的靶细胞尤其重要,因为它们保持对新抗原的反应能力。同样至关重要的是,基因转导进T细胞后不会显著改变T细胞对抗原的反应。现在普遍认为构成体内大部分循环T细胞库的静息T细胞不能通过慢病毒载体转导[12-14]。慢病毒载体LV可以转导许多类型的非增殖细胞,除了一些特定的静止细胞类型,例如静息T细胞和B细胞。到目前为止,尽管对阻碍LV转导静止细胞的限制条件有广泛的了解,但设计能够稳定转导静止淋巴细胞的VSVG-LV还是不可能的[15],除非通过T细胞受体(TCR)或存活细胞因子诱导他们进入细胞周期的G1期,否则逆转录(RT),核输入以及随后的水泡性口炎病毒G蛋白假型LV(VSVG-LV)基因组的整合都不会发生[16]。据报道[17-19],诱导静息T细胞进入细胞周期的G1b期而不引发细胞分裂可使它们允许用HIV-1载体转导。本研究利用CD3/CD28磁珠及IL-2、IL-15等细胞因子刺激活化T细胞,结果显示LV在T细胞上的转导效率大大提高,提示CD3/CD28磁珠及IL-2、IL-15等细胞因子刺激T细胞有利于促进T细胞进入G1期,从而提高T细胞的LV转导效率。
T细胞活化后较佳转导时相点的探索过程中,本研究前期结果表明静息的T细胞不能被LV感染,通过CD3/CD28磁珠及IL-2等细胞因子诱导T细胞进入G1期才能被LV转导。因此,本研究进一步探索了T细胞活化后大多数细胞进入G1期的时相点,以进一步提高T细胞的转导效率。本研究在T细胞活化后0、24、48、72 h分别转导LV,结果显示0~24 h时转导效率逐渐上升,24 h以后转导效率呈递减趋势,因此确定了T细胞活化后24 h为较佳转导时相点,可以推测此时绝大部分细胞已经进入G1期,能够被LV转导。
综上所述,在慢病毒包装时适宜选用三代慢病毒包装系统,慢病毒包装载体适宜选用EF-1a启动子的载体。制备好的病毒最多允许冻融一次和在4 ℃储存一天,反复冻融超过两次或在4 ℃储存时间超过一天病毒滴度下降较多,从而影响病毒活性,进一步影响靶细胞的LV转导效率。T细胞活化后24 h LV的转导效率较高。