原发性肝癌免疫治疗的现状及未来
2019-03-13卢姗姗陆荫英白文林
刘 淦,孙 杰,张 婷,卢姗姗,向 姣,曾 珍,陆荫英,白文林
原发性肝癌是中国第三位致死性肿瘤,其中85%~90%以上是肝细胞癌(hepatocellular carcinoma,HCC)[1]。根据巴塞罗那临床分期系统(Barcelona clinic liver cancer,BCLC)的定义,进展期/晚期HCC指失去手术切除可能,并出现门静脉侵袭,肝外转移的恶性原发性HCC。晚期HCC通常缺少手术指征,除少数给予局部治疗降低肿瘤负荷,提高生存质量的姑息治疗外,主要采用系统性治疗。晚期HCC治疗方法包括辅助化疗、靶向治疗、免疫治疗等[2]。近两年,随着相关临床试验的开展,肿瘤免疫治疗因其突出的有效性和安全性,在中晚期HCC的治疗中受到越来越广泛的关注。本综述将着重介绍免疫检查点抑制剂(immune checkpoint blockage,ICB)、肿瘤免疫疫苗、溶瘤病毒、溶瘤细菌、免疫细胞治疗及联合治疗等方法在HCC治疗中的应用及未来。
1 肿瘤免疫治疗及HCC的免疫特征
肿瘤免疫是一个复杂的过程,主要包括以下7个环节:①肿瘤抗原释放;②肿瘤抗原提呈;③启动和激活免疫细胞;④T细胞向肿瘤组织迁移;⑤肿瘤组织T细胞浸润;⑥T细胞识别肿瘤细胞;⑦清除肿瘤细胞等。在正常状况下,免疫系统可以识别并清除肿瘤微环境中的肿瘤细胞。病理状态下,随着肿瘤进展,肿瘤细胞可通过各种方式抑制人体免疫系统,使其不能正常杀伤肿瘤细胞,出现免疫逃逸。肿瘤免疫治疗就是通过重新激活人体免疫系统,恢复机体正常的抗肿瘤免疫反应,依靠机体自身免疫机能控制、清除肿瘤细胞和肿瘤组织的一种治疗方法[3]。肿瘤免疫治疗可以分为主动免疫治疗、被动免疫治疗两类(如图1所示)。主动免疫治疗是通过作用于机体免疫系统,改善免疫功能来达到杀伤肿瘤的效果;被动(获得性)免疫治疗则是通过直接作用于肿瘤细胞本身来杀伤肿瘤细胞。
肝脏是人体重要的免疫器官,肝内富含巨噬细胞(Kuffer细胞)及各类天然免疫细胞,如NK细胞和NKT细胞等,在人体正常免疫功能的维持过程中发挥重要作用。HCC是一种炎性肿瘤,往往有高密度的T细胞浸润,表现出以下免疫特征:①肿瘤相关抗原提呈、处理障碍;②调节性T细胞(regulatory cells,Tregs)负向调控CD8+T细胞活性,降低CD4+/ CD8+T细胞比值;③CD4+T细胞辅助功能降低;④程序性细胞死亡蛋白-1(programmed death-1,PD-1)/程序性死亡配体1(programmed death-ligand 1,PD-L1)通路激活抑制免疫功能;⑤NK细胞数量减少及功能降低。以上各种免疫抑制特征也为HCC的免疫治疗指明了方向。

图1 肿瘤免疫治疗策略Figure 1 Strategy for tumor immunological therapy
2 免疫检查点抑制剂
ICB是近些年发展最迅速的免疫治疗手段之一,其主要通过恢复机体受抑制的免疫功能,达到杀伤肿瘤的作用。T细胞在机体抗肿瘤过程中发挥重要作用,突变的肿瘤细胞被免疫系统识别后即被清除;而表面高表达PD-L1的肿瘤细胞可以通过结合T细胞表面的PD-1,使机体误将肿瘤细胞认为是自体细胞,从而抑制免疫系统对肿瘤细胞的杀伤作用。PD-1被称为免疫检查点,与PD-L1结合的免疫抑制信号也被形象地称为 别杀我 信号。而ICB通过小分子/单克隆抗体等阻断肿瘤细胞表面异常高表达的PD-L1与免疫细胞表面PD-1的结合,使肿瘤浸润淋巴细胞得以恢复杀伤活力,达到杀伤肿瘤细胞的目的。
现阶段的ICB主要以PD-1/PD-L1和CTLA-4作为治疗靶点。在晚期HCC治疗中,ICB如Nivolumab(Opdivo)、Pembrolizumab(Keytruda)、Camrelizumab(SHR-1210)等均具有相当疗效,下面将着重介绍这3项 II期临床试验。
CheckMate-040纳入262例晚期HCC患者(肝功能Child-Pugh评级为A~B7),48例入组Nivolumab剂量爬坡试验,其中12例出现3级及以上不良反应,包括AST、ALT、淀粉酶升高等,但总体安全且可耐受,最终确定治疗剂量为3 mg/kg。剩余的214例HCC患者入组Nivolumab剂量扩大试验,根据是否对Sorafenib耐药、是否有病毒感染分成4组:未接受Sorafenib治疗且无病毒感染组、Sorafenib耐药且无病毒感染组、Sorafenib耐药且HBV感染组与Sorafenib耐药且HCV感染组等。HBV携带者接受抗病毒治疗,同时每2周接受3 mg/kg的Nivolumab治疗。结果发现采用Nivolumab的晚期HCC患者的中位无疾病进展期(median progression-free survival,mPFS)为4.0(2.9~5.4)个月,中位生存期(median overall survival,mOS)尚未达到研究终点,客观缓解率(objective response rate,ORR)达到20%,疾病控制率(disease control rate,DCR)更是达到64%,其中22.0%的患者肿瘤负荷下降超过30%;51.4%的患者因为疾病进展在后期中断治疗,低于SHARP研究中76%的Sorafenib治疗中断比例,提示Nivolumab较Sorafenib具有更好的疗效,更低的不良反应率[4]。2017年9月23日,美国FDA批准Nivolumab作为二线用药,用于Sorafenib治疗失败的HCC患者,标志着HCC治疗正式进入免疫时代。
Keynote-224是一项非随机多中心开放标签的II期临床试验,共纳入104例Sorafenib治疗失败的晚期HCC患者,均具有良好的肝功能:Child-Pugh A级。入组患者每3周静脉注射200 mg Pembrolizumab,疗程约2年或直至疾病进展,以此评估Pembrolizumab的疗效。结果表明Pembrolizumab治疗后患者的mPFS为4.9(3.4~7.2)个月,mOS为12.9(9.7~15.5)个月;同时ORR达到17%, DCR达到62%[病情稳定(stable diseases,SD)患者占46%];其中15%的患者出现3级及以上不良反应,包括AST、ALT升高,腹泻等,但总体安全且可耐受[5]。鉴于Pembrolizumab在治疗HCC中的有效性与安全性,美国FDA于2018年11月9日加速批准Pembrolizumab作为二线用药,用于Sorafenib治疗失败的HCC患者。
此外,秦叔逵团队领衔的国产PD-1单抗Camrelizumab(SHR-1210)在晚期HCC治疗中取得重要突破。该项研究纳入了217例晚期HCC患者,受试者入组时病情较其他PD-1药物临床试验患者更为严重:更多BCLC分期为C期的患者(占94.9%),更高的HBV感染率(占83.9%),更多肝外转移(占81.6%),更高的AFP(AFP≥400 ng/ml者占51.2%)等。经SHR-1210治疗后,患者总的ORR达到了13.8%,而6个月的OS为74.7%,与Nivolumab、Pembrolizumab等疗效相当,且不良反应可耐受[6]。上述提示其具有成为晚期HCC患者二线治疗用药的潜力。
ICB治疗晚期HCC患者的ORR虽然有所突破,但仍有较大的提升空间。现阶段并非每个晚期HCC患者均能从ICB治疗中获益,因此,开发预测ICB疗效的方法,评估患者是否适合进行ICB治疗显得非常重要。研究指出对比治疗前后关键基因变化可以为ICB的疗效和肿瘤预后预测提供指导和借鉴;治疗后肿瘤组织原位PD-L1表达的下降,能够反映在ctDNA中,即肿瘤原位组织和ctDNA中PD-L1的表达具有相同的变化趋势,因而ctDNA中PD-L1的含量变化可以作为肿瘤免疫治疗反应、mPFS、mOS等的准确预测因素[7-8]。Xu等[9]最新研究则指出,检测循环肿瘤细胞(circulating tumor cells,CTC)中PD-L1表达水平可以预测免疫抑制剂PD-1疗效:CTC中高表达PD-L1(>20%的阈值)的患者,ORR达到47.8%[23例中有11例部分缓解(partial response,PR)],CTC中PD-L1表达低于20%患者的ORR为0(12例患者无一肿瘤明显缩小)。此外,检测肿瘤组织中肿瘤突变负荷(tumor mutation burden,TMB),即检测每百万碱基中体细胞基因编码错误、碱基替换、基因插入或缺失错误的总数,同样可以预测PD-1疗效。一项通过检测100 000例患者肿瘤组织的315个基因评估TMB的研究发现,与全基因、全外显子检测相比,该检测准确率高达95%以上,提示315个基因组合即能较全面的评估TMB;同时该研究还发现,在这167种不同肿瘤患者中,TMB高的患者可以从免疫疗法中受益[10]。再者,检测血液中衍生的中性粒细胞值(derived neutrophil lymphocyte,dNLR),即中性粒细胞与其他白细胞的比值,以及乳酸脱氢酶(lactate dehydrogenase,LDH)同样可以用来预测治疗预后。如根据dNLR是否>3、LDH是否超过正常值,将晚期非小细胞肺癌患者分成三类:低危(2个都不超标)、中危(有1个指标超标)、高危(2个都超标),三类患者的mOS分别为16.5个月、10.0个月和4.8个月[11]。
综上,现阶段ICB治疗晚期HCC患者的ORR约为20%,展现出可喜的疗效。随着更多ICB III期临床试验的推进(表1),其ORR有望进一步突破。同时,开发更加灵敏、高效的预测手段,有助于ICB治疗更准确地惠及潜在的晚期HCC患者,让适合ICB疗法的患者从中获益。这将重新定义免疫治疗在HCC治疗中的地位,并有望开创HCC免疫治疗新局面。
3 溶瘤病毒及溶瘤细菌
近几年,随着合成生物学的快速发展,应用Pexa-Vec溶瘤病毒治疗HCC患者的临床试验受到广泛关注。Pexa-Vec能够靶向肿瘤细胞,除能直接裂解细胞外,还可表达免疫刺激细胞因子如粒细胞-巨噬细胞集落刺激因子,激活肿瘤特异性免疫应答;此外,还可感染血管相关内皮细胞使肿瘤微血管萎缩,通过多种途径共同杀伤肿瘤细胞。一项Pexa-Vec联合Sorafenib治疗晚期HCC患者的II期临床试验结果表明,联合治疗能够减缓HCC进展速度,延长晚期HCC患者的生存期,该项目的III期临床试验正在进行中[12-14]。此外,携带有基因开关的第三代智能溶瘤病毒SynOV,可以利用基因开关进行可预测性地编程,控制溶瘤病毒靶向肿瘤。其模块化的设计理念,可实现产品的快速迭代,并具有很强的移植性,可以快速研发针对不同实体瘤的疫苗[15]。目前,清华大学谢震团队开发的溶瘤病毒带有多个基因开关,可以定量杀伤肿瘤,其在HCC临床前试验中已取得可喜的成果[16],将在不久的将来开展相关临床试验。
表1 ICB治疗晚期HCC患者的期临床研究Table 1 Phase clinical trials of ICB for advanced HCC

表1 ICB治疗晚期HCC患者的期临床研究Table 1 Phase clinical trials of ICB for advanced HCC
研究药物 研究名称 开始时间(年) 入组患者 入组数(例)Nivolumab CheckMate 459 2015 进展期肝癌一线治疗 729 Nivolumab CheckMate 9DX 2018 肝切除或消融后高复发风险的患者 530 Piembrolizumab Keynote 240 2016 系统治疗失败的肝细胞癌患者 408 Piembrolizumab Keynote 394 2017 亚洲经治晚期肝细胞癌患者 330 Durvalumab and Tremelimumab HIMALAYA 2017 不可切除肝细胞癌患者一线治疗 1200 Atezolizumab IMbrave150 2018 不可切除或转移性肝细胞癌患者一线治疗 480 BGB-037 百济神州 2018 不可切除或转移性肝细胞癌患者一线、二线治疗 600
除了溶瘤病毒,溶瘤细菌在肿瘤治疗中也初显成效。甲硫氨酸是细胞存活所必需的氨基酸,其缺失会导致细胞死亡。广州工业大学郭子健团队利用基因工程手段构建的减毒沙门菌具有极强的肿瘤靶向性,同时携带特异性消耗氨基酸的酶。临床前试验证实将该菌经静脉输入机体后,其能够特异性靶向肿瘤细胞,通过消耗肿瘤细胞的甲硫氨酸,破坏肿瘤内部微环境杀伤肿瘤;此外,破碎的肿瘤细胞则可释放相关肿瘤抗原引发肿瘤局部免疫反应,同时释放的溶瘤细菌可杀伤残存的肿瘤细胞。而机体免疫系统对该种溶瘤沙门菌具有很强的杀伤作用,能够保证其安全性。该团队进行的溶瘤细菌治疗晚期HCC患者的I期临床试验也证实该疗法的初步疗效及安全性,后续扩大样本的临床试验正在进行中[17]。
溶瘤病毒和溶瘤细菌作为两种新型的肿瘤免疫治疗方法,尽管仍处于临床研究早期阶段,但其展现的巨大肿瘤杀伤潜力:特异性杀伤肿瘤细胞的同时激活机体肿瘤免疫的双重功效,使其一直以来都备受关注。
4 肿瘤免疫疫苗
肿瘤免疫疫苗疗法是将肿瘤细胞、肿瘤相关蛋白或多肽、肿瘤抗原的表达基因等导入患者体内,增强免疫原性,激活患者自身的免疫系统,诱导机体细胞免疫和体液免疫应答,从而达到控制或清除肿瘤的方法。一系列临床试验结果揭示了肿瘤免疫疫苗在HCC治疗中的安全性和有效性。①蒙古国开展的HCC疫苗Hepcortespenlisimut-L(Hepko-V5)II期临床试验,对入组的75例晚期HCC患者(均具有不同程度肝硬化,Child Pugh A~C级,其中Child-Pugh C级患者占33.4%)进行了为期2个月的疫苗治疗,随访12个月后发现66.7%的患者肿瘤缩小,并伴随AFP水平下降(从治疗前的245.2 IU/ml下降到治疗后的102.3 IU/ml),且没有明显的不良反应;此外,接受疫苗治疗的75例患者12个月的OS达90.7%(仅有7例死亡),远高于SHARP试验中接受Sorafenib治疗的中晚期HCC患者12个月的OS(约20.0%)[18],提示其安全可靠、对于HCC有良好的疗效。②Yutani等[19]进行的一项针对个性化多肽疫苗的Ⅱ期临床试验,入组26例抵抗局部治疗的HCC患者,30例抵抗局部治疗和系统治疗的HCC患者(28例BCLC分期为C期),通过比对HCC患者基因突变谱,从已有的31个肽段中选择合适的肽段制备疫苗后进行个性化输注治疗。经过两轮输注后发现,HCC患者细胞毒性T细胞、IgG活性显著提高,且无明显不良反应;抵抗局部治疗和系统治疗的患者的mOS为8.6(5.9~12.2)个月,而抵抗局部治疗的HCC患者mOS为18.7(12.2~22.5)个月,优于SHARP试验中接受Sorafenib治疗的患者(mOS为10.7个月)[20]。由此提示个体化疫苗具有治疗HCC的潜力。③针对MRP3位点肽疫苗的I期临床安全性试验纳入12例接受过肝动脉灌注化疗且Child-Pugh A~B7的中晚期HCC患者,给予MRP3肽疫苗治疗后,1例患者反应良好,9例SD,2例疾病进展(progressive disease,PD),mOS为14.0个月[21],提示MRP3衍生肽具有改善晚期HCC患者生存状态的潜在作用。④以DC-GPC3疫苗作为辅助治疗方案的I期试验入组了12例Child-Pugh A级的HCC患者(其中中晚期HCC有4例),接种疫苗后有9例在24个月内肿瘤未复发;IIa期试验中发现该疗法不良反应轻,未出现ALT、AST等升高的肝损伤表型,且mPFS为36.6个月,显著优于对照组的11.8个月,危险率(hazard rate,HR)为0.41(0.18~0.95)[22],提示免疫疫苗具有很好的辅助治疗作用。
5 免疫细胞治疗
早期的免疫细胞治疗主要以细胞因子诱导的杀伤(cytokine-induced killer,CIK)细胞、NK细胞、树突状细胞刺激的CIK细胞等非特异性细胞治疗为主,这类细胞特异性较差,在临床应用中受限,其发展长期处于停滞状态。近几年,随着嵌合抗原受体T细胞(chimeric antigen receptor T-Cell,CAR-T)、T细胞受体修饰的T细胞(T cell receptor modified T cell,TCR-T)等特异性细胞过继治疗的开发,免疫细胞治疗又因其出众的特异性,重新成为肿瘤免疫治疗的主流。CAR-T和TCR-T治疗无疑是现阶段最受关注的两种免疫细胞疗法。CAR-T治疗首先从人体中分离正常免疫细胞,再利用合成生物学手段改造T 细胞,使其表面表达针对特定肿瘤抗原的嵌合型抗原受体,然后将改造的T细胞回输到体内,经嵌合抗原受体识别肿瘤配体从而杀伤肿瘤细胞。而TCR-T治疗则是对T细胞受体进行修饰,增加其与肿瘤抗原的亲和力从而增强其杀伤肿瘤细胞的作用。CAR-T克服了TCR-T需要主要组织相容性复合体(major histocompatibility complex,MHC)及共刺激信号的局限性;而TCR-T不仅能识别细胞表面蛋白抗原,同时还能识别MHC呈递的细胞内蛋白,两种疗法在肿瘤治疗中各具特色[23]。
2017年,首个治疗难治性急性淋巴细胞白血病的CAR-T产品Kymriah获批。同时针对实体瘤的CAR-T产品也于2017 2018年陆续进入临床试验阶段,国内针对HCC的CAR-T治疗更是蓬勃发展。在HCC晚期治疗中,科济生物公司靶向HCC中GPC3靶点的CAR-T Ib/II期临床试验展现出了初步疗效和良好的安全性[24]。此外,由中国人民解放军总院第五医学中心肝脏肿瘤诊疗与研究中心团队牵头的I期临床试验 瘤内注射CAR-T细胞治疗晚期肝脏肿瘤的临床应用 现已入组4例晚期HCC患者。经基因检测发现这4例患者肝肿瘤组织GPC3显著高表达,符合靶向GPC3的CAR-T治疗的入组要求。考虑到静脉注射后到达肿瘤的有效药物剂量较低,该研究采取瘤内注射的方法,即在肿瘤正面、纵切面、横切面分别选择1、3、2个进针点给药,前后进行2次CAR-T瘤内注射。随访发现1例PR,2例SD,1例PD;PD患者治疗后生存期为6个月,而其余3例目前存活时间均超过12个月,初步提示瘤内注射CAR-T对治疗晚期HCC具有潜力[15]。
CAR-T治疗靶点的选择与其疗效密切相关。治疗血液性肿瘤的CAR-T产品因靶向CD19这个高特异性的靶点而取得显著的治疗效果,现阶段进入晚期HCC临床试验的CAR-T治疗主要靶向GPC3、MUC1、AFP等,已表现出一定临床疗效,未来应努力寻找特异性更好、疗效更佳的靶点[25]。随着相关临床试验逐步开展,相信CAR-T、TCR-T在HCC治疗领域的进展会为晚期HCC患者带来福音。
6 联合治疗
考虑到晚期HCC单一疗法有限的ORR,晚期HCC联合治疗逐渐成为新的选择(图2)。涉及到免疫治疗的常见免疫-肿瘤(immuno-oncology,I-O)联合治疗策略主要有两种:①两种免疫抑制剂联用如Durvalumab(PD-L1抑制剂)联合Tremelimumab(CTLA-4抑制剂);②免疫治疗联合靶向药、化疗药,如Atezolizumab(PD-1抑制剂)联合Bevacizumab(抗VEGF血管生成药)等。
6.1 两种免疫抑制剂的联合治疗 Nivolumab和Lpilimumab联合治疗晚期黑色素瘤的III期临床试验发现,随访36个月后联合用药组的受试者存活人数超过50%,而单药Nivolumab组mOS为37.6个月,HR为0.55,Lpilimumab组mOS为19.9个月,HR为0.65。联合用药组的ORR为58%,远高于Lpilimumab组和Nivolumab组(分别为19%,44%),提示联用能有效提高晚期黑色素瘤患者的生存质量[26]。PD-1/PD-L1、CTLA-4抑制剂联合治疗在晚期黑色素瘤中的成功应用,也推动了在HCC中联合应用的临床试验。Durvalumab(PD-L1抑制剂)联合Tremelimumab(CTLA-4抑制剂)治疗晚期HCC患者的I期临床试验发现,联合用药组ORR为25%,较单药ORR的17%提升显著,初步提示两药联用在晚期HCC患者治疗中有良好的应用前景[27]。
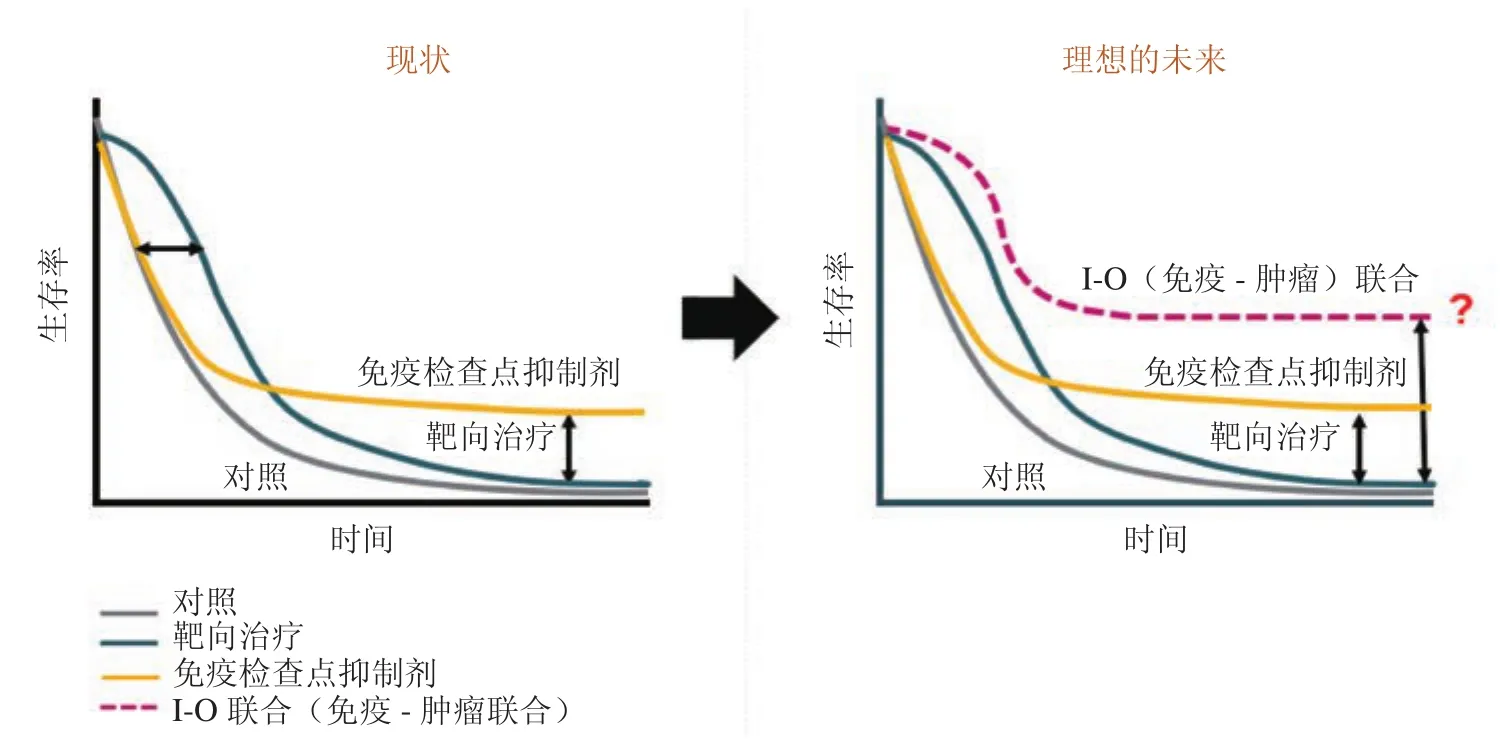
图2 晚期HCC联合用药的理想未来Figure 2 Future of combination therapy for advanced HCC
6.2 免疫治疗联合抗血管生成药 血管正常化能够重塑肿瘤微环境,使机体从免疫抑制状态向免疫促进状态转换,进而提升免疫治疗的作用。Bevacizumab(抗VEGF血管生成药)联合Atezolizumab(PD-1抑制剂)的Ib临床试验发现,73例晚期HCC受试者中有1例完全缓解,22例PR,ORR达到32%;此外33例SD,DCR达到77%,mPFS为14.9个月,而mOS未达到[28]。一项纳入26例晚期HCC受试者的Ib临床试验,采用Lenvatinib与Pembrolizumab联合治疗后,患者的ORR为26.9%[29]。此外,Xu等[9]进行的SHR-1210(PD-1抑制剂)联合Apatinib(VEGFR2抑制剂)的I期临床试验发现,16例接受联合用药的晚期HCC患者中,8名PR,ORR达到50%,且未发生不可耐受的不良反应。综上,三项联合治疗的阶段性成果均提示免疫治疗联合抗血管生成药具有抵抗肿瘤形成的作用,这也是治疗肿瘤的一个重要研究方向。
7 免疫治疗未来研发方向及展望
晚期HCC的治疗从化疗、靶向治疗、免疫治疗,逐步走向了联合治疗。现阶段已开展的针对晚期HCC的临床试验结果显示,ICB治疗的ORR为20%[4],新一代靶向药Lenvatinib的ORR为24%[30],而在联合多种治疗后,ORR有望进一步提升。同时现阶段的研究数据提示免疫治疗对肝脏的损伤较传统靶向治疗等显著减小,安全且可耐受(表2)。晚期HCC治疗表现出更好的疗效,更少的不良反应,也让人们对HCC免疫治疗充满期待。未来可从三个方向入手让更多晚期HCC患者从治疗中获益:①探索免疫治疗新靶点/新通路;②建立 HCC分子谱与特定治疗预后间的相关关系 数据库,通过大数据积累,结合多维度、多平台来实现HCC的精准治疗;③重新定义免疫治疗在HCC治疗中的位置,将免疫治疗药物作为HCC治疗的一线用药。
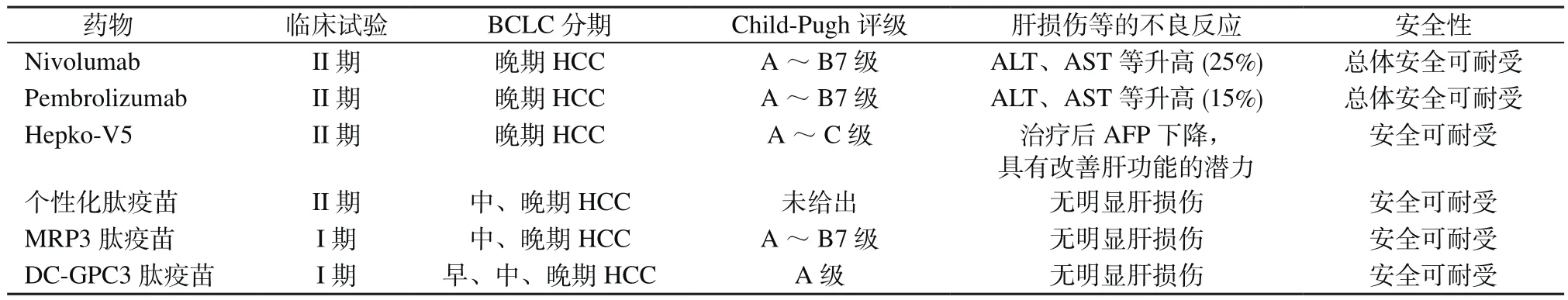
表2 免疫治疗产生的肝损伤等不良反应的统计Table 2 Statistics on adverse reactions such as liver damage caused by immunotherapy
7.1 探索免疫治疗新靶点/通路 细胞表面有许多别吃我 信号(抑制免疫细胞杀伤肿瘤细胞),除PD-1/PD-L1、CTLA-4外,还有许多未知的免疫检查点,寻找并揭示这些潜在的靶点与信号通路是未来免疫治疗研究的重要方向之一。近期Wang等[31]揭示了 FGL1/LAG3 信号通路,认为HCC细胞分泌FGL1蛋白能力增强,血液中升高的FGL1蛋白能够特异性结合T细胞表面LAG3受体,抑制T细胞肿瘤杀伤功能;而当阻断这一信号通路后能够让受抑制的T细胞恢复肿瘤杀伤活力,提示FGL1与LAG3的结合,是一种新型的免疫逃逸机制,可以保护肿瘤细胞免受免疫系统的攻击。
从免疫细胞分类角度,除了纠正T细胞免疫杀伤作用外,纠正天然免疫细胞如巨噬细胞、NK细胞肿瘤杀伤作用的研究也是未来的一个重要方向。对肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)的系列研究发现,巨噬细胞通过CSF1α结合肿瘤细胞表面CSF1来吞噬肿瘤细胞。而肿瘤细胞CD47结合巨噬细胞SIRP-α受体[32]及肿瘤细胞MCH1β结合巨噬细胞LILRB1受体[33]这两个 不吃我 信号通路的激活,导致TAMs从免疫杀伤到免疫抑制的转变。此外,M2型巨噬细胞表面同样高表达PD-1[34],提示阻断CD47、MCH1β、PD-1能够显著提高肿瘤TAMs肿瘤杀伤作用。尽管这些研究仍处于基础研究阶段,但考虑到晚期HCC组织中有大量TAMs,相信针对TAMs的免疫治疗将使更多的晚期HCC患者从中受益。
同时,随着CAR-T、TCR-T等临床试验的推进,适应性免疫治疗方案会成为HCC治疗的又一利器。此外,溶瘤病毒、溶瘤细菌的开发,尤其是利用工程学技术定量杀伤肿瘤细胞的溶瘤病毒的开发,将为晚期HCC的治疗提供新的途径。多种免疫治疗共同发展,针对不同患者采取 免疫正常化 免疫增强 等不同策略[35-36],将显著提升晚期HCC患者的ORR,改善其生存质量。
7.2 通过MDT平台等方式建立 HCC分子谱与患者接受特定治疗方案预后间的相关关系 数据库,指导免疫治疗 ICB存在致死性的不良反应 免疫超进展,表现为用药后肿瘤生长速度提高2倍以上,用药2个月后肿瘤增大50%以上,疾病出现明显进展等,往往会导致患者死亡。NGS测序发现,发生免疫超进展的患者MDM2、MDM4、EGFR等基因扩增,提示这些基因可能与疾病暴发进展相关,是预测ICB疗效的潜在负相关因子[37]。而肿瘤微卫星不稳定性(tumor microsatellite instability,MSI)程度高(MSI-H)与错配修复基因缺陷可以作为PD-1抑制剂疗效的正相关因子。同时,如前所述,TMB、PD-L1 3'非翻译区突变等都可以作为预测PD-1抑制剂疗效的生物标志物[38]。寻找 患者是否适合进行免疫治疗和评估免疫治疗效果的生物标志物,对于肿瘤免疫治疗的普及非常关键。而积累大数据,建立特定分子谱/分子标志物与免疫治疗效果、不良反应间的关系,可以为个性化免疫治疗方案选择提供理论指导与经验借鉴。
7.3 免疫治疗在HCC治疗中的位置 既然免疫治疗具有如此好的效果,为什么一定要把它当做最后的救命稻草?而不是在治疗最初就采用呢?随着随访时间延长,数据积累增多,越来越多的证据支持尽早使用免疫治疗,概括后主要有以下三点:①健康的免疫系统是免疫药物起效的关键,无论是短期内杀伤肿瘤细胞,还是长期达到控制肿瘤复发的目的,免疫药物起效的必要条件都是健康的免疫系统;②大数据显示先采用免疫疗法的患者总生存期可能较最后使用的患者更长,同时患者整体死亡风险降低30%以上[39];③患者身体状态越好,免疫治疗效果越好。因此,在条件允许的状态下,更早使用可以让更多患者获益。同时,研究能够互相增效的联合治疗方案,也将更有助于改善HCC患者的预后。在联合用药的过程中也会进一步增加对免疫治疗的理解,坚信免疫治疗可以成为贯穿HCC治疗全过程的方案(图3)。
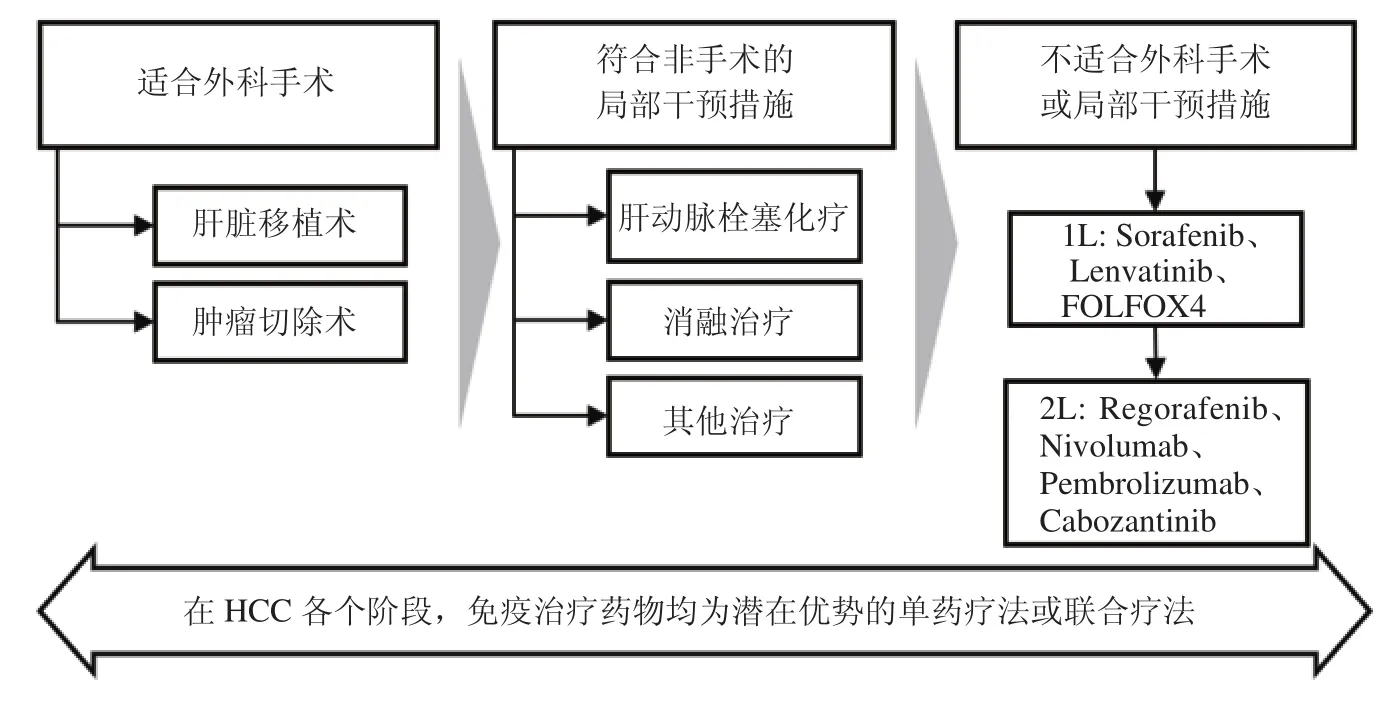
图3 免疫治疗可以贯穿于HCC治疗的全过程Figure 3 Immunological therapy throughout the entire processes of HCC
近三年,晚期HCC系统性治疗取得新的突破。未来免疫治疗在肿瘤治疗中将拥有良好的应用前景。而随着CAR-T等个性化治疗方案的成熟,一系列基于免疫联合治疗试验的开展,个性化联合治疗方案将成为趋势[40-41],更多的晚期HCC患者将从HCC精准治疗中获益。
