二氧化铈/钼酸铋复合光催化剂的制备及光催化性能
2019-03-13胡丰献郁桂云
胡丰献 戴 勇 郁桂云
(1江苏大学化学化工学院,镇江 212013)
(2盐城工学院化学化工学院,盐城 224051)
0 引 言
经济的飞跃式发展造成大量有毒污染物的排放[1],对人们赖以生存的环境造成了不可忽视的影响。因此,净化、修复环境污染的问题亟待解决[2]。研究者最早是应用TiO2来净化、修复环境[3-4],同时TiO2在光催化分解水[5-6]、化合物合成[7]等领域也发挥了巨大作用。但其禁带宽度为3.2 eV,对光的利用仅限于吸收利用在太阳光中占据4%的紫外光[8],所以寻找能替代TiO2的光催化剂势在必行。
近年来,由于铋具有特殊的外层电子构型(6s2),其化合物的禁带宽度较窄,研究者将研究方向转向铋系光催化剂。钼酸铋(BMO)属于铋系光催化剂的一种, 它具有 α-Bi2Mo3O12、β-Bi2Mo2O9、γ-Bi2MoO6三种晶体结构[9-10]。在这3种晶体结构中,γ-Bi2MoO6是低温下结构稳定的唯一层状Aurivillius结构[11]。根据密度泛函理论对低温相的γ-Bi2MoO6能带组成进行计算发现Bi2MoO6的导带由Mo4d和Bi6s轨道构成,价带由O2p和Bi2s轨道构成,禁带宽度(Eg=2.7 eV)表明其在可见光区域有强吸收[12]。同时稀土元素离子具有4f电子构型,可以提高半导体的光催化活性[13]。将稀土元素与钼酸铋掺杂是增强光催化活性的一种方法。例如Adhikari等[14]尝试采用微波水热法合成Er3+/Yb3+元素掺杂的Er3+/Yb3+-Bi2MoO6,并通过红外光与可见光的转换机理来增强光催化活性。Jin等[15]通过共沉淀法制备了Ho3+/Yb3+共掺杂的Ho3+/Yb3+-Bi2MoO6光催化剂,通过增强可见光的吸收和减少电子-空穴对的复合来有效地提高光催化活性。Li等[16]通过溶剂热法制备Ce掺杂Bi2MoO6/TiO2异质结性复合材料,Ce离子进入Bi2MoO6晶格内部形成缺陷位更有利于光生电子的分离和转移进而增强光催化活性。将2个导带、价带相匹配的半导体复合也是一种提高光催化活性常用的方法。例如Yan等[17]通过沉淀-沉积方法制备了BiOI/Bi2MoO6复合材料促进光生电荷载体的分离和转移从而提高光催化活性。Xu等[18]通过溶剂热法制备分层Bi2O3/Bi2MoO6微/纳米结构,其光催化活性的显著增强可归因于在半导体界面上光致电荷载流子的有效分离。同时,光催化剂本身的物质组成、结构、形貌也与光催化性能密切相关。例如Zhang等[19]通过水热法获得纳米片和微米棒形态的Bi2MoO6,Bi2MoO6纳米片明显高于Bi2MoO6纳米棒的光催化性能。Ma等[20]以MoO3为模板合成的纳米片框架结构的Bi2MoO6具有比常规纳米片和纳米颗粒更高的催化活性,分层框架结构可以促进光诱导电荷在交叉的Bi2MoO6纳米片之间分离转移。Zheng等[21]采用水热法合成了优先沿(010)晶面生长的Bi2MoO6,其晶体表面形成了更多氧缺陷空位点,在光催化过程中可产生更多的羟基自由基进而增强了光催化性能。
之前与稀土元素铈有关的研究[22-24]往往只是考查稀土元素对催化性能产生的影响,并未提及到其对合成产物的结构、形态的影响。本文通过水热法在不同酸碱性反应条件下合成复合CeO2和不复合CeO2的钼酸铋,探究不同酸碱性反应体系下,稀土元素Ce对钼酸铋组成、形态、结构及其光催化性能的影响。
1 实验部分
1.1 实验试剂
六水合硝酸铈(Ce(NO3)3·6H2O,AR,99.5%(w/w),上海阿拉丁生化科技股份有限公司)。五水合硝酸铋 (Bi(NO3)3·5H2O,99.0%(w/w))、 二 水 合 钼 酸 钠(Na2MoO4·2H2O,99.0%(w/w)), 氢 氧 化 钠 (NaOH,96.0%(w/w))、稀硝酸(HNO3,95%(w/w))均为分析纯,上海国药集团化学试剂有限公司。无水乙醇(CH3CH2OH,AR,99.7%(w/w), 江苏彤晟化学试剂有限公司),蒸馏水。
1.2 制备方法
1.2.1 合成不同pH值下的BMO
称取 6 mmol Bi(NO3)3·5H2O、3 mmol Na2MoO4·2H2O放入到50 mL蒸馏水中。然后,滴加适量0.5 mol·L-1稀硝酸溶液使其完全溶解。在磁力搅拌下逐滴加入1 mol·L-1的氢氧化钠溶液,分别控制其反应体系溶液的pH值维持在5和9。最后装入聚四氟乙烯不锈钢反应釜中于160℃烘箱中静态晶化24 h。反应结束后自然冷却到室温,离心、洗涤后70℃干燥10 h。样品根据其pH值依次命名为BMO-5、BMO-9(数值代表反应溶液体系pH值)。
1.2.2 合成CeO2/BMO半导体复合材料
称取 6 mmol Bi(NO3)3·5H2O、3 mmol Na2MoO4·2H2O、0.065 1 g Ce(NO3)3·6H2O 放入到 50 mL 蒸馏水中。然后,滴加适量0.5 mol·L-1稀硝酸溶液使其完全溶解。在磁力搅拌下慢慢滴加1 mol·L-1的氢氧化钠溶液,分别控制其反应体系溶液的pH值维持在5和9。最后装入聚四氟乙烯不锈钢反应釜中于160℃烘箱中静态晶化24 h。反应结束后自然冷却到室温,离心、洗涤后70℃干燥10 h。依次命名为CeO2/BMO-5、CeO2/BMO-9(数值代表反应溶液体系pH值)。
1.3 表征仪器及参数
X射线衍射仪(X-ray diffraction,XRD)型号为日本Shimadzu XRD-6000型,配有石墨单色镜,Cu靶Kα 辐射(λ=0.15 nm),工作电压为 40 kV,工作电流为 30 mA,扫描速度为 2°·min-1,扫描角度范围为 5°~80°。采用美国Nicolet iS10型傅立叶变换红外光谱仪(FT-IR)测试样品化学键类型,采用KBr压片法,扫描次数不少于32次。采用美国FEI公司Nova Nano SEM 450型超高分辨率场发射扫描电子显微镜(SEM)测试样品形貌,工作电压为5.0 kV。紫外可见漫反射光谱 (UV-Vis diffuse reflectance spectra,UV-Vis DRS)型号为日本岛津公司生产的UV-3600 Plus紫外-可见分光光度计,测试中以BaSO4做基线校正,测试范围在200~800 nm。
1.4 光催化性能测试
称取0.1 g样品,放入200 mL浓度为5 mg·L-1的罗丹明B(RhB)溶液中,黑暗处理30 min后,在250 W、带有420 nm滤光片的氙灯下光照,每隔15 min取5 mL溶液待测。测试完成后,将取得的样品溶液离心,去除沉淀,上层清液用紫外可见光光度计测其浓度。根据表达式计算不同时间段污染物降解率,其中η代表光催化效率,C0代表原始污染物溶液的浓度(mg·L-1),Ct代表t时间时的污染物溶液的浓度(mg·L-1)[25]。
1.5 活性物质捕获实验
为了判断在光催化反应过程不同活性物质的发挥作用,添加了不同的自由基猝灭剂。以异丙醇(IPA,10 mmol·L-1),草酸钠(Na2C2O4,10 mmol·L-1)和苯醌(BQ,10 mmol·L-1)为猝灭剂[26],通过在可见光照射下复合样品对含各种自由基猝灭剂的RhB溶液的降解效果,推断影响光降解效果的主要活性种类。
2 结果与讨论
2.1 XRD结果分析
运用X射线衍射仪,对样品的组成和相结构进行分析(图1)。图1a中BMO-5的XRD图与Bi2MoO6的特征衍射峰相符, 在 2θ=10.86°、23.52°、28.26°、32.58°、33.11°、36.02°和 47.16°等处出现的衍射峰,依 次 归 属 为 (020)、(111)、(131)、(200)/(002)、(060)、(151)和(331)/(113)晶面特征衍射峰,由此可知在酸性条件下合成的样品为Aurivillius结构钙钛矿型Bi2MoO6。图1b的CeO2/BMO-5的XRD图与图1a相比其衍射峰的强度显著降低,由于Ce元素的添加量很少且结晶度弱,被Bi2MoO6的衍射峰面积所覆盖,导致在图1b中未观察到CeO2的衍射峰。由此可知在酸性条件下Ce3+的加入影响了Bi2MoO6的结晶度。CeO2/BMO-9的XRD图与立方相Bi3.64Mo0.36O6.55的特征衍射峰相符[27],在 2θ=27.36°、31.69°、45.42°、53.83°和56.45°等处出现的衍射峰,依次分别归属为(111)、(200)、(220)、(311)和(222)晶面。 BMO-9 的XRD图中既存在Bi2MoO6的特征衍射峰又存在Bi3.64Mo0.36O6.55的特征衍射峰,由此可知在碱性条件下合成的样品为Bi2MoO6/Bi3.64Mo0.36O6.55复合材料。图1d经局部放大之后的 XRD图(图 2)在 2θ=28.31°、33.08°和56.48°等处出现的衍射峰与CeO2的特征衍射峰相符,依次分别归属于(111)、(200)和(311)晶面特征衍射峰。由此可知,物质的形态、组成与pH值有密切的联系,且在碱性条件下CeO2的存在会诱导Bi2MoO6向Bi3.64Mo0.36O6.55的转化。

图1 (a)BMO-5、(b)CeO2/BMO-5、(c)BMO-9 和(d)CeO2/BMO-9的XRD图Fig.1 XRD patterns of the composite(a)BMO-5,(b)CeO2/BMO-5,(c)BMO-9 and(d)CeO2/BMO-9
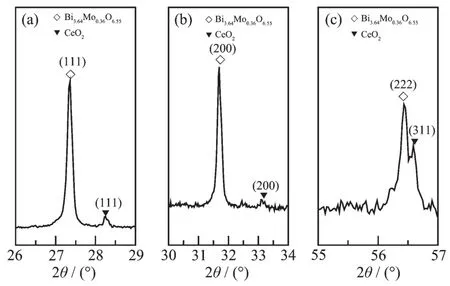
图2 CeO2/BMO-9的XRD局部放大后图Fig.2 Partial amplification XRD patterns of CeO2/BMO-9
2.2 FT-IR结果分析
借助傅立叶变换红外光谱仪表征金属离子与非金属离子化学键种类(图3)。酸性条件下生成的样品在3 445和1 630 cm-1附近出现吸收峰,分别对应于-OH、H-O-H 的伸缩振动[28](图 3(a,b)),而在碱性条件下生成的样品H-O-H的伸缩振动吸收峰消失(图3(c,d))。由此可知,在碱性条件下合成样品的结晶水含量很低,物质间的氢键作用力大大削弱。在1 384 cm-1附近出现的吸收峰对应于CO32-离子的C-O键的伸缩振动,图3d在1 384 cm-1处的吸收峰强度与宽度相对图3b明显增加,这是Ce-O与C-O键的伸缩振动吸收峰叠加造成的[29]。钼酸铋的Bi-O和Mo-O键的伸缩振动出现在400~1 000 cm-1指纹区域(图4),由图可知在酸性和碱性反应体系下合成的催化剂在850~720 cm-1范围内均有吸收,且归属为Mo-O键的伸缩振动,在570和444 cm-1附近的吸收峰归属于Bi-O键的伸缩振动[30]。

图3 (a)BMO-5、(b)CeO2/BMO-5、(c)BMO-9 和(d)CeO2/BMO-9的傅里叶红外光谱图Fig.3 FT-IR spectra of the sample(a)BMO-5,(b)CeO2/BMO-5,(c)BMO-9 and(d)CeO2/BMO-9
2.3 SEM结果分析
借助扫描电子显微镜观察样品材料形貌、元素分散度以及成分含量(图5)。由图5(a,b)可知,在酸性条件下生成的Bi2MoO6纳米片分布均匀、层层叠加,纳米片厚度在45~55 nm之间。图5(c,d)与图5(a,b)相比,纳米片层棱角模糊、组装杂乱,由此得知在酸性条件下CeO2的加入对样品的结晶程度影响很大,这与图1b中相应XRD图的衍射峰强度相一致。图5(e,f)表明样品中存在小的纳米片和较大的纳米片,结合图1c中相应的XRD图分析的结果可知在碱性条件下反应生成Bi3.64Mo0.36O6.55/Bi2MoO6复合物。对比图5(g,h)与图5(e,f)可知大块的纳米片为Bi3.64Mo0.36O6.55。选择CeO2/BMO-9的某一区域(图5i)进行 Bi、Mo、Ce、O 元素分布检测,可以发现 Bi、Mo的元素分布状态与纳米片轮廓相一致,Ce、O均匀分布在所有选择区域。
2.4 Brunauer-Emmett-Teller(BET)结果分析
如图 6a 所示,BMO-5、BMO-9、CeO2/BMO-5 和CeO2/BMO-9的氮气吸附-脱附等温线类型属于Ⅱ型[13],CeO2/BMO-9的氮气吸附-脱附等温线类型属于Ⅳ型。 BMO-5、CeO2/BMO-5、BMO-9和 CeO2/BMO-9 比表面积分别为 15、19、15 和 6 m2·g-1,孔容积分别为 0.10、0.12、0.12 和 0.04 cm3·g-1。 SEM 结果表明纳米片Bi3.64Mo0.36O6.55的表观形貌比Bi2MoO6大几倍,因此CeO2/BMO-9与CeO2/BMO-5相比比表面积会大大降低。对于BMO-5和CeO2/BMO-5而言,钼酸铋纳米片水平竖直交错堆积,再加上CeO2均匀分布在纳米片之间使纳米片堆积更加稀松形成更多的层板空隙,因此孔容积会因为CeO2的引入而增加。但是,BMO-9和CeO2/BMO-9情况却是相反的,主要原因在于较大的Bi3.64Mo0.36O6.55纳米片往往是水平堆叠在一起,分布在表面上的CeO2起到的作用显得微乎其微。由此可知,CeO2/BMO-5比表面积和孔容积均是最大,这将暴露更多的活性位点,光激发产生更多的光生电子空穴对,同时也增大了样品的受光面积和与污染物接触的面积,增大了动力学常数加速光催化进程,这些都有利于光催化活性的提高。图6b 是 样 品 的 孔 径 分 布 图 ,BMO-5、CeO2/BMO-5、BMO-9 和 CeO2/BMO-9 的孔径分别为 15~25、20~40、25~60和20 nm。CeO2的加入使形成的复合光催化剂拥有较大的比表面积和孔容积,暴露出更多的活性位点,增加了催化剂与污染物的接触面积,是光催化性能增强的另一个关键因素。

图5 (a,b)BMO-5、(c,d)CeO2/BMO-5、(e,f)BMO-9、(g~i)CeO2/BMO-9 的 SEM 图;(i)CeO2/BMO-9 的 EDX 分布图Fig.5 SEM images of the composite(a,b)BMO-5,(c,b)CeO2/BMO-5,(e,f)BMO-9 and(g~i)CeO2/BMO-9 at different resolutions;(i)EDX spectra of CeO2/BMO-9
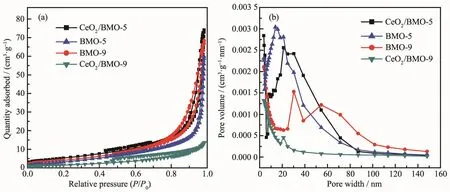
图6 样品BMO-5、CeO2/BMO-5、BMO-9和CeO2/BMO-9的(a)氮气吸附-脱附等温线和(b)孔径分布图Fig.6 (a)N2adsorption-desorption isotherms and(b)pore size distributions of BMO-5,CeO2/BMO-5,BMO-9 and CeO2/BMO-9
2.5 UV-Vis结果分析
借助紫外-可见紫外光谱仪测试BMO-5、BMO-9、CeO2/BMO-5、CeO2/BMO-9 对紫外和可见光的吸收波长范围(图7)。样品在可见光区域的吸收范围的大小反应出光照下样品产生价电子的难易程度,而BMO-5、CeO2/BMO-5、BMO-9、CeO2/BMO-9 的边带吸收波长分别在 430、455、480、420 nm 左右,因此CeO2/BMO-5在光照下更容易产生价电子。根据光谱的峰形及陡峭形状,可以判断对可见光波长吸收的增强来自于禁带的调整,而不是由于样品不纯造成的[31]。对于晶体半导体禁带边缘的光吸收遵循等式:(αhν)=A(hν-Eg)n/2,其中 α,h,ν,Eg和 A 分别是吸收系数,普朗克常数,光频率,带隙和常数[32](直接半导体n=1,间接半导体 n=4)。 图 8 为相对应的(αhν)2~hν关系曲线(hν为光子能量),可以看出 BMO-5、BMO-9、CeO2/BMO-5、CeO2/BMO-9 的禁带分别在 2.91、3.01、2.56、2.65 eV。禁带值越小意味着激发光电子所需要的能量越低,越容易被可见光激发产生电子空穴对,对可见光区域的光能量吸收能力最强,由此预测所有样品中CeO2/BMO-5可能具有最好的光催化性能。

图7 BMO-5、BMO-9、CeO2/BMO-5 和 CeO2/BMO-9 的UV-Vis DRS光谱Fig.7 UV-Vis DRS spectra of BMO-5,BMO-9,CeO2/BMO-5 and CeO2/BMO-9 composites
2.6 光催化性能结果分析

图9 可见光下降解RhB速率图Fig.9 Photocatalytic degradation of RhB under visible light irradiation
图9 是 BMO-5、BMO-9、CeO2/BMO-5、CeO2/BMO-9在不同时刻光催化降解RhB的降解曲线图。反应溶液经可见光照射60 min之后,4种样品均能光催化降解RhB,其中CeO2/BMO-5的降解效果最好,残留量为48%,BMO-5、BMO-9的降解效果近似,残留量分别为60%、62%,CeO2/BMO-9的效果最差,残留量为85%。CeO2/BMO-5样品光催化降解RhB效果最好,可归因于在酸性条件下CeO2的加入促使Bi2MoO6的纳米片形成更多缺陷位点,增强捕获效应进而提升了动力学速率,这与光催化剂比表面积和孔容积的增大息息相关。同时从UV-Vis DRS光谱的实验结果可知,CeO2的加入调整了Bi2MoO6的能带结构[33]。CeO2/BMO-9样品光催化降解RhB效果最差,一方面是因为Bi3.64Mo0.36O6.55的光催化活性相对Bi2MoO6弱[27],另一方面是CeO2/BMO-9的比表面积较小,较小的比表面积是导致光催化性能弱的主要原因。另外,酸性条件下生成的样品中含有-OH吸收峰而碱性条件下生成的样品却没有(图3),因此光催化性能的强弱与-OH的存在有一定的联系[34]。图10是CeO2/BMO-5样品的吸光度-波长曲线图。图中表明原始RhB溶液的最大吸收波长为554 nm,随着光照时间的延长,RhB的最大吸收波长向低波长方向移动[35-36],说明在可见光照射下RhB共轭结构解构和逐步去甲基化,导致最大吸收带发生蓝移[37]。如图11所示,经循环利用4次之后,CeO2/BMO-5的光催化性能几乎不变。从图12可知,添加IPA和BQ的反应溶液中降解率明显降低,表明·OH和·O2-是光催化过程中的主要活性组分。
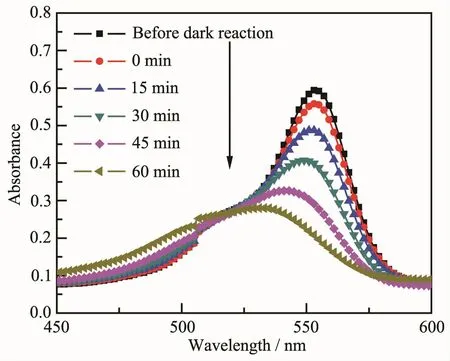
图10 CeO2/BMO-5样品降解RhB的可见光吸收光谱Fig.10 Absorption spectra of the photodegradation for RhB solution under visible light irradiation with CeO2/BMO-5

图11 CeO2/BMO-5样品可见光降解RhB的循环实验Fig.11 Recycling test of CeO2/BMO-5 for the photodegradation for RhB

图12 光催化过程中添加不同活性猝灭剂后的RhB降解图Fig.12 Effects of reactive species in the degradation for RhB solution under photocatalytic process
2.7 光催化降解机理讨论
根据 UV-Vis的实验结果可知,BMO-5、CeO2/BMO-5的禁带宽度分别为2.91、2.56 eV。按照下列公式获得BMO-5和CeO2/BMO-5的价带和导带值[38]:

其中χ是半导体的绝对电负性,Ee是自由电子在氢能量级的能量值(~4.5 eV),Eg是半导体的禁带宽度,ECB是被电子占满的导带,EVB是遗留空穴的价带。因Bi2MoO6的χ值为5.17 eV[39],计算可知 BMO-5的导带值和价带值分别为-0.86和2.05 eV,CeO2/BMO-5的价带值和导带值分别为1.95和-0.61 eV。由此可知,CeO2的加入使钼酸铋的禁带结构得以改善。因为 Bi2MoO6的价带电位低于E(·OH/H2O)(+2.68 eV)的电位[40],所以CeO2/BMO-5不能直接将水氧化产生·OH。反应中·OH的产生是通过H2O2间接生成的。 Bi2MoO6的导带电位高于 E(O2/·O2-)(+0.13 eV)的电位,可以直接吸收O2将其还原为·O2-活性组分[41]。另外,RhB还可以与空穴(h+)发生氧化反应生成二氧化碳和水,其中RhB·*是被活化的活跃态RhB。图13为CeO2/BMO-5的光催化降解示意图,其降解机理如下:


图13 CeO2/BMO-5的光催化降解示意图Fig.13 Schematic diagram of the photocatalytic degradation for the CeO2/BMO-5

3 结 论
采用水热法,以 Ce(NO3)3·6H2O、Bi(NO3)3·5H2O、为主要反应试剂,制备了4种复合CeO2和不复合CeO2的钼酸铋复合光催化剂(BMO-5、BMO-9、CeO2/BMO-5、CeO2/BMO-9)。 以 罗 丹明 B溶液为光催化性能测试的研究对象,考查4种样品在可见光下的光催化活性。由XRD、SEM、FTIR等表征方法的结果得知,CeO2的添加与钼酸铋在不同酸碱性合成体系中的形态、组成、结构及光催化性能密切相关。未复合CeO2时,在酸性条件下反应生成Bi2MoO6,在碱性条件下反应生成Bi2MoO6/Bi3.64Mo0.36O6.55混合物。复合CeO2之后,在酸性条件下反应生成结晶度较差的CeO2/Bi2MoO6,在碱性条件下反应生成CeO2/Bi3.64Mo0.36O6.55混合物。性能测试结果表明碱性反应体系合成的CeO2/BMO-5的光催化性能最强,原因是CeO2加入使BMO的禁带值降低,同时也增加了BMO的比表面积和孔容积。这些都与光催化剂性能的改善有着至关重要的联系。稀土元素的加入很可能对复合物质的结构、组成产生较大的影响,导致生成预期之外的产物。本研究对以后通过稀土元素复合改性钼酸铋以期提高其光催化活性具有一定的借鉴意义。
