基于GC-QTOF-MS代 谢组学技术研究饲喂不同糖饲料对蜜蜂所产蜂王浆中代谢物组成成分的影响
2019-03-11张文文陈孝梅范荣莉陈国宏
张文文,庞 倩,王 康,陈孝梅,范荣莉,陈国宏,吉 挺*
(扬州大学动物科学与技术学院,江苏 扬州 225000)
蜂王浆是由蜜蜂蜂群中的哺育蜂头部上颚腺和咽下腺分泌的一种淡黄色或者乳白色的乳块状物质,是工蜂饲喂蜂王以及蜜蜂幼虫的一种食物[1],对于蜜蜂的级型分化有着重要的作用,蜂群中的工蜂一般只在孵化后3 d采食蜂王浆,而孵化后一直采食蜂王浆的幼虫则发育成蜂王[2-3]。蜂王浆含有许多生物活性成分,具有提高免疫力、抑制肿瘤、降血压、抗菌、降血脂、抗氧化和抗疲劳等功能作用[4]。蜂王浆的成分和含量对于蜂王浆品质的好坏也有着重要的影响[5],而蜂种、蜂王浆的生产方式、生产时间、泌浆蜂日龄、取浆时间、饲料的种类和质量以及外界环境、气候等都会影响蜂王浆的成分和含量[6-9]。在蜜源缺乏时期,蜂农选用人工饲料替代蜜粉饲喂蜂群以继续维持蜂王浆的生产。李肖[10]研究表明在蜜蜂饲喂的饲料中添加不同蛋白质水平对蜜蜂春繁时期生产的蜂王浆品质有显著影响;程艳华[11]研究表明饲喂蜜蜂不同水平的蛋白质也会对蜂王浆中的主要成分如王浆酸、粗蛋白和粗脂肪等含量产生显著影响;王改英等[12]认为使用人工蛋白质饲料代替花粉饲喂蜜蜂也会对蜂王浆的品质产生影响。代谢组学是一门研究生物体系受到内在或外在的刺激使自身代谢发生变化,能够对其中的关键物质主要是小分子物质进行精确地定性定量分析的一门学科[13],具有研究代谢物种类少、操作简便且技术通用,可以反映出基因或蛋白表达的细微变化的优点,被广泛应用于动植物研究、微生物研究、疾病诊断、药物机制、中药成分研究、营养学研究等多个方面[14-20]。
目前国内外对蜂王浆的研究多集中于基于不同的蛋白营养水平对蜂王浆品质的影响,而成年工蜂糖类食物对其分泌的蜂王浆品质影响的研究也主要体现在粗蛋白、水分、10-羟基癸烯酸等常规指标方面。本研究基于气相色谱-四极杆飞行时间质谱(gas chromatography-quadrupole time-of-flight-mass spectrometry,GC-QTOF-MS)代谢组学技术分析不同糖饲料饲喂条件下蜂王浆的组成成分差异,及对蜂王浆品质的影响,为养蜂者实际生产(如选择合适的人工替代饲料等)提供理论依据。
1 材料与方法
1.1 材料与试剂
实验所选用的蜂群是本地意蜂与平湖浆蜂的杂交后代,首先从蜂群中选取300 群产浆性能比较优异的实验蜂群,并从中随机选择产浆性能一致、健康无病且蜂种相同的90 群蜂,调整群势至一致,随机分为3 组,每组30 群,分别在江苏南京六合区3 处环境相似的地方定地饲养。然后取同地点、同组随机10 个蜂群生产出来的蜂王浆进行充分混合后作为1 个样品,每组8 个平行样品,3 组一共采集24 个蜂王浆样品。
内标物:核糖醇(CAS#:488-81-3) 美国Sigma公司;衍生化试剂:双(三甲基硅基)三氟乙酰胺(含体积分数1%三甲基硅烷) 美国REGIS科技公司。
1.2 仪器与设备
JXFSTPRP-24研磨仪 上海净信科技有限公司;7890A GC-QTOF-MS联用仪、DB-5MS毛细管柱(30 m×250 μm,0.25 μm) 美国Agilent公司。
1.3 方法
1.3.1 样品的保存与运输
蜂场所在地位于南京市六合区,采集的蜂王浆样本装瓶后进行标记编号并立即冷冻保存,随后保存在扬州大学蜂产品研究实验室的冰箱中并以低温保存的状态送往上海欧易生物医学科技有限公司利用代谢组学技术检测蜂王浆中组分。
1.3.2 饲喂条件
实验开始前45 d饲喂正常用量的花粉和花蜜,生产前20 d,3 组以糖和花粉质量比1∶1分别饲喂白糖、蜂蜜和高果糖浆3 种不同的糖饲料。
1.3.3 样品前处理
1.3.3.1 样品萃取
每管中称取10 mg蜂王浆样本,置于2 mL研磨管里,然后滴加0.4 mL的甲醇-水(3∶1,V/V)提取液,再加20 μL的核糖醇,放入钢珠,45 Hz、6 min研磨仪旋涡混匀处理;4 ℃、12 000 r/min离心15 min;取上清液于2 mL进样瓶(甲烷硅基化)中,每个蜂王浆样本中取8 μL混成一个样本。
1.3.3.2 萃取物衍生化
在真空浓缩器中将提取物进行干燥。滴加80 μL甲氧胺盐试剂(甲氧胺盐酸盐,溶于吡啶20 mg/mL)于干燥后的提取物中,轻轻吹打混匀后,放入80 ℃烘箱中烘烤20 min;迅速滴加100 μL双(三甲基硅基)三氟乙酰胺(含1%三甲基硅烷)70 ℃烘烤1 h后冷却;向混匀的样品中加入5 μL的饱和脂肪酸甲酯标准混合液(溶于氯仿C8~C161 mg/mL,C18~C240.5mg/mL);混匀,上机检测。
1.3.4 GC-QTOF-MS检测条件
DB-5MS毛细管柱(30 m×250 μm,0.25 μm);进样量1 μL,不分流模式;前进样口的吹扫流速3 mL/min;柱流速1 mL/min;程序升温:柱温80 ℃维持1 min,以10 ℃/min升温至290 ℃,维持12 min;进样口温度280 ℃;传输线温度270 ℃;离子源温度220 ℃;质量扫描范围m/z30~600;扫描速率20 spectra/s。
1.4 数据处理
本实验通过数据预处理,主成分分析(principal component analysis,PCA)、正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)、差异化合物筛选和鉴定等基础数据分析,采用SPSS软件对数据进行独立样本t检验分析,以差异极显著(P<0.01)、差异显著(P<0.05)作为差异显著性进行判断。
2 结果与分析
2.1 各组蜂王浆样品总离子流图
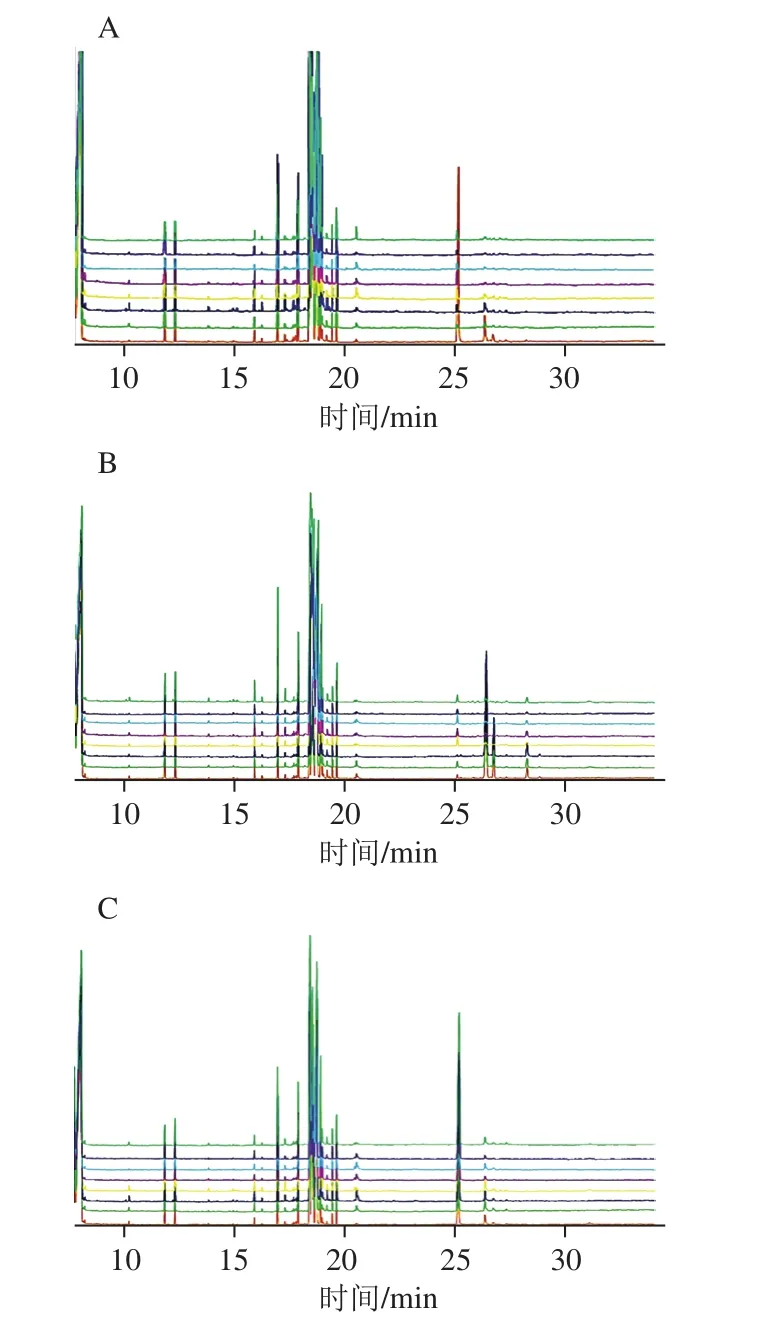
图1 饲喂白糖组(A)、蜂蜜组(B)、高果糖浆组(C)蜂王浆总离子流图Fig. 1 Total ion current chromatograms for royal jelly from sugar-fed (A), honey-fed (B) and high fructose syrup-fed honeybees (C)
由图1可知,3 组总离子流图色谱峰的主要保留时间都在0~26.667 min之间,但在具体同一保留时间的峰值高低、面积大小又存在着明显的差异,表明3 种不同糖饲喂所得的蜂王浆中的一些物质种类及含量存在差异,还需要进一步分析。
2.2 数据预处理结果
为进一步得出3 种不同饲喂方式所得到的蜂王浆具体成分差异,进行数据预处理分析,采用四分位数极差对数据进行过滤,目的是去除噪音数据,保留所有组中空值不大于50%的峰面积数据,然后对原始数据中的缺失值进行模拟,采用内标归一法对填补完以后的数据进行标准化处理,通过质谱分析,共检测出201 种成分,其中未知物99 种,主要为氨基酸、脂肪酸和糖类3大类,各组中蜂王浆中小分子如表1所示,由峰面积平均值可以看出3 组不同糖饲喂的结果中,部分小分子物质含量存在差异。
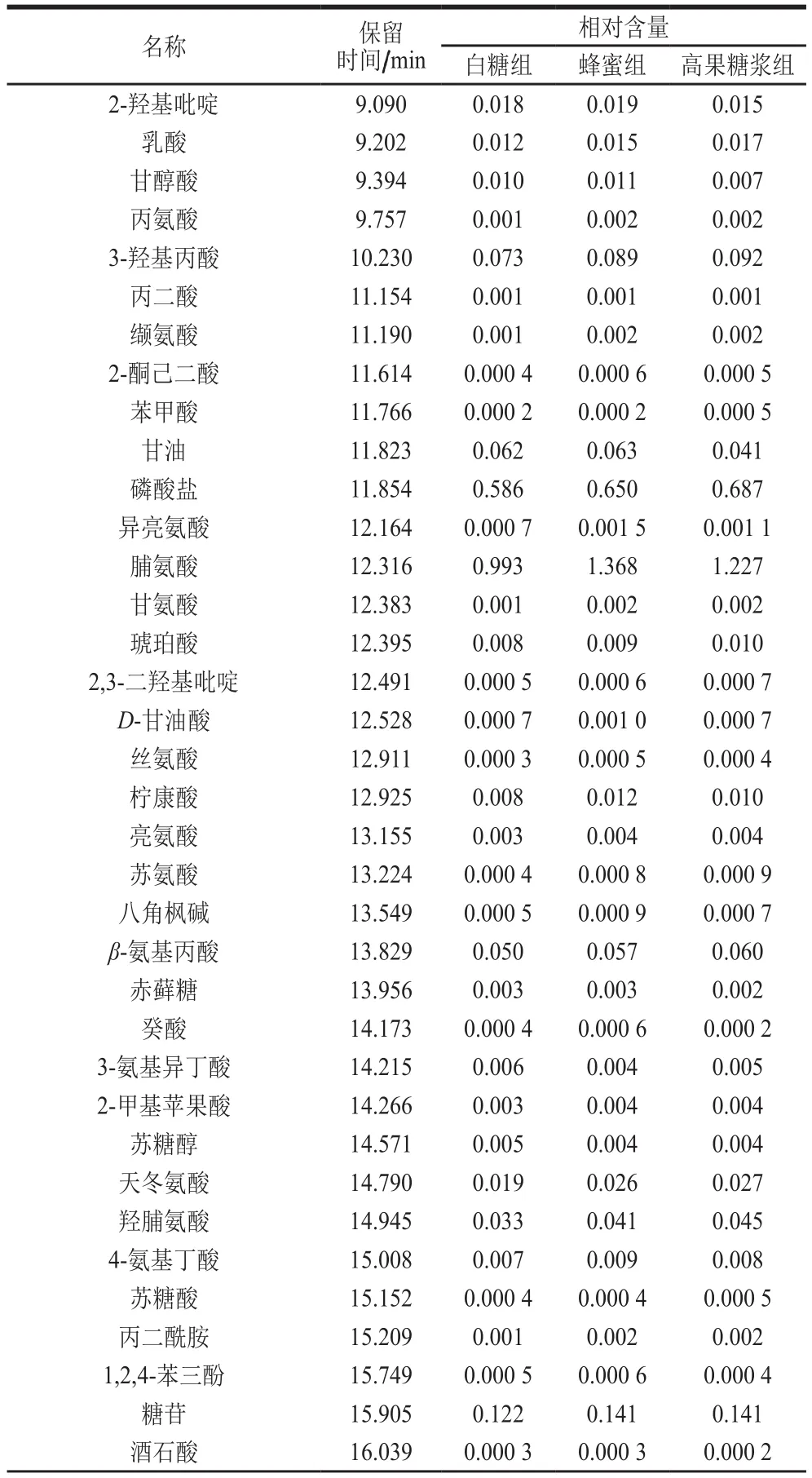
表1 GC-QTOF-MS代谢组学技术分析的小分子物质结果Table 1 Small molecular components of royal jelly analyzed by GC-QTOF-MS-based metabolomics
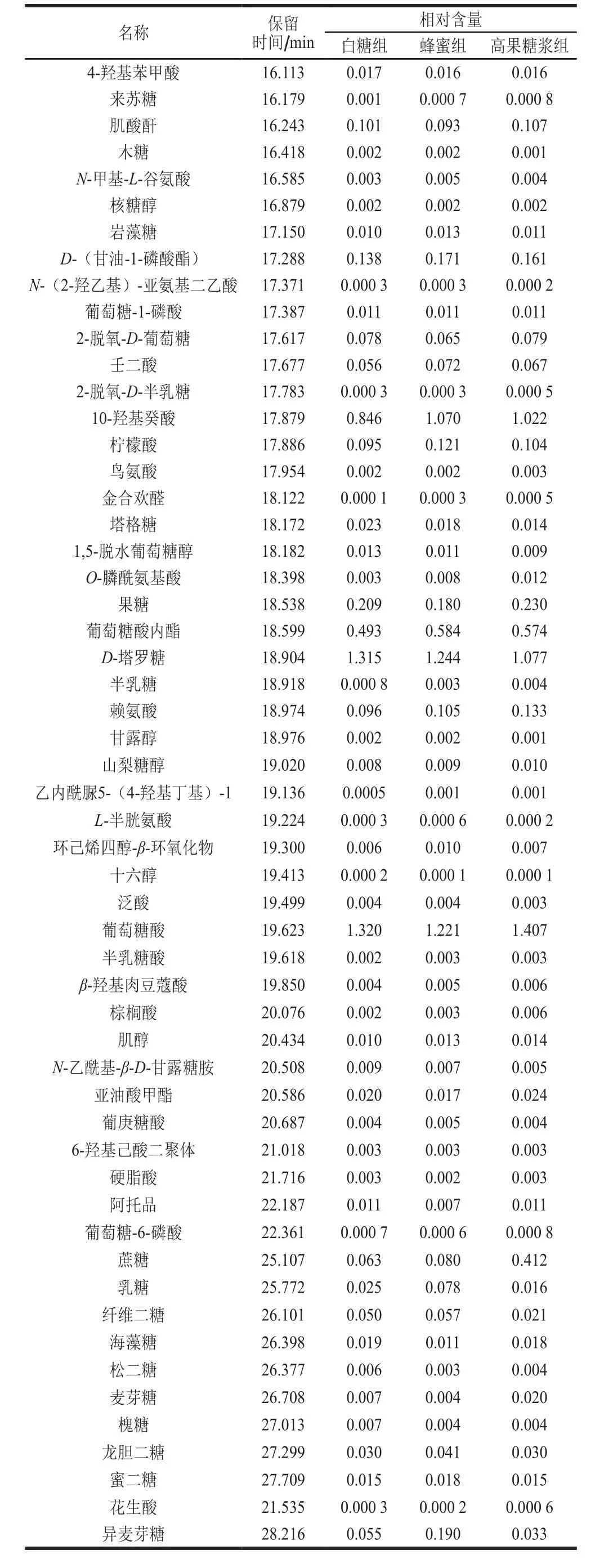
续表1
2.3 PCA结果
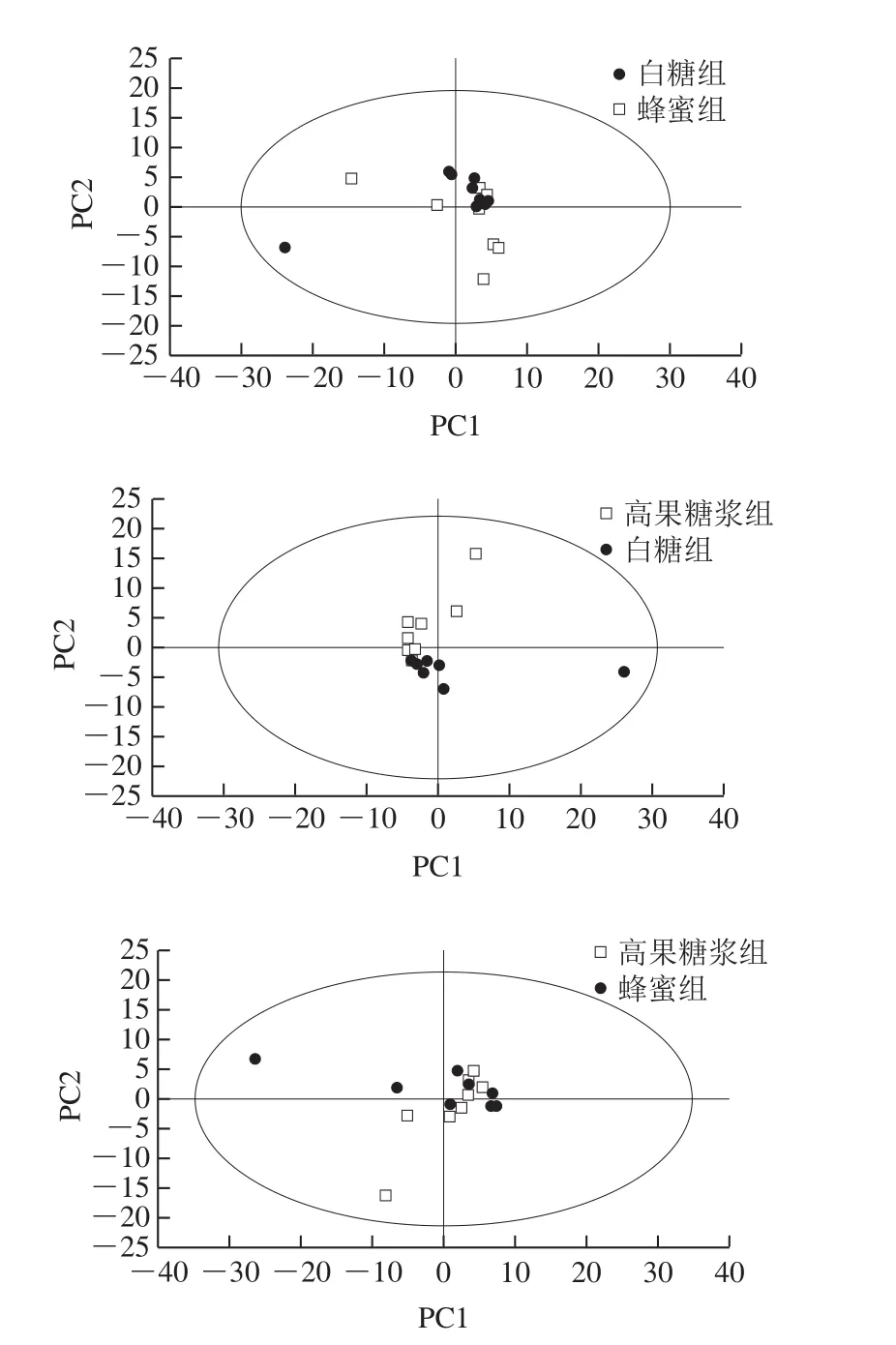
图2 白糖组、蜂蜜组、高果糖浆组PCA两两比较结果图Fig. 2 The PCA scores plot of sugar group, honey group and high fructose syrup group
对预处理后的数据进行多元变量模式识别分析,如图2所示,3 组所有样本均处于95%置信区间内,对蜂蜜组与白糖组、高果糖浆组与白糖组进行两两比较发现3 组间主成分均存在一定差异,具体差异物还需进一步分析。
2.4 OPLS-DA结果
使用SIMCA软件(V14, Umetrics AB, Umea, Sweden)对模型进行OPLS-DA,能够比较有效地将样品内部成分与预测主成分相关的差异突显出来。如图3A所示,置换检验中R2Y表示Y变量的可解释性,Q2表示模型的可预测性,越接近1越能很好地体现和说明两组样本间存在的差异性。置换检验截距R2为0.876、Q2为-0.104体现出模型较好的稳健性。蜂蜜组和白糖组样品均比较稳定,且2 组样本的主成分区分很明显,说明2 组样本中的代谢物存在差异。如图3B所示,R2为0.85、Q2为-0.175的置换检验截距体现出模型很好的稳健性。高果糖浆组和白糖组2 组样品均比较稳定,且2 组样本的主成分区分很明显,说明2 组样本中的代谢物存在差异。如图3C所示,置换检验截距R2为0.897、Q2为-0.182体现出模型很好的稳健性。高果糖浆组和蜂蜜组两组样品均比较稳定,且2 组样本的主成分区分很明显,说明2 组样本中的代谢物存在差异。
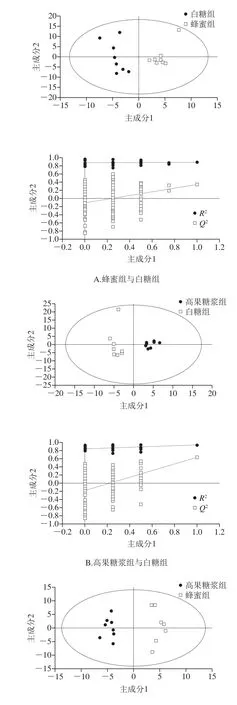
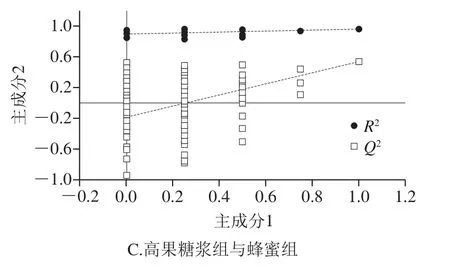
图3 3 组OPLS-DA得分图和置换检验图Fig. 3 OPLS-DA score plots and permutation test of 3 groups
2.5 差异代谢物的筛选及鉴定结果
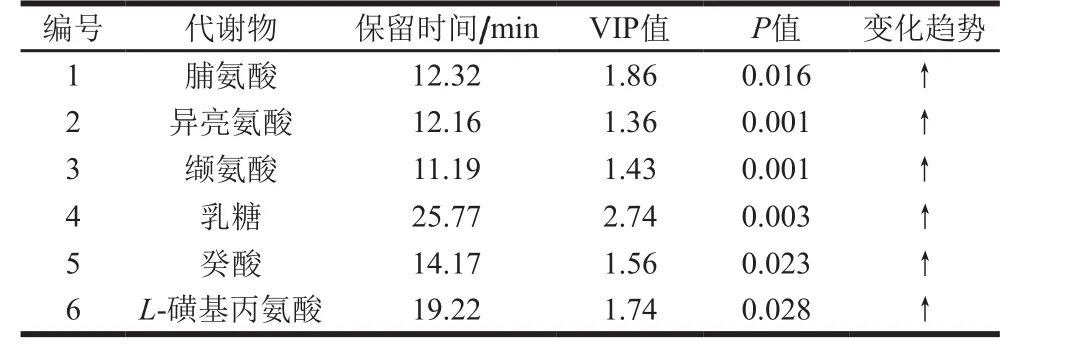
表2 蜂蜜组与白糖组的差异代谢物结果Table 2 Differential metabolites between honey-fed and sugar-fed groups
通过OPLS-DA过滤掉不相关的正交信号从而得到明确的差异性代谢物。采用OPLS-DA模型第1主成分的变量重要性预测(variable importance in the projection,VIP)值(阈值>1),并结合t检验的P值比较分析不同组样品中的具体差异性表达代谢物。蜂蜜组与白糖组的差异代谢物(VIP>1,P<0.05)结果见表2,与白糖组相比较,蜂蜜组脯氨酸、异亮氨酸、缬氨酸、乳糖、癸酸、L-磺基丙氨酸含量显著较高(P<0.05),其中异亮氨酸、缬氨酸和乳糖差异极显著(P<0.01)。
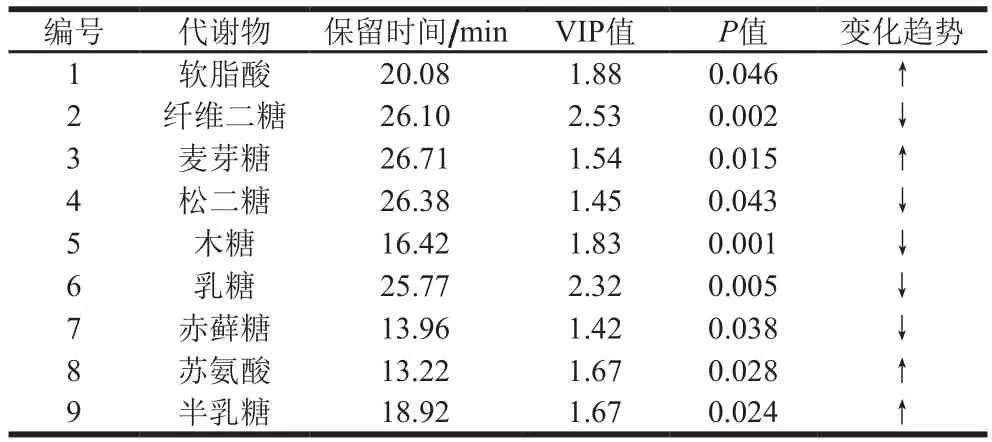
表3 高果糖浆组与白糖组的差异代谢物结果Table 3 Differential metabolites between high fructose syrup-fed and sugar-fed groups
如表3所示,与白糖组相比,高果糖浆组软脂酸、麦芽糖、苏氨酸、半乳糖含量显著较高(P<0.05),其中而纤维二糖、松二糖、木糖、乳糖、赤藓糖含量显著较低(P<0.05),纤维二糖、木糖和乳糖含量差异极显著(P<0.01)。
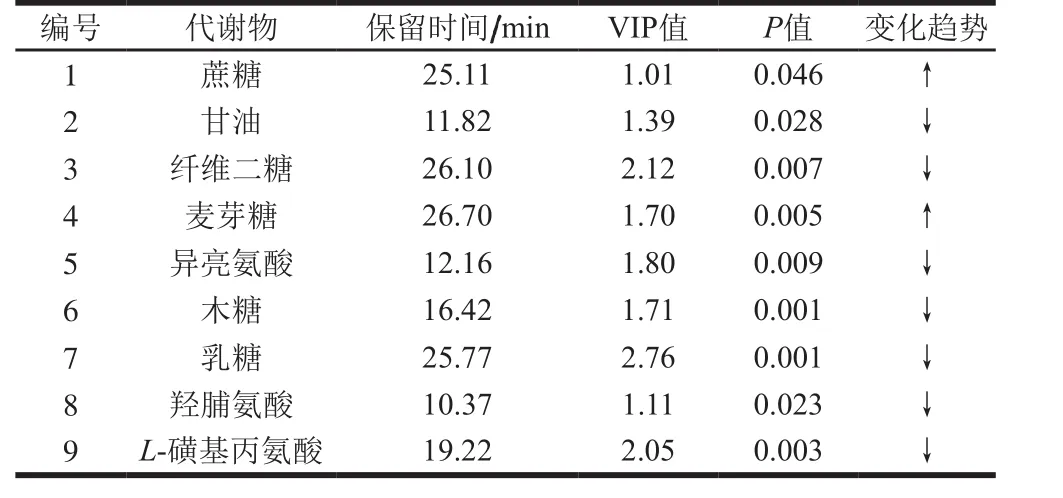
表4 高果糖浆组与蜂蜜组的差异代谢物结果Table 4 Differential metabolites between high fructose syrup-fed and honey-fed groups
如表4所示,与蜂蜜组相比较,高果糖浆组蔗糖、麦芽糖含量显著较高(P<0.05),其中麦芽糖含量差异极显著(P<0.01),而甘油、纤维二糖、异亮氨酸、木糖、羟脯氨酸、乳糖、L-磺基丙氨酸含量显著较低(P<0.05),其中纤维二糖、异亮氨酸、木糖、乳糖、L-磺基丙氨酸等含量差异极显著(P<0.01)。
3 讨论与结论
3 组不同糖饲喂的蜜蜂蜂王浆代谢产物中,氨基酸、脂肪酸以及糖类3 类小分子物质差异较显著,从氨基酸代谢物来看,苏氨酸、缬氨酸、异亮氨酸作为蜜蜂必需氨基酸,对于蜜蜂的生长发育有着重要影响[21-23]。此外,苏氨酸、异亮氨酸、缬氨酸是人体必需氨基酸,对人体健康有着重要的作用[24-26],蜂王浆作为蜂产品被人类所食用时,其含有各种功能成分能够很好地补充人体需求,蜂王浆中的缬氨酸、异亮氨酸、苏氨酸、脯氨酸、羟脯氨酸的含量越高,其营养作用越高。综合考虑,就氨基酸差异而言,蜂蜜组的蜂王浆产物较好,其次是高果糖浆组,最后是白糖组。
蜂王浆中的脂肪酸主要是由工蜂头部的上颚腺分泌的,其合成途径需经过羟基化和β氧化以及功能基因的修饰等步骤[27],脂肪酸的成分对于蜂群的营养调节以及在幼虫的生长发育过程中作用尤为重要,也在很大程度上影响着蜂王浆的品质[28-30]。本实验结果中,白糖饲喂组的蜂王浆产物中的癸酸显著低于蜂蜜组,高果糖浆组的蜂王浆产物中的甘油显著低于蜂蜜组,与白糖组相比较,高果糖浆组的蜂王浆产物中软脂酸较高。说明不同的糖饲料的蜜蜂蜂王浆产物中脂肪酸的含量有一定差异。
蜜蜂的生长发育、生命活动的进行以及蜂产品的生产所需要的能量主要由糖代谢产生,糖类在酶解的作用下水解成葡萄糖和果糖。单糖被吸收到血液中以后,在细胞脂肪体中合成海藻糖,同时转化成糖原贮存在细胞中。然后,蜜蜂机体内通过糖酵解、三羧酸循环产生三磷酸腺苷从而参与到身体的各项生理活动中去[31-32]。本实验表明不同的糖饲料饲喂对蜂王浆产物中的糖类含量有一定影响。蜜蜂对于糖类的需要会随着发育阶段所需营养物质而不同,它们会根据自身需求进行选择来维持机体均衡[33]。蜜蜂幼虫期发育缓慢,对糖的需要量少,对于1~4 日龄蜂王幼虫,所食食物中糖分的提高能够加大蜂王幼虫的采食量和速度,促进其生长发育[34]。
由以上可知,不同糖饲料饲喂分泌的蜂王浆中的小分子代谢物质存在差异,这种由于不同糖饲料饲喂导致的差异会对蜜蜂机蜜蜂幼虫的生长发育产生一定的影响,同时本实验认为蜂王浆作为一种保健产品供人们所食用时,应将蜂王浆中对于人体有利的小分子物质作为考虑因素来进行实际生产。同时,本实验创新之处也是不足之处在于运用GC-QTOF-MS代谢组学技术对蜂王浆中的代谢物进行基础分析,GC-QTOF-MS代谢组学技术由于是新兴起的一门检测技术,还在不断完善和发展,在蜂王浆成分这一方面的检测图谱还不够全面,以致部分小分子物质未能检出,无法比较其差异性,但随着技术的不断完善,利用代谢组学技术进一步分析蜂王浆中的代谢物以及代谢途径,对于指导蜂农饲喂及生产以及蜂王浆的进一步研究有一定的理论指导意义。
