纳豆菌液态发酵荞麦产纳豆激酶及其代谢特性分析
2019-03-11赵谋明林恋竹
赵谋明,邹 颖,林恋竹,*,吴 见
(1.华南理工大学食品科学与工程学院,广东 广州 510640;2.纽斯葆广赛(广东)生物科技股份有限公司,广东 广州 510931)
纳豆激酶是一种在纳豆发酵过程中由纳豆菌产生的丝氨酸蛋白酶[1-3],具有高效溶血栓活性,极具开发价值[4-5]。近年来利用纳豆菌液态发酵法生产纳豆激酶已经成为趋势。选择特色的发酵底物,并对发酵培养基及发酵条件进行优化以实现发酵底物的高效利用,是降低纳豆激酶生产成本的重要途径。荞麦含有丰富的碳水化合物、蛋白质、维生素、膳食纤维、矿物元素等营养成分[6]。黄酮类化合物如芦丁,是荞麦最重要的生物活性物质之一,具有很强的抗氧化活性,对心血管疾病以及高血糖、高血脂等慢性疾病具有较好的防治作用[7-8]。前期研究结果表明,在基础培养基中添加荞麦可以促进纳豆菌产纳豆激酶并提高发酵产物的抗氧化活性[9]。
肽类物质是优良的氮源,具有促进微生物生长发育和加速新陈代谢的作用[10]。枯草芽孢杆菌液态发酵培养基多使用蛋白胨作为氮源。蛋白胨成本较高,且市场上绿色安全的食品级蛋白胨较少。以大豆蛋白为原料,采用食品级蛋白酶法制备大豆蛋白酶解物具有绿色、安全的特点[11],可以取代国内发酵工业中所用的价格高昂蛋白胨类产品,达到降低成本提高食用安全性目的。
本实验拟优化纳豆菌液态发酵荞麦产纳豆激酶揺瓶、发酵罐条件,制备高纳豆激酶活力、富含谷物多酚且具有强抗氧化活性的发酵产物。对比大豆分离蛋白酶解物与商业大豆蛋白胨作为补充氮源时菌体生长规律以及代谢物质(酶、可溶性蛋白、还原糖、多酚及抗氧化物质)变化规律,为工业化放大生产纳豆激酶提供理论与方法指导。
1 材料与方法
1.1 材料与试剂
纳豆菌(Bacillus subtilis natto) 中国农业大学食品科学与营养工程学院;荞麦 南沙旧镇天汇百货超市;大豆分离蛋白 广州合诚实业有限公司;凝血酶、纤维蛋白原 上海源叶生物科技有限公司;BCA试剂盒 广州鼎国生物科技有限公司;2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis (2-amidinopropane)dihydrochloride,AAPH)、荧光素、Trolox(纯度99%)美国Sigma公司;大豆蛋白胨 广东环凯微生物科技有限公司;胰酶、NS37071、复合蛋白酶、α-淀粉酶(10 000 U/g) 诺维信公司;福林-酚试剂根据GB/T 23527—2009《蛋白酶制剂》规定方法配制;其他试剂均为分析纯。
1.2 仪器与设备
Varioskan Flash型酶标仪 美国Thermo公司;UV-721型紫外分光光度计 上海精密科学仪器仪表有限公司;LRH-250A-II生化培养箱 韶关市泰宏医疗器械有限公司;SKY-211B恒温培养振荡器 江苏苏昆仪器有限公司;BioStat B2.5 L发酵罐 德国Sartorius公司。
1.3 方法
1.3.1 揺瓶条件优化
种子液的制备:取试管斜面上保藏的纳豆菌接种于种子培养基中(胰蛋白胨1%,酵母粉0.5%,NaCl 1%,pH 7.0,100 mL/250 mL锥形瓶),37 ℃、180 r/min振荡培养20 h。
荞麦浸泡6 h后,按料液比1∶10(g/mL)加水打浆,分别加入不同添加量(0%、0.2%、0.4%、0.6%、0.8%、1.2%)的α-淀粉酶,90 ℃加热40 min,得到荞麦糖化液,调节混悬液pH 7.0,将种子液以2%的接种量接种于发酵培养基中(25 mL/250 mL锥形瓶),37 ℃、180 r/min振荡培养24 h,考察α-淀粉酶添加量对纳豆菌产纳豆激酶的影响。
大豆分离蛋白酶解物的制备:取大豆分离蛋白,按料液比1∶15(g/mL)加入去离子水,搅拌至大豆分离蛋白充分水化,分别加入1%胰酶(以大豆分离蛋白质量计)、NS37071、复合蛋白酶,分别于55 ℃酶解4、8、12 h,沸水浴灭酶10 min,离心(4 ℃,8 000 r/min,15 min),取上清液,减压浓缩后冷冻干燥,得到大豆分离蛋白酶解物。
在经过优化后的荞麦糖化液中,分别补充不同大豆分离蛋白酶解物及商业大豆蛋白胨(添加量0.4%),调节混悬液pH 7.0,按上述摇瓶条件进行发酵,考察氮源对纳豆菌产纳豆激酶的影响。
在经过优化后的荞麦糖化液中,补充经过上述优化得到的大豆分离蛋白酶解物,调节混悬液pH 7.0,按上述摇瓶条件进行发酵,考察发酵时间对纳豆菌产纳豆激酶的影响。
1.3.2 2.5 L发酵罐发酵条件的优化
将种子液以2%接种量接种于发酵培养基中(经1.3.1节优化得到的发酵培养基,25 mL/250 mL锥形瓶),37 ℃、180 r/min培养24 h。将摇瓶预培养后的菌体接种到装有发酵培养基的发酵罐中,固定发酵温度37 ℃、发酵时间36 h,分别考察通气量(2.0、3.0、3.5 L/min)、搅拌速率(200、300、400 r/min)、装液量(1、1.2、1.5 L)、接种量(2.0%、3.0%、4.0%)对纳豆菌产纳豆激酶的影响。
1.3.3 2.5 L发酵罐中菌体生长和代谢特性分析
分别于荞麦糖化液中补充大豆分离蛋白酶解物和商业大豆蛋白胨,在发酵罐优化条件下,使用pH电极和复膜氧电极在线监测发酵过程中pH值与溶氧的变化。发酵过程中,每间隔6 h取样,分别测定生物量、纳豆激酶活力、可溶性蛋白、还原糖、总酚含量、氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)。
1.3.4 指标的测定
1.3.4.1 纳豆激酶活力
纤维蛋白平板法:参照Astrup等[12]的方法并加以改进。将13.35 mg纤维蛋白原溶于15 mL pH 7.4磷酸盐缓冲溶液中,制成0.89 mg/mL的纤维蛋白原缓冲溶液,50 ℃保温5~10 min。将7.5 U凝血酶溶于1 mL pH 7.4磷酸盐缓冲溶液中制得凝血酶缓冲溶液。配制1%琼脂糖溶液,50 ℃保温10 min,将1 mL 7.5 U/mL凝血酶缓冲溶液、15 mL纤维蛋白原溶液以及20 mL琼脂糖溶液迅速混匀,立即倒平板,凝固后进行打孔,取10 μL发酵产物加样于纤维蛋白原平板孔中,37 ℃孵育18 h,用游标卡尺测量透明圈直径,并计算透明圈面积。一个酶活力单位(U)定义为1 min内水解纤维蛋白产生0.01 mm2透明圈所需要的酶量。
紫外分光光度计法[13]:将1.4 mL的Tris-HCl缓冲液(0.05 mol/L,pH 7.8)和0.4 mL 0.72 g/100 mL的纤维蛋白原溶液混合,振荡后于37 ℃放置10 min;加入0.1 mL凝血酶溶液(20 U/L)充分混匀,37 ℃放置10 min,于上述溶液中加入0.1 mL样品溶液(对照组不加),37 ℃水浴保温反应1 h。每隔20 min振荡一次,最后加入2 mL 0.2 mol/L的三氯乙酸(trichloroacetic acid,TCA)终止反应(对照组同时添加样品溶液),37 ℃水浴中放置20 min,将上述反应于10 000 r/min离心10 min,测定275 nm波长处的吸光度。一个酶活力单位(FU)定义为1 min内在275 nm波长处吸光度变化0.01所需要的酶量。
1.3.4.2 生物量
采用万春艳[11]的方法(细胞干重法),准确量取25 mL发酵液,4 ℃、8 000 r/min离心15 min,收集菌体,用生理盐水洗涤2 次后,将菌体转移到干燥皿中,105 ℃烘干至恒质量。
1.3.4.3 可溶性蛋白
按BCA试剂盒方法,以牛血清蛋白为标准品测定蛋白质量浓度。
1.3.4.4 还原糖
还原糖的测定采用3,5-二硝基水杨酸比色法[14]。
1.3.4.5 总酚
采用Lin Lianzhu等[15]的方法,取样0.5 mL,加蒸馏水至6 mL,摇匀,加入0.5 mL福林-酚试剂摇匀,在1~8 min内加入20% Na2CO3溶液1.5 mL,加入蒸馏水至10 mL摇匀,40 ℃保温2 h,迅速冷却后,立即在760 nm波长处测定其吸光度。以没食子酸为标准品做标准曲线,计算总酚含量。
1.3.4.6 ORAC
参考林恋竹等[16]的方法,在微孔板中分别加入25 μL样品溶液或Trolox溶液或缓冲液(75 mmol/L NaH2PO4-Na2HPO4缓冲液,pH 7.4),然后加入75 μL 0.159 μmol/L荧光素钠溶液,37 ℃孵育10 min后,加入100 μL 38.25 mmol/L AAPH,保持反应体系温度恒定为37 ℃,设定激发波长为485 nm,发射波长为530 nm,开始计时反应并读数(f0),每分钟读一次数(f1、f2、…、f70)共读71 次数(共计反应70 min),将每次读数连成曲线。计算见公式(1)、(2):
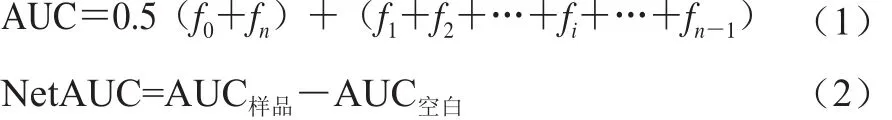
式中:AUC为曲线下的面积;NetAUC为样品曲线下面积与空白曲线下面积之差。
Trolox浓度与NetAUC呈线性关系,换算得到样品的ORAC值,即达到每千克样品的ORAC所需Trolox的量(mmol/kg)。ORAC值越高,则样品抗氧化活性越强,抗氧化活性以Trolox当量表示。
1.3.4.7 菌体比生长速率与代谢物质比合成速率
菌体比生长速率(μm)是指菌体生长速率与菌体浓度之比,代谢物质比合成速率(μp)是指代谢物质合成速率与代谢物质浓度之比,其计算分别见式(3)、(4):

式中:x为不同发酵时间时菌体质量浓度/(g/L);y为不同发酵时间代谢物质质量浓度/(g/L)。
1.4 数据处理
2 结果与分析
2.1 纳豆菌液态发酵荞麦产纳豆激酶摇瓶条件优化结果
2.1.1α-淀粉酶添加量对纳豆菌液态发酵荞麦产纳豆激酶活力的影响
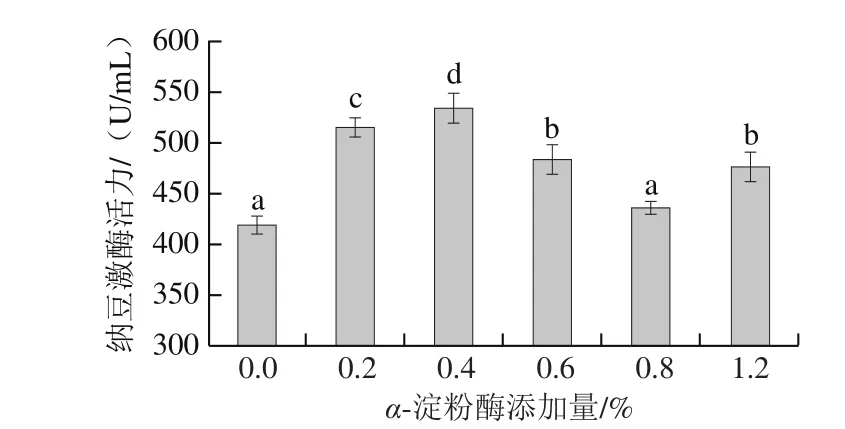
图1 α-淀粉酶添加量对纳豆菌液态发酵产纳豆激酶活力的影响Fig. 1 Effect of α-amylase addition on the production of nattokinase
如图1所示,随着α-淀粉酶添加量的增加,纳豆激酶活力呈现先升高后下降的趋势。未添加α-淀粉酶的发酵培养基黏稠且流动性差,不利于纳豆菌利用;添加α-淀粉酶后,荞麦中淀粉被可控水解,更容易被纳豆菌利用,纳豆激酶活力从未添加α-淀粉酶时的420.12 U/mL提升到535.66 U/mL,故选择α-淀粉酶添加量为0.4%。碳源供给菌体生命活动所需营养,对菌体产酶具有诱导或阻遏作用[17]。将麦芽糖或葡萄糖作为碳源时,纳豆菌所产纳豆激酶活力较高,以可溶性淀粉作为碳源时,纳豆菌所产纳豆激酶活力相对较低[18]。葡萄糖是易被吸收利用的碳源,属于速效碳源,然而速效碳源在高浓度时可能会表现出阻遏作用;被菌体缓慢利用的碳源往往更有利于产物生成,尤其是次生代谢产物的合成,这是由于碳源的适中利用速率恰好满足产物合成的需求[19]。因此,通过优化碳源组成调控菌体产酶,是提高发酵产物中纳豆激酶活力的重要途径。α-淀粉酶可以快速将直链淀粉水解成麦芽糖和麦芽三糖,再将麦芽三糖水解成葡萄糖和麦芽糖[20]。通过对荞麦淀粉进行适度水解优化培养基中碳源组成,可提高纳豆激酶活力。
2.1.2 补充氮源对纳豆菌液态发酵荞麦产纳豆激酶活力的影响
纳豆菌对氮源的选择性较高,仅在以大豆蛋白胨为氮源时有较高的蛋白酶活力和纳豆激酶活力,使用其他有机氮源时,菌体能生长,但酶活力相对较低[19]。大豆蛋白胨是大豆蛋白经过酸、碱或酶水解而成的一种由肽类物质、氨基酸组成的混合物,可大大加快酶的合成速率[21]。
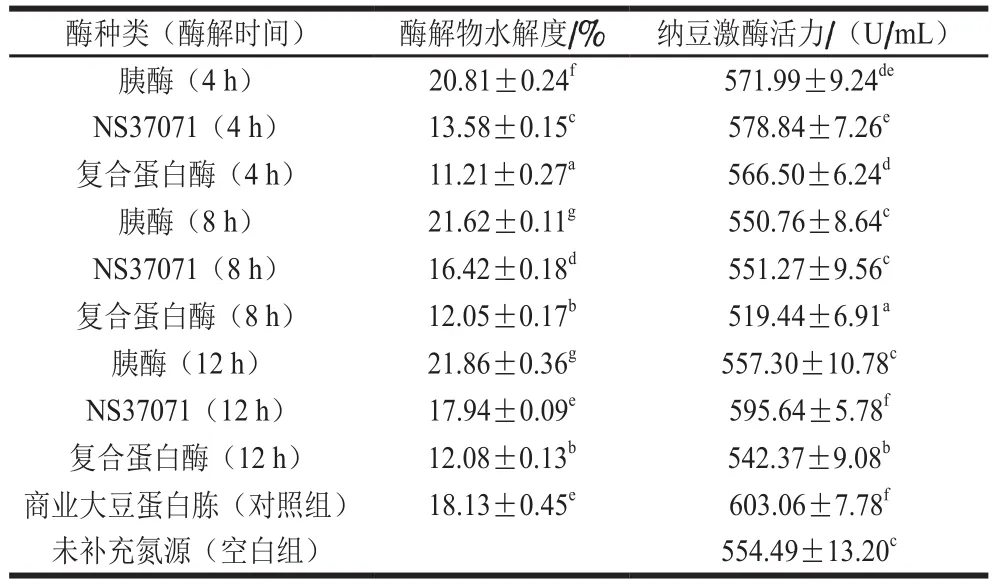
表1 添加氮源对纳豆菌液态发酵产纳豆激酶活力的影响Table 1 Effect of nitrogen sources on the production of nattokinase
如表1所示,大豆分离蛋白酶解物的水解度随酶解时间延长而增加。3 种酶水解大豆分离蛋白所得酶解物水解度从高到低依次为胰酶>NS37071>复合蛋白酶。不同水解度的大豆分离蛋白酶解物作为补充氮源时,纳豆激酶活力存在显著性差异。然而,大豆蛋白酶解物的促产酶活力不随其水解度的增加而增加。补充NS37071酶解产物,所得发酵产物中纳豆激酶活力较补充胰酶/复合蛋白酶酶解产物高。不同蛋白酶促产酶活力不同,这可能是由于各种蛋白酶的酶切位点不同,导致酶解产物组成不同[22]。补充NS37071酶解12 h时所制得的酶解物,发酵产物中纳豆激酶活力可达595.64 U/mL,与添加商业大豆蛋白胨发酵所产纳豆激酶活力无显著性差异。
2.1.3 发酵时间对纳豆菌液态发酵产纳豆激酶活力的影响
在发酵过程中,在产酶总量达到峰值时应及时停止发酵,否则酶活力就可能会出现回落的现象[9]。如图2所示,在发酵前期,纳豆激酶活力随发酵时间的延长不断增加,至36 h,达到最高值;在发酵后期随发酵时间的延长,纳豆激酶活力逐渐降低。故选定36 h为最佳发酵时间。
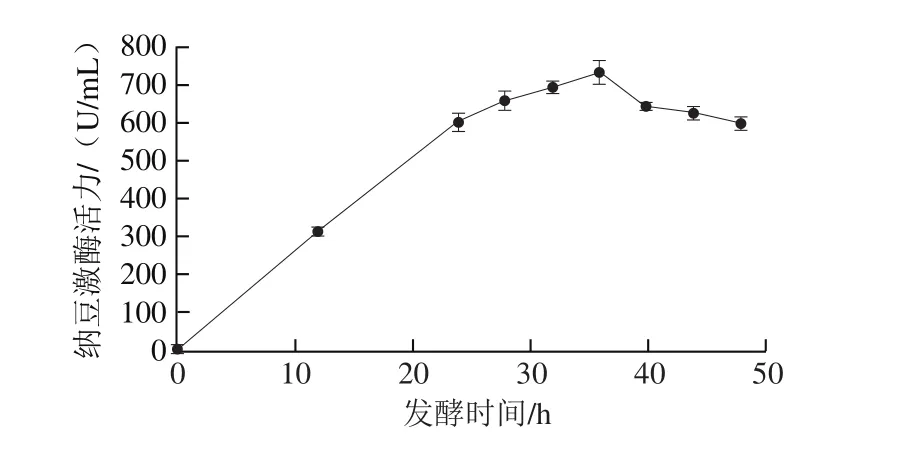
图2 发酵时间对纳豆菌液态发酵产纳豆激酶活力的影响Fig. 2 Effect of fermentation time on the production of nattokinase
纳豆菌液态发酵荞麦产纳豆激酶的揺瓶条件为荞麦浸泡6 h后,按料液比1∶10(g/mL)加水打浆,加入0.4%α-淀粉酶,90 ℃加热40 min,补充NS37071酶解12 h时所制得酶解物为氮源,调节发酵培养基pH 7.0,装液量10%,接种量3%,摇床转速180 r/min,发酵温度37 ℃,发酵时间36 h,酶活力从420.12 U/mL提升至756.96 U/mL。
2.2 2.5 L发酵罐发酵条件的优化结果
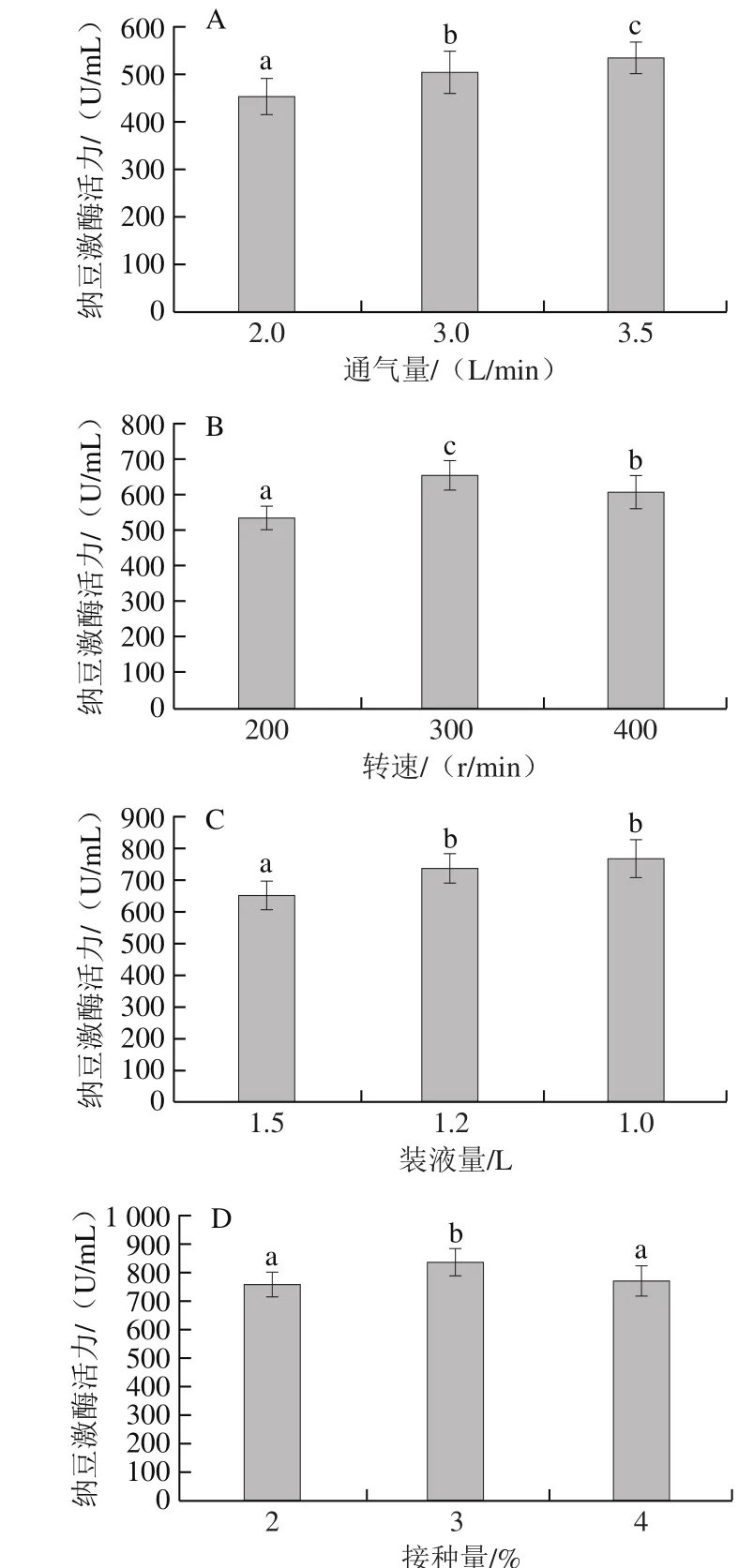
图3 通气量(A)、转速(B)、装液量(C)、接种量(D)对纳豆菌液态发酵产纳豆激酶的影响Fig. 3 Effects of ventilation (A), stirring speed (B), loading volume (C)and inoculum size (D) on the production of nattokinase
纳豆菌发酵属于极其好氧发酵,通气量直接影响发酵罐中的溶氧。如图3A所示,当通气量为2.0 L/min时,纳豆激酶活力较低,随着通气量的增加,纳豆激酶活力增加。因通气量较大时容易起泡,选择通气量为3.5 L/min。搅拌速率直接影响培养基的溶氧,在通气量不变的条件下,提高搅拌速率可以提高传氧速率,但转速过高,产生的剪切力可能损害微生物菌体,使菌体生长变缓,也可能影响产物活性[23],选择转速300 r/min(图3B)。装液量增加至1.5 L时,纳豆激酶活力降低,因此选择装液量为1.2 L(图3C)。接种量对于发酵尤其是大规模发酵有重要影响,合适的接种量可以使微生物迅速增殖,减少杂菌污染机会,提高发酵效率;过大的接种量会导致细胞生长过快,造成有害物质的大量积累和培养液黏度的改变,反而影响产物的合成[24]。随接种量增加,纳豆激酶活力呈先升高后降低的趋势,因此选择3%接种量(图3D)。最终得到优化后的发酵罐最佳条件为通气量3.5 L/min、转速300 r/min、装液量1.2 L、接种量3%、发酵36 h,酶活力达到834.91 U/mL,相当于152.5 FU/mL(为方便与文献所报道的纳豆激酶酶活力水平进行对比,采用紫外分光光度计法测定纳豆激酶活力),与文献[25-28]报道未经过基因重组的纳豆菌液态发酵所产纳豆激酶活力(≤130.96 FU/mL)相比有一定的优势。
2.3 2.5 L发酵罐中菌体生长和代谢特性分析
自制大豆蛋白酶解物与商业大豆蛋白胨作为补充氮源时,在摇瓶条件下,纳豆菌所产纳豆激酶活力并无显著性差异。然而,两者的水解度、氨基酸组成与分子质量分布不同。在菌体放大培养时,两者可能会对菌体的生长和代谢有不同的影响。本实验通过对比研究补充自制大豆蛋白酶解物与商业大豆蛋白胨时,2.5 L发酵罐中菌体生长和代谢特性,揭示自制大豆蛋白酶解产物作为补充氮源的优势。
2.3.1 氮源对纳豆菌发酵过程生物量和比生长速率的影响
如图4A所示,添加自制大豆蛋白酶解物与商业大豆蛋白胨组均几乎没有延滞期,立即进入生长对数期,随发酵时间延长,生物量快速增加。商业大豆蛋白胨组发酵18 h后缓慢生长趋于稳定,在24 h时达到最大生物量(5.81 g/L)。而大豆分离蛋白酶解物组发酵前期生长速率较慢,但对数期较长,在30 h左右生物量趋于稳定达到最大值(6.68 g/L)。
如图4B所示,2 个组别的比生长速率均呈现先增加后降低的趋势,商业大豆蛋白胨组在2.8 h时比生长速率最快(0.92 h-1),而大豆分离蛋白酶解物组在10.8 h时比生长速率最大(0.22 h-1)。总体而言,商业大豆蛋白胨作为补充氮源时,发酵前期菌体比生长速率更快,达到最大比生长速率时间提前,但后期动力不足。可能是因为水解度更高的商业大豆蛋白胨中小分子肽和氨基酸在发酵前期为纳豆菌提供速效氮源,促进菌体生长,但后期培养基组成发生变化不利于纳豆菌生长。
2.3.2 氮源对纳豆菌发酵过程可溶性蛋白含量的影响
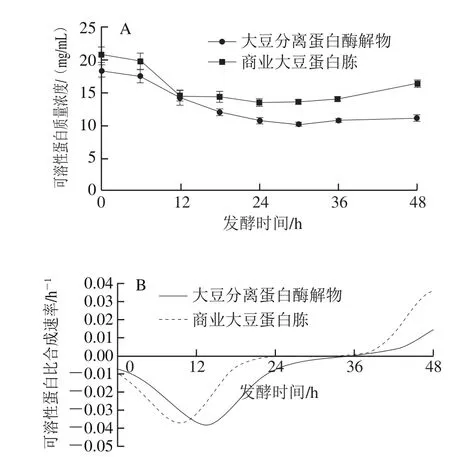
图5 发酵过程中可溶性蛋白(A)及其比合成速率(B)的变化Fig. 5 Changes in soluble protein level (A) and its specific formation rate (B) during fermentation
如图5A所示,添加自制大豆蛋白酶解物与商业大豆蛋白胨组在发酵过程中可溶性蛋白含量变化趋势大致相同,均呈现先降低后略微增长的趋势;随着发酵过程中微生物对氮源的利用,体系内可溶性蛋白含量逐渐减少,发酵后期可溶性蛋白有所增加,可能与发酵过程中酶蛋白的分泌与积累有关;如图5B所示,可溶性蛋白的消耗速率先增加后减小,其中商业大豆蛋白胨组在发酵9.7 h时对可溶性蛋白的消耗速率最快(0.036 h-1),大豆分离蛋白酶解物组在发酵13.6 h时对可溶性蛋白的消耗速率最快(0.037 h-1)。
2.3.3 氮源对纳豆菌发酵过程还原糖含量的影响
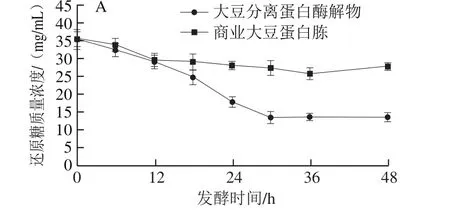
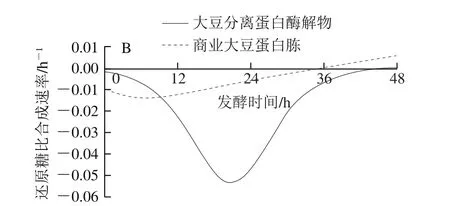
图6 发酵过程中还原糖(A)及其比合成速率(B)的变化Fig. 6 Changes in reducing sugar level (A) and its specific formation rate (B) during fermentation
如图6A所示,发酵液中糖类物质逐渐被菌体利用,两组还原糖含量均逐渐下降。大豆分离蛋白酶解物组在36 h还原糖含量趋于稳定,即不再消耗碳源;而对于商业大豆蛋白胨组,24 h后还原糖含量趋于平稳,说明纳豆菌对碳源的消耗基本停止。从图6B可知,大豆分离蛋白酶解物组在20.85 h还原糖比消耗速率最快(0.053 h-1),而商业大豆蛋白胨组在12 h后还原糖比消耗速率远低于大豆分离蛋白酶解物组。商业大豆蛋白胨组对碳源的利用相对较少,且消耗速率较慢,使得发酵液中碳氮比发生较大变化,不利于后续发酵产酶。
2.3.4 氮源对纳豆菌发酵过程pH值与溶氧的影响
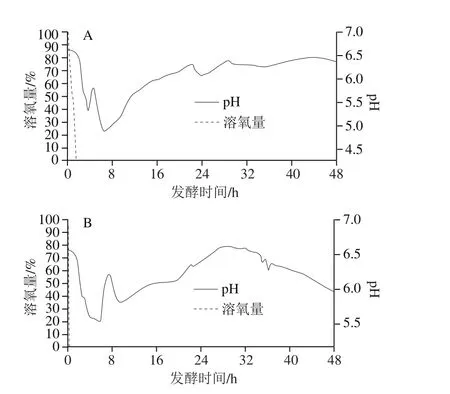
图7 大豆分离蛋白酶解物组(A)和商业大豆蛋白胨组(B)在发酵过程中pH值与溶氧的变化Fig. 7 Changes in pH and dissolved oxygen during fermentation with soy protein isolate hydrolysate (A), and commercial soybean peptone (B)as supplementary nitrogen source
如图7所示,添加自制大豆蛋白酶解物与商业大豆蛋白胨组pH值变化趋势整体上是一致的,初始pH 6.8左右,6 h左右降到最低值随后上升,表明在前6 h,糖类被大量利用,分解成小分子酸、醇,使pH值迅速下降。随着糖类的缺乏,开始大量利用氮源,氨基酸被利用后产生氨气使pH值回升。溶氧量发酵初期急剧下降,因为高浓度发酵下菌体氧需求量大。特别是添加商业大豆蛋白胨组,溶氧下降速率更快,这是由于纳豆菌快速生长需氧量急剧上升,与其比生长速率曲线相对应(图4B)。
2.3.5 氮源对纳豆菌发酵过程纳豆激酶活力的影响
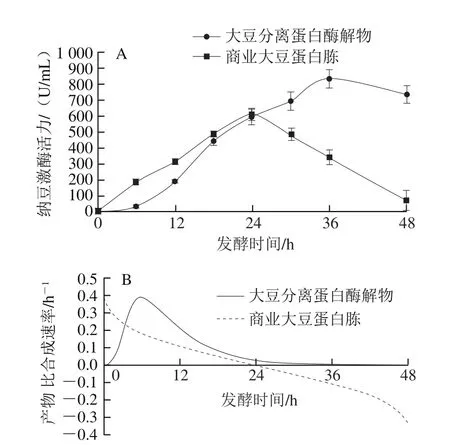
图8 发酵过程中发酵过程中纳豆激酶活力(A)与产物比合成速率(B)的变化Fig. 8 Changes in nattokinase activity (A) and its specific nattokinase formation rate (B) during fermentation
如图8A所示,商业大豆蛋白胨作为补充氮源时,24 h达到酶活力最高值(604.61 U/mL),之后酶活力急剧下降;而大豆分离蛋白酶解物组酶活力持续上升至36 h达到最大值(834.91 U/mL)才出现回落。从图8B可知,商业大豆蛋白胨组产物比合成速率呈负增长,而大豆分离蛋白酶解物组纳豆激酶比合成速率曲线呈钟形曲线,在6 h左右达最大值0.41 h-1。自制大豆蛋白酶解物与商业大豆蛋白胨水解度、氨基酸组成与分子质量分布不同,进而影响纳豆激酶的合成速率。
2.3.6 氮源对纳豆菌发酵过程酚类物质及抗氧化物质含量的影响
如图9A所示,随发酵时间延长,自制大豆蛋白酶解物与商业大豆蛋白胨组的总酚含量均逐渐增加,从初始的0.033 mg/mL分别增加到0.109 mg/mL(大豆分离蛋白酶解物组)和0.090 mg/mL(商业大豆蛋白胨组),说明酚类物质在发酵过程中随着菌体对荞麦的利用逐渐溶出,而大豆分离蛋白酶解物组的总酚含量要高于商业大豆蛋白胨组,说明微生物对两组中荞麦的利用程度不同,后者酚类物质溶出更多。如图9B所示,两组均呈现酚类物质比生成速率呈先增加后减小的趋势,在12 h左右达到最大速率。
谷物多酚、肽类物质与微生物代谢产物是发酵产物发挥抗氧化活性重要的物质基础[9]。如图10A所示,随着发酵时间的延长,两组抗氧化物质含量均增加,发酵36 h时,大豆分离蛋白酶解物组的抗氧化活性(27.43 μmol/mL)高于商业大豆蛋白胨组(22.71 μmol/mL),与发酵初期(16.69 μmol/mL)相比,抗氧化活性显著提高。如图10B所示,抗氧化物质比生成速率均在6 h左右达到最大值,但大豆分离蛋白酶解物组抗氧化物质比生成速率最大值(0.018 1 h-1)高于商业大豆蛋白胨组(0.014 8 h-1)。
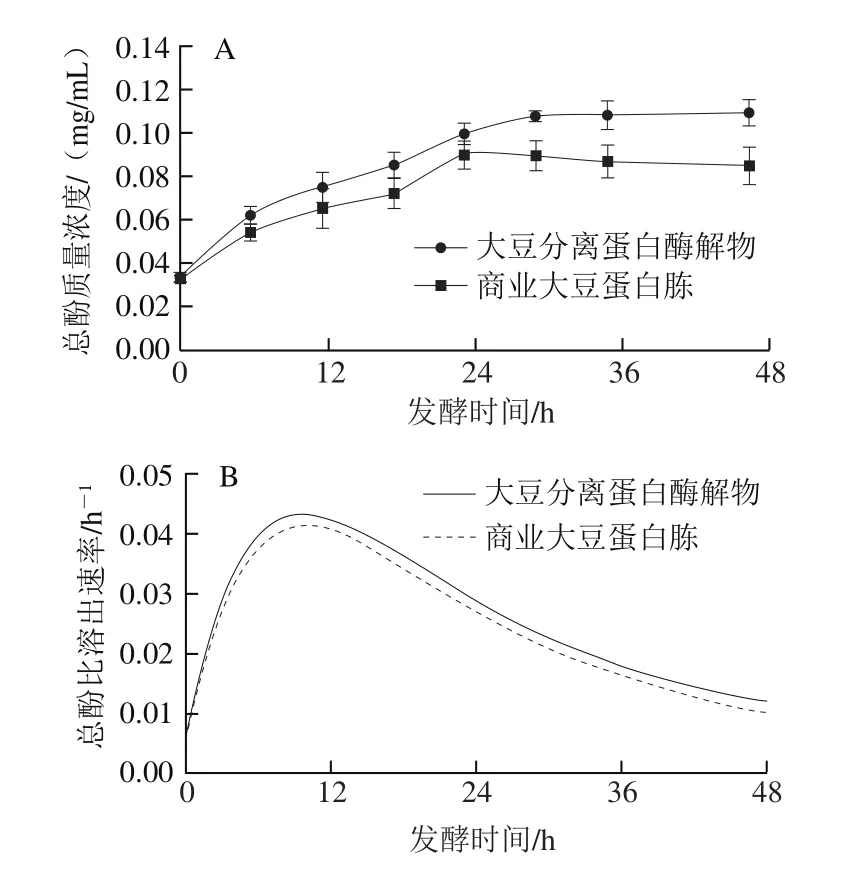
图9 发酵过程中酚类物质(A)及其比溶出速率(B)的变化Fig. 9 Changes in phenolics level (A) and its specific dissolution rate (B)during fermentation
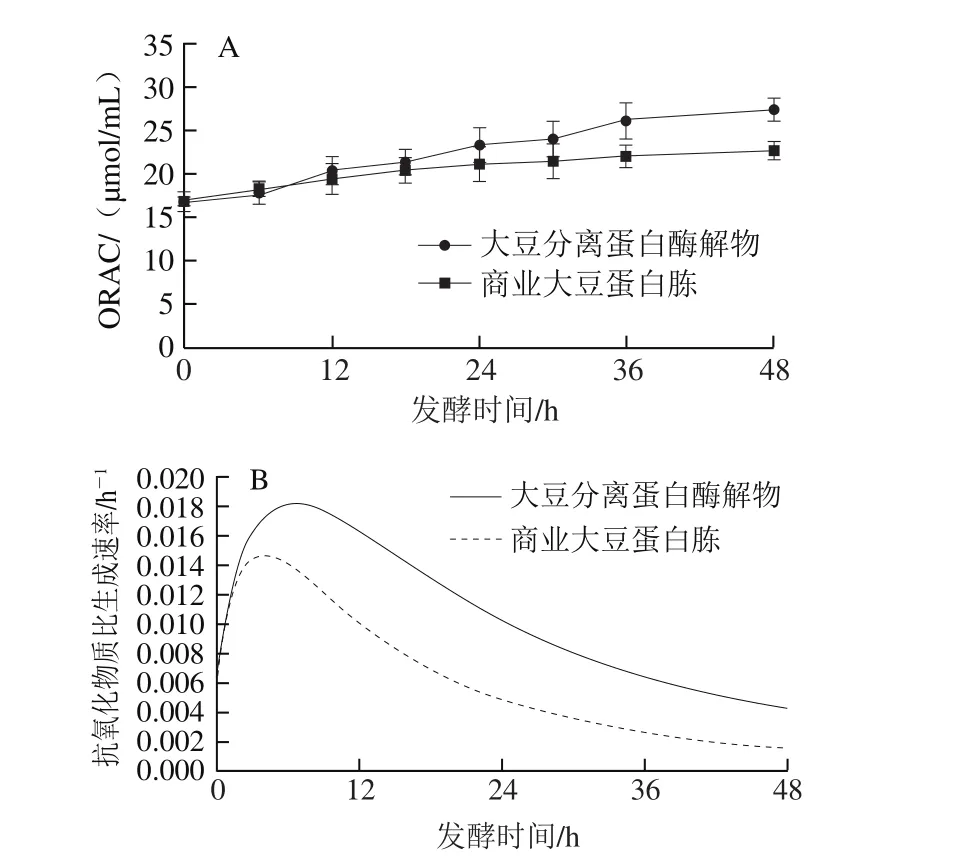
图10 发酵过程中抗氧化物质(A)及其比生成速率(B)的变化Fig. 10 Changes in antioxidant activity (A) and its specific antioxidants formation rate (B) during fermentation
综上所述,补充大豆分离蛋白酶解物时,纳豆菌生长对数期较长,在30 h左右生物量趋于稳定,达到最大值(6.68 g/L);纳豆菌对可溶性蛋白与还原糖的消耗量较大,在36 h趋于平稳;纳豆激酶活力持续上升至36 h达到最大值,为834.91 U/mL(152.5 FU/mL),远高于补充商业大豆蛋白胨组(酶活力提高38%);酚类物质比溶出速率在12 h达到最大值,抗氧化物质比生成速率在6 h达到最大值,发酵36 h时,发酵产物中酚类物质、抗氧化物质含量分别达到0.109 mg/mL及27.43 μmol/mL,远高于补充商业大豆蛋白胨组。
3 结 论
纳豆菌液态发酵荞麦产纳豆激酶2.5 L发酵罐最优条件为荞麦浸泡6 h后,按料液比1∶10(g/mL)加水打浆,加入0.4% α-淀粉酶,90 ℃加热40 min,补充NS37071酶解12 h时所得酶解物,调节发酵培养基pH 7.0,接种量3%,通气量3.5 L/min,转速300 r/min,装液量1.2 L,发酵36 h。
以荞麦为原料,通过常温浸泡、加水打浆、联合耐高温α-淀粉酶的前处理方法,获得以荞麦为底物的发酵培养基。采用酶法制备大豆蛋白酶解产物,作为补充氮源添加至发酵培养基,通过优化纳豆菌液态发酵条件,可制备具有高纳豆激酶活力(152.5 FU/mL,与商业大豆蛋白胨组相比酶活力提高38%)、富含谷物多酚(0.109 mg/mL)且具有强抗氧化活性(27.43 μmol/mL)的发酵产物。
