乳酸片球菌AS1.2696来源的α-L-鼠李糖苷酶酶学性质分析
2019-03-11郭双双郑芳芳可丛雪王子龙韦宇拓黄日波杜丽琴
郭双双,郑芳芳,可丛雪,王子龙,韦宇拓,黄日波,杜丽琴*
(广西大学 亚热带农业生物资源保护与利用国家重点实验室,生命科学与技术学院,广西 南宁 530005)
鼠李糖苷酶以L-鼠李糖苷酶为主,L-鼠李糖苷酶又可分为α-L-鼠李糖苷酶(EC3.2.1.40)和β-L-鼠李糖苷酶(EC3.2.1.43)。α-L-鼠李糖苷酶可将α-鼠李糖苷键的非还原端水解[1],可以作用于α-1,2、α-1,3、α-1,4、α-1,6以及α-1连接的糖苷键[2],如柚皮苷[3-5]、新橙皮苷、柴胡皂苷C、橙皮苷[6]、芦丁[7]和槲皮苷等物质末端的α-L-鼠李糖基[8]。Lise等[9]从Novospingobium sp. PP1Y中得到一个对α-1,2、α-1,6均有较好水解效果的鼠李糖苷酶。
CAZY根据氨基酸序列的相似性和疏水簇分析,将α-L-鼠李糖苷酶划分为GH13、GH28、GH78和GH106家族[10]。目前报道较多的为GH78家族[10-13],GH78家族的α-L-鼠李糖苷酶大多来源于真菌(如曲霉属和青霉属等)[14]和细菌[15]。Ishikawa等[16]从Aspergillus oryzae中克隆得到的α-L-鼠李糖苷酶最适酶反应温度为70 ℃。来源于Aspergillus terreus的α-L-鼠李糖苷酶在温度为70 ℃时,仍具有较好的耐受性[17]。Li Lijun等[18]从Aspergillus niger JMU-TS528中发现1 株能够耐葡萄糖和乙醇的鼠李糖苷酶。Qian Siriguleng等[19]从新鲜牛肝中分离纯化分子质量大小为75 kDa的薯蓣皂苷-α-L-鼠李糖苷酶,该酶的最适酶反应pH值为7.0,最适温度为42 ℃,Mg2+对该酶具有激活作用。Birgisson等[15]从一种新型嗜热细菌中克隆了2 个α-L-鼠李糖苷酶并进行重组表达,研究证明两个重组酶RhmA和RhmB的分子质量大小为104 kDa和107 kDa,当温度达到70 ℃时2 个重组酶均具有较好的耐受性,RhmA和RhmB对对硝基苯基-α-L-吡喃鼠李糖苷(p-nitrophenyl-α-L-rhamnopyranoside,pNPR)的Km分别为 0.46 mmol/L和0.66 mmol/L,Vmax分别为134 U/mg和352 U/mg。这两个α-L-鼠李糖苷酶还能够水解α-1,2和α-1,6连接的β-D-葡萄糖苷。
α-L-鼠李糖苷酶具有广泛的应用价值与前景。在食品饮料方面,α-L-鼠李糖苷酶可水解柚皮苷,用于饮料果汁的脱苦[20-21],改善饮品的风味。在医药方面,通过水解柚皮苷来获得应用价值更广更好的普鲁宁[3,22-24];异槲皮素作为芦丁水解掉一个末端鼠李糖的产物,其相较于芦丁具有更好的医疗效果和利用率[25],如韩冰[26]、Gerstorferová[17]、Yadav[27]等分别得到中能够高效转化芦丁生成异槲皮素的重组菌株。其他水解活性的应用,α-L-鼠李糖苷酶还可应用于水解淫羊藿苷类物质,增加活性苷元的含量[28-29]。
本研究中乳酸片球菌(Pediococcus acidilactici)AS1.2696已经全基因组测序,通过对全基因组序列分析,查找到2 个注释为α-L-鼠李糖苷酶的基因序列。对这2 个基因序列进行比对,结果发现这两个基因序列的一致性为44.6%,编码蛋白质的序列一致性只有17.8%,一致性比较低,于是克隆表达菌株中的2 个α-L-鼠李糖苷酶基因,纯化目的蛋白,研究这2 个重组酶的酶学性质以及底物特异性,以期挖掘其在一些天然类底物的水解功能及潜在的应用价值。
1 材料与方法
1.1 材料与试剂
乳酸片球菌AS1.2696由本实验室保藏。
限制性内切酶 大连宝生物工程有限公司;质粒DNA小量提取试剂盒 北京BioFlux公司;Ni-NTA填料德国Qiagen公司;pNPR、4-硝基苯基-β-D-阿拉伯糖苷(4-nitrophenyl-β-L-arabinoside,pNPA)等对硝基苯基底物美国Sigma公司;柚皮苷、新橙皮苷 阿拉丁生化科技股份有限公司;橙皮苷、芦丁 生工生物工程(上海)股份有限公司;淫羊藿苷类物质、槲皮苷、杨梅苷、柴胡皂苷C 上海源叶生物科技有限公司。
1.2 仪器与设备
Biomertra T-Gradient Thermoblock聚合酶链式反应(polymerase chain reaction,PCR)仪 德国耶拿分析仪器股份公司;Centrifuge 5415D离心机 德国Eppendorf公司;G1314F-1260VWD高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Agilent公司;ZHWY-211B恒温摇床 上海精宏实验设备有限公司;恒温培养箱 德国Binder公司;JY92-2D超声波细胞破碎机 宁波新芝生物科技有限公司。
1.3 方法
1.3.1 α-L-鼠李糖苷酶基因prha2及prha3的克隆
从数据库中,查找到乳酸片球菌AS1.2696中含有2 个已经注释为鼠李糖苷酶的基因序列,分别将其命名为prha2及prha3。使用SMART软件分别对其编码的蛋白质结构组件进行分析,并使用SignalP4.1进行信号肽的预测。以pSE380为表达载体,设计含有6×His标签的引物,以乳酸片球菌AS1.2696的总DNA为模板,PCR扩增鼠李糖苷酶完整基因prha2及prha3。引物合成由上海生工生物工程有限公司完成,DNA测序由北京奥科鼎盛生物科技有限公司完成。
prha2基因扩增的引物:PA1-1:5’-ACGCCATGGA ACATCATCATCATCATCATATGGCATTTACATTTCA AATTAATG-3’(引入酶切位点NcoI,和组氨酸标签。加粗表示酶切位点,下划线表示组氨酸标签);PA1-2:5’-GGCGAGCTCCTAACTTAAATACTTTCTCATTA AG-3’(引入酶切位点SacI)。
prha3基因扩增的引物:PA2-1:5’-ACGCCATGG AACATCATCATCATCATCATATGAATCAAACTTATT GGATCTG-3’(引入酶切位点NcoI,和组氨酸标签);PA2-2:5’-GTCGAGCTCTCACGCAATGGGAATTACT ACGGPCR-3’(引入酶切位点SacI)。
反应程序:95 ℃、3 min;95 ℃、30 s,57.6 ℃、30 s,72 ℃、2 min,进行30 个循环;72 ℃、10 min。将PCR产物纯化并酶切处理后连接至经过同样酶切处理的pSE380表达载体,转化至大肠杆菌XL1-blue中经过测序。将成功构建的重组质粒分别命名为pSE-prha2、pSE-prha3。
1.3.2 重组酶PRHA2和PRHA3的诱导表达及纯化
将菌株于37 ℃培养,使菌液OD600nm达到0.4~0.6,再加入终浓度为0.5 mmol/L的异丙基-β-D硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)进行诱导,在最佳诱导条件下进行诱导一定时间后,离心收集菌体。超声波破胞后,通过镍亲和层析纯化重组酶PRHA2和PRHA3。并对纯化后的重组酶进行变性聚丙烯酰胺凝胶电泳。
1.3.3 重组酶PRHA2和PRHA3酶学性质分析
鼠李糖苷酶酶活力单位(U)的定义:在最适酶反应条件下,每分钟催化1 μmol底物(pNPR)转化为产物对硝基苯酚(p-nitrophenol,pNP)所需要的酶量。酶活力测定方法:酶标准反应体系是由缓冲液、底物、酶液组成200 μL体系,170 μL磷酸氢二钠-柠檬酸缓冲液、20 μL 10 mmol/L的pNPR先在最适酶反应温度下预热2 min,加入10 μL适当稀释的酶液,准确反应20 min后,加入50 μL 2 mol/L Na2CO3溶液终止酶反应。以不加酶的反应管为空白对照。混匀后取200 μL反应液至酶标板中,在405 nm波长下读取吸光度。
1.3.3.1 最适酶反应pH值的测定
在37 ℃条件下,测定不同pH值(3.0~8.0)的0.1 mol/L柠檬酸-0.2 mol/L磷酸氢二钠缓冲液对重组酶活力的影响,以最高活力为100%,计算在各个pH值下重组酶的相对活力,相对活力最高对应的pH值即为该酶的最适反应pH值。
1.3.3.2 最适酶反应温度的测定
在最适酶反应pH值条件下,测定酶在不同温度下(25~80 ℃)的酶活力,以最高活力为100%,计算各个温度下重组酶的相对活力,相对活力最高对应的温度即为该酶的最适反应温度。
1.3.3.3 重组酶的动力学常数测定
在最适酶反应条件下,测定酶在以0.1~9.0 mmol/L一系列不同浓度的pNPR为底物时的比活力,使用软件GraphPad Prism 5通过非线性回归分析拟合出重组酶的Km、Vmax值。
1.3.3.4 重组酶pH值稳定性的测定
将重组酶于4 ℃在一系列不同pH值的缓冲液中保存12 h,然后在最适反应条件下测定其残存酶活力,以保存在pH 7.0的磷酸氢二钠-磷酸二氢钠缓冲液中的纯酶活力为100%,计算各个pH值下重组酶的相对活力。
1.3.3.5 重组酶热稳定性的测定
将重组酶保存在一系列不同温度下1 h,立即取出放于冰上,在最适反应条件下测定其残存酶活力,以保存在冰箱4 ℃的纯酶活力为100%,计算各个温度下重组酶的相对活力。
1.3.3.6 化学试剂对酶活力的影响
在最适反应条件下,在反应体系中加入一定量的化学试剂(0.05 g/100 mL十二烷基硫酸钠、1%曲拉通(TritonX-100)、4 mol/L脲、0.01 mol/L咪唑、1%巯基乙醇、5%吐温-80),测定重组酶的残存酶活力。以不添加化学试剂的反应管酶活力为100%,计算各种化学试剂下酶的相对活力。
1.3.3.7 有机试剂对重组酶酶活力的影响
在最适反应条件下,在反应体系中分别添加体积分数5%~30%的醇类及有机溶剂(醇类:甲醇、乙醇、正丙醇、异丙醇、正丁醇、乙二醇、1,3-丙二醇;有机溶剂:二甲基甲酰胺(N,N-dimethylformamide,DMF)、二甲基亚砜(dimethyl sulfoxide,DMSO)、四氢呋喃、吡啶、乙腈),测定重组酶的残存酶活力。以不添加有机试剂的反应管酶活力为100%,计算各有机试剂下酶的相对活力。
1.3.3.8 酶底物特异性的测定
人工底物:取合适的底物浓度,以及适当稀释的酶液,在最适反应条件下进行酶活力的测定。以pNP或oNP的生成量来计算酶活力,以pNPR作为底物时的酶活力为100%。测定的底物包括pNPR、邻硝基苯-β-D-半乳糖苷(2-nitrophenyl-β-D-galactopyranoside,oNPG)、4-硝基苯基-β-D-吡喃半乳糖苷(p-nitrophenylβ-D-galactopyranoside,pNPGal)、对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,pNPG)、4-硝基苯基-α-D-葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,α-pNPG)、对硝基苯基-β-D-吡喃木糖苷(p-nitrophenyl-β-D-xylopyranoside,pNPX)、4-甲基伞形酮-β-D-葡糖苷酸(4-methylumbelliferylβ-D-glucuronide,MU-Glc)、4-硝基苯基-2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖苷(4-nitrophenyl-2-Acetamido-2-deoxy-β-D-glucopyranoside,pNPNAG)、4-硝基苯基-β-L-阿拉伯糖苷(4-nitrophenyl-β-L-arabinopyranoside,pNPA)、4-硝基苯基-β-D-纤维二糖苷(4-nitrophenyl-β-D-cellobioside,pNPC)。
二糖及糖苷类:以终质量浓度为1 g/100 mL的乳糖、纤维二糖、蔗糖、麦芽糖、异麦芽糖、海藻糖、苦杏仁苷、水杨苷分别作为底物,与纯酶在最适条件下反应测定酶活力。反应20 min后,煮沸终止5 min,利用葡萄糖氧化试剂盒测定反应管中葡萄糖的生成量,依次计算酶活力。
多糖类物质:以终质量浓度为1 g/100 mL的羧甲基纤维素钠、淀粉、蔗渣木聚糖、山毛榉木聚糖分别作为底物,与纯酶在最适条件下反应测定酶活力。反应6 h后,加入400 μL 3,5-二硝基水杨酸终止酶反应,煮沸反应管显色5 min。混匀后取200 μL反应液至酶标板中,于540 nm波长下读取吸光度。根据还原糖的生成量来计算酶活力。
其他底物特异性以终质量浓度为0.1 g/100 mL的柚皮苷、新橙皮苷、芦丁、橙皮苷、槲皮苷、杨梅苷、柴胡皂苷C分别作为底物,与纯酶在最适条件反应12 h后,煮沸终止5 min。用50%乙腈稀释10 倍,12 000 r/min离心30 min,取上清液利用HPLC分析反应产物。
对淫羊藿类物质的水解作用:以终质量浓度为100 μg/μL的淫羊藿苷、淫羊藿次苷I、宝藿苷I、朝藿定A、朝藿定B、朝藿定C分别作为底物,于纯酶在最适酶反应条件反应12 h后,煮沸终止5 min。用50%乙腈稀释3 倍,12 000 r/min离心30 min,取上清液利用HPLC分析反应产物。HPLC检测条件:安捷伦1260系列液相色谱仪,色谱柱:C18柱,进样量:10 μL,柱温:30 ℃,流速:1 mL/min,检测波长:270 nm。流动相:乙腈(A),水(B)。梯度洗脱:0~5 min,32% A;5~12 min,80% A;12~17 min,80% A;17~20 min,32% A;20~25 min,32% A。
1.3.4 重组酶的糖基转移活性的测定
糖类:以16 g/100 mL鼠李糖为鼠李糖基供体,20 g/100 mL的糖类或糖醇类为受体,加入重组酶反应12 h(PRHA2在55 ℃下反应,PRHA3在40 ℃下反应),煮沸5 min终止酶反应,12 000 r/min离心30 min,HPLC检测反应产物。HPLC检测条件:示差折光检测器;色谱柱:NH2柱;进样量:20 μL;流速:1 mL/min;流动相:70%乙腈,等度洗脱。
醇类:以16 g/100 mL鼠李糖为鼠李糖基供体,分别以10%的乙醇、正丙醇、异丙醇、丁醇,15%的甲醇和20%的乙二醇、1,2-丙二醇、1,3-丙二醇、2,3-丁二醇、丙三醇为受体,加入重组酶反应12 h(PRHA2在55 ℃下反应,PRHA3在40 ℃下反应),煮沸5 min终止酶反应,12 000 r/min离心30 min, HPLC检测反应产物。HPLC检测条件:示差折光检测器;色谱柱:NH2柱;进样量:20 μL;流速:1 mL/min;流动相:83%乙腈,等度洗脱。
长链醇类:在重组酶的最适反应pH值条件下,以鼠李糖作为鼠李糖基供体,己醇、辛醇、壬醇、癸醇分别作为糖基受体,与纯酶在摇床220 r/min反应12 h后,煮沸终止5 min。12 000 r/min离心30 min,取有机相利用HPLC分析反应产物(体系:2.4 mL长链醇+150 μL 40 g/100 mL的鼠李糖+150 μL缓冲液+150 μL酶液)。HPLC检测条件:蒸发光检测器;色谱柱:C18柱,进样量:20 μL,流速:0.8 mL/min;流动相:75%甲醇,等度洗脱。
烷基糖苷类:在重组酶的最适反应pH值条件下,以16 g/100 mL鼠李糖作为鼠李糖基供体,1 g/100 mL的己基-β-D-葡萄糖苷、庚基-β-D-葡萄糖苷、n-辛基-β-D-葡萄糖苷、壬基-β-D-葡萄糖苷、癸基-β-D-葡萄糖苷分别作为糖基受体,与纯酶反应12 h后,煮沸终止5 min。用超纯水分别稀释20 倍和100 倍,12 000 r/min离心30 min,取上清液利用HPLC分析反应产物。HPLC检测条件:蒸发光检测器;色谱柱:C18柱;进样量:20 μL;流速:0.8 mL/min;流动相:75%甲醇,等度洗脱。
咖啡酸:在重组酶的最适反应pH值条件下,以16 g/100 mL鼠李糖作为鼠李糖基供体,1 g/100 mL咖啡酸作为糖基受体,与纯酶反应12 h后,煮沸终止5 min。用50%乙腈稀释10 倍,12 000 r/min离心30 min,取上清液利用HPLC分析反应产物。HPLC检测条件:色谱柱:C18柱;进样量:10 μL;柱温:30 ℃;流速:1 mL/min;检测波长:327 nm;流动相:乙腈(A),2%乙酸溶液(B);等度洗脱:A∶B=85∶15(V/V)。
苯甲酸:在重组酶的最适反应pH值条件下,以16 g/100 mL鼠李糖作为鼠李糖基供体,0.5 g/100 mL苯甲酸作为糖基受体,与纯酶反应12 h后,煮沸终止5 min。用50%乙腈稀释50 倍,12 000 r/min离心30 min,取上清液利用HPLC分析反应产物。HPLC检测条件:色谱柱:C18柱,进样量:10 μL;流速:1 mL/min;检测波长:230 nm;流动相:甲醇(A),20 mmol/L乙酸铵(B);等度洗脱:A∶B=5∶95(V/V)。
1.4 数据及图像处理
重组酶的酶学性质数据采用GraphPad Prism 5进行处理,动力学常数使用软件GraphPad Prism 5通过非线性回归分析拟合出重组酶的Km、Vmax值。图像采用Microsoft Office Visio 2003进行处理。
2 结果与分析
2.1 AS1.2696中prha2及prha3鼠李糖苷酶基因的克隆
2.1.1 α-L-鼠李糖苷酶基因prha2及prha3的序列分析
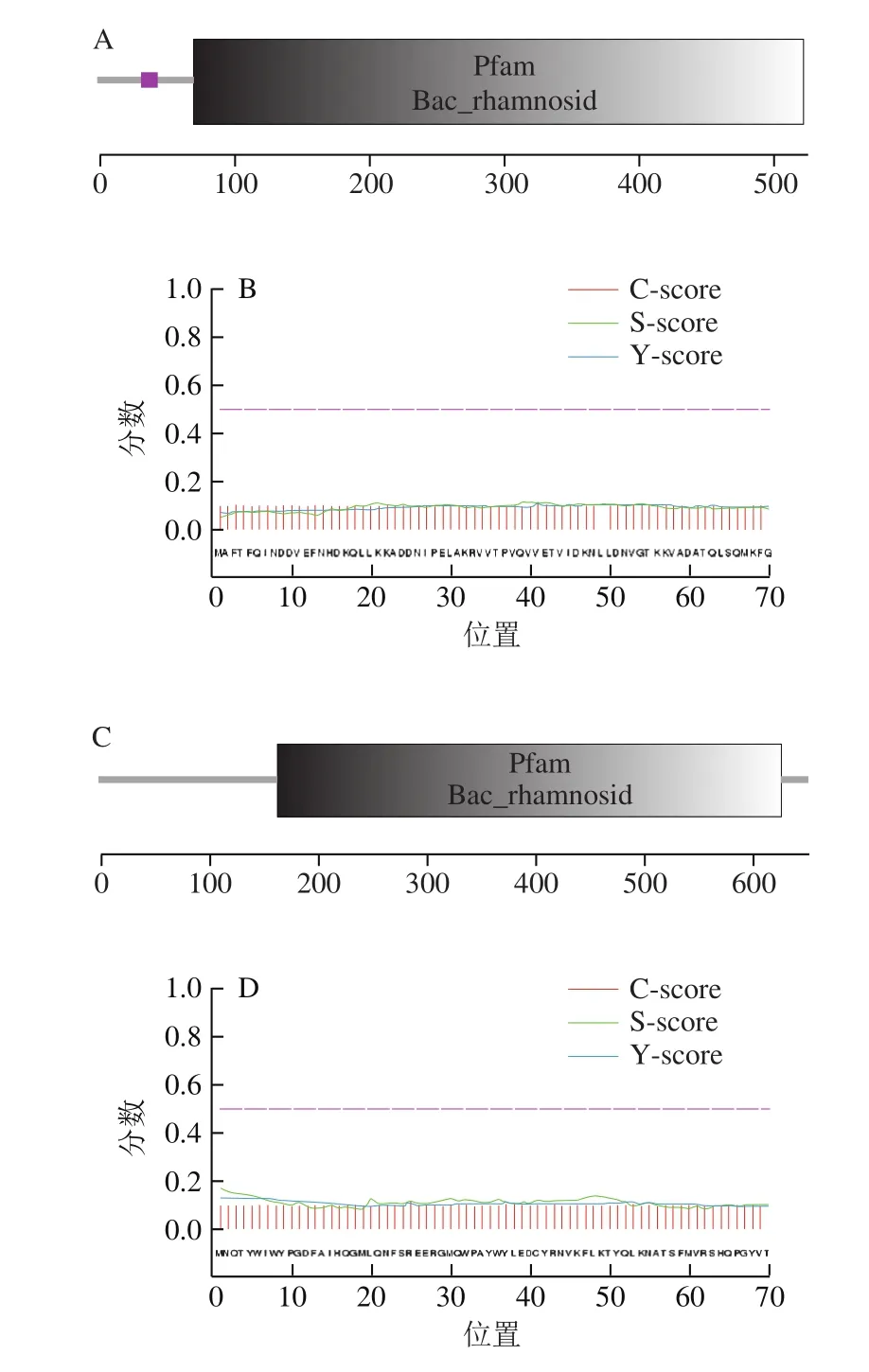
图1 PRHA2和PRHA3的蛋白质结构组件及信号肽分析Fig. 1 Analysis of protein domains and signal peptide sequences in PRHA2 and PRHA3
本研究从实验室保存的1 株已经完成基因组测序的乳酸片球菌AS1.2696出发,分析其基因组数据,从中查找到两个被注释为α-L-鼠李糖苷酶的开放阅读框(open reading frame,ORF)。其中一个的ORF全长1 578 bp,由ATG起始TAG终止,编码了一个长度为525 个氨基酸的蛋白质。将该ORF命名为prha2,将其编码的蛋白质命名为PRHA2。对PRHA2的蛋白质结构组件进行SMART分析,PRHA2含有一个low complexity功能域和一个Bac_rhamnosid功能域(图1A)。同时,结合SignalP4.1进行信号肽分析,表明PRHA2不含信号肽序列(图1B)。对PRHA2进行理化参数的计算,结果显示PRHA2的理论分子质量为60 460.84 Da,理论等电点pI为5.05。
另一个ORF全长1 962 bp,由ATG起始TGA终止,编码了一个长度为653 个氨基酸的蛋白质。将该ORF命名为prha3,将其编码的蛋白质命名为PRHA3。对PRHA3的蛋白质结构组件进行SMART分析,PRHA3含有一个Bac_rhamnosid功能域(图1C)。同时,结合SignalP4.1分析信号肽,表明PRHA3不含信号肽序列(图1D)。对PRHA3进行理化参数的计算,结果显示PRHA3的理论分子质量为75 959.45 Da,理论等电点pI为6.10。
2.1.2 α-L-鼠李糖苷酶基因prha2及prha3的克隆和重组表达
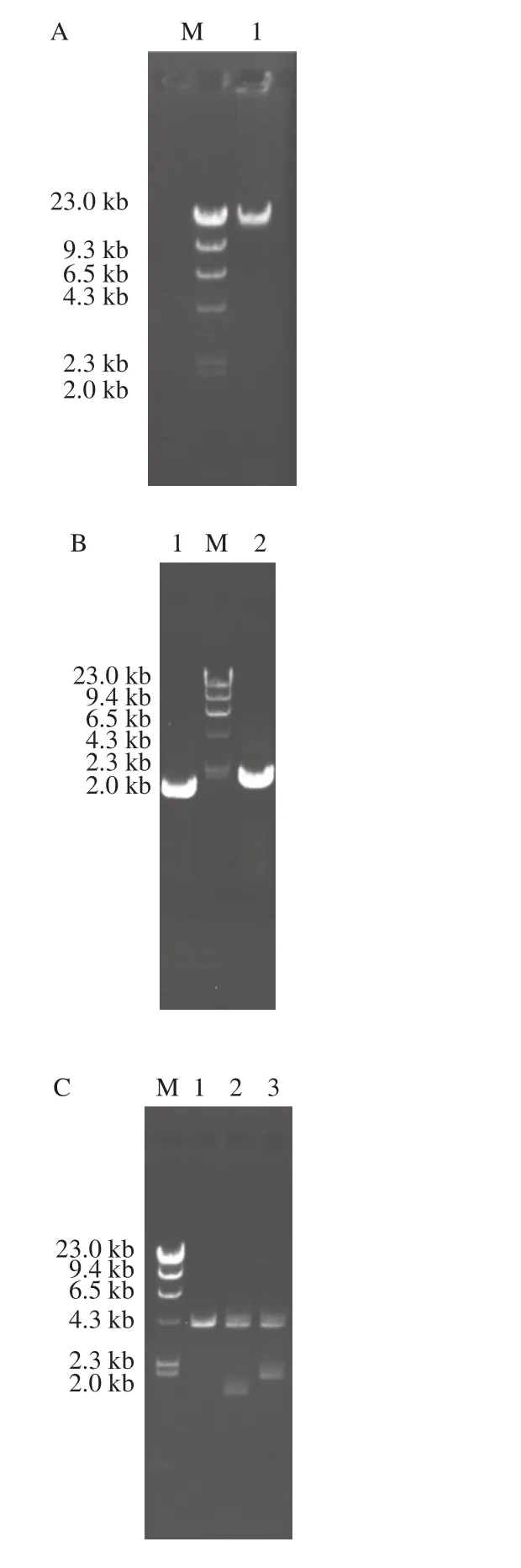
图2 琼脂糖凝胶电泳分析Fig. 2 Agarose gel electrophoresis analysis
提取菌株乳酸片球菌AS1.2696的总DNA,琼脂糖凝胶电泳检测,结果如图2A所示。以pSE380为表达载体,设计含有6×His标签的引物,以AS1.2696的总DNA为模板,PCR扩增基因prha2及prha3。电泳检测后,结果如图2B所示,分别成功扩增到一条约为1.5 kb及1.9 kb的DNA条带,片段大小与预期相符。
目的基因经用NcoI和SacI双酶切后与同样经NcoI和SacI双酶切的pSE380载体连接,构建重组质粒pSE-prha2及pSE-prha3。将连接产物转化大肠杆菌(Escherichia coli)XL1-Blue,提取质粒,用NcoI和SacI双酶切处理质粒。结果如图2C所示,重组质粒pSE-prha2及pSE-prha3双酶切后产生两条带,与预期大小相符,表明目的基因prha2及prha3已经连入载体pSE380。
2.1.3 重组酶PRHA2和PRHA3的诱导表达和纯化
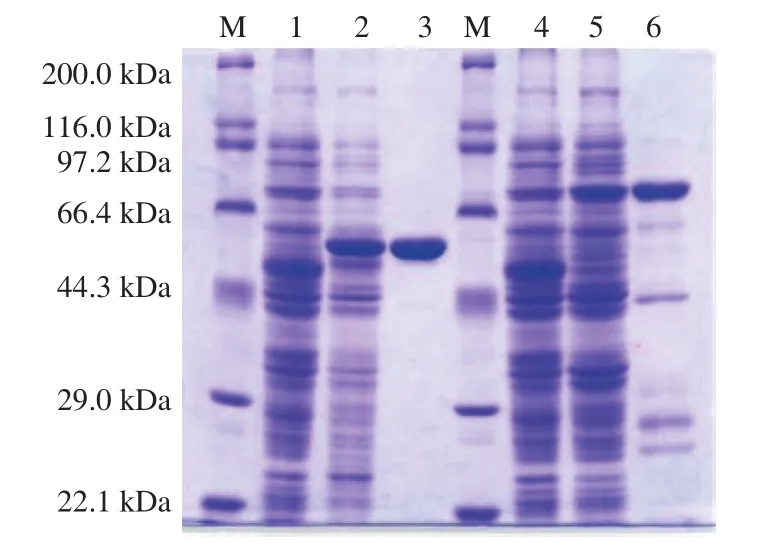
图3 纯化产物的聚丙烯酰胺电泳分析Fig. 3 SDS-PAGE analysis of purified PRHA2 and PRHA3
由图3可知,相较于对照菌株,诱导后的重组菌株分别在预期大小处出现明显的蛋白质特征性条带,且纯化后的蛋白质溶液在相应位置也出现蛋白质特征性条带,表明成功表达且纯化到目的蛋白质PRHA2和PRHA3。纯化后的蛋白条带较为明显,可用于下一步的研究。
2.2 PRHA2和PRHA3基本酶学性质的鉴定
2.2.1 PRHA2和PRHA3最适反应pH值
结果表明,PRHA2的最适酶反应pH值为5.0(图4A),PRHA3的最适酶反应pH值为5.5(图4B)。
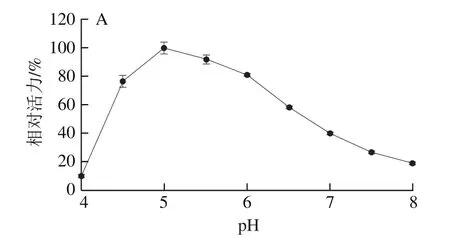
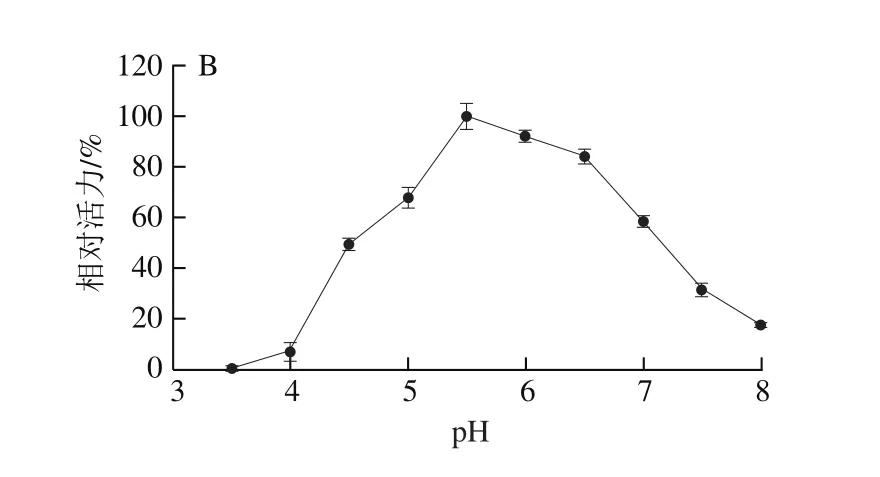
图4 pH值对PRHA2(A)和PRHA3(B)酶活力的影响Fig. 4 Effect of pH on the activity of PRHA2 (A) and PRHA3 (B)
2.2.2 PRHA2及PRHA3最适反应温度
结果表明,PRHA2的最适酶反应温度为60 ℃(图5A),PRHA3的最适酶反应温度为45 ℃(图5B)。
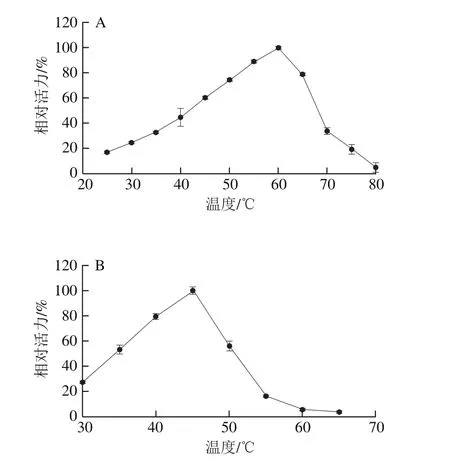
图5 温度对PRHA2(A)和PRHA3(B)酶活力的影响Fig. 5 Effect of temperature on the activity of PRHA2 (A) and PRHA3 (B)
2.2.3 PRHA2及PRHA3 pH值稳定性
在pH 5.5~8.0的缓冲液内4 ℃放置12 h后,重组酶PRHA2活力仍保持在80%以上,说明在此范围内该酶具有较好的pH值稳定性(图6A);在pH 4.0~8.5的缓冲液内4 ℃放置12 h后,重组酶PRHA3活力仍保持在80%以上,说明在此范围内该酶具有较好的pH值稳定性(图6B)。
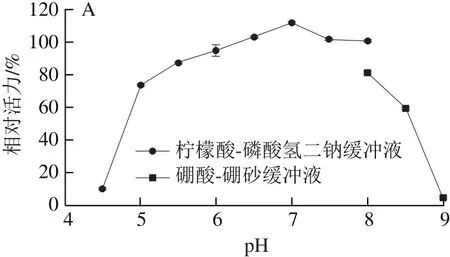
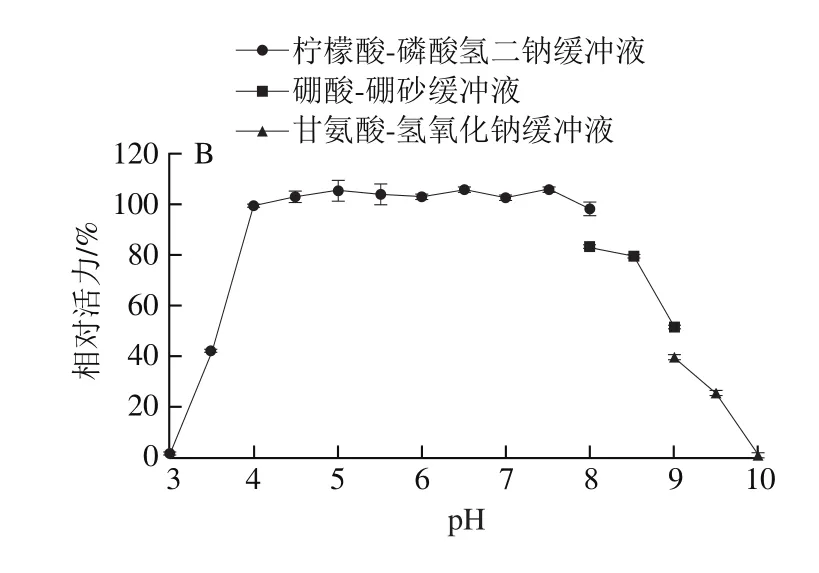
图6 PRHA2(A)和PRHA3(B)的pH值稳定性Fig. 6 pH stability of PRHA2 (A) and PRHA3 (B)
2.2.4 PRHA2及PRHA3温度稳定性
在温度25~45 ℃的温度范围保温1 h后,重组酶PRHA2活力仍保持在80%以上,说明在此范围内该酶具有较好的温度稳定性(图7A)。在25~35℃的温度范围保温1 h后,重组酶PRHA3活力仍保持在80%以上,说明在此范围内该酶具有较好的温度稳定性(图7B)。
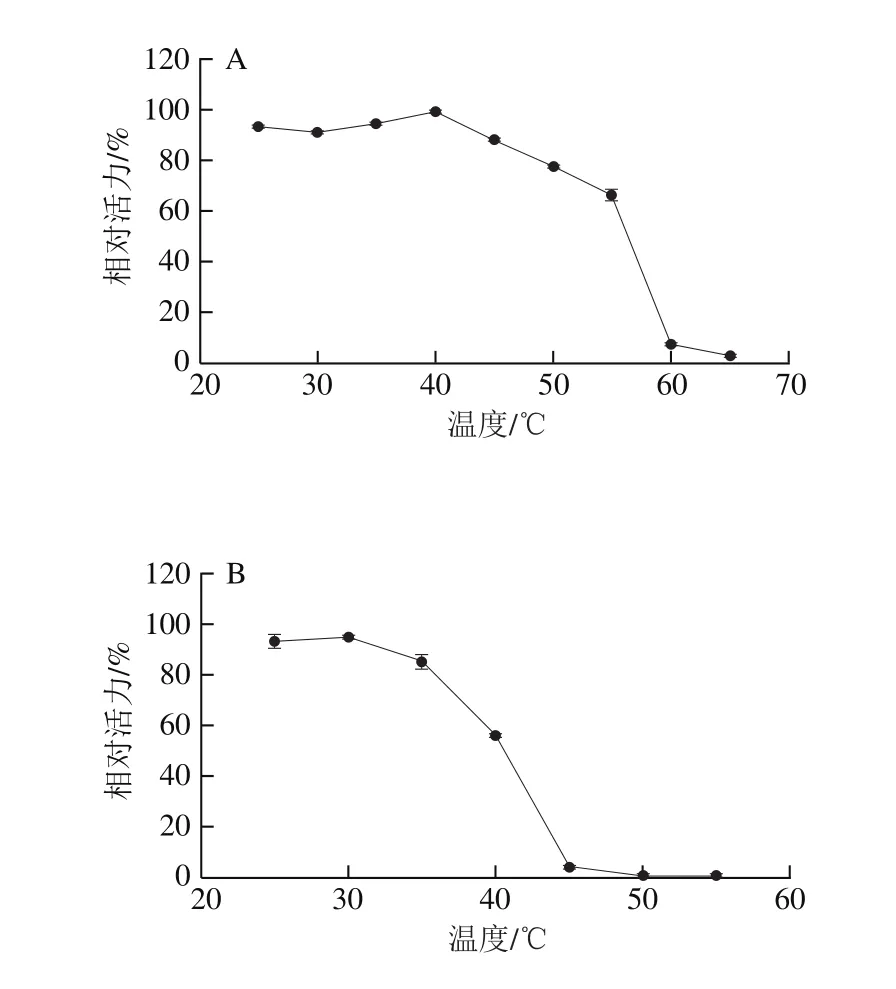
图7 PRHA2(A)和PRHA3(B)热稳定性Fig. 7 Thermal stability of PRHA2 (A) and PRHA3 (B)
2.2.5 PRHA2及PRHA3的动力学常数
分别测定PRHA2(pH 5.0、60 ℃)及PRHA3(pH 5.5、45 ℃)在以0.1~9 mmol/L不同浓度的pNPR为底物时的酶活力(每个浓度做3 个重复)。利用软件GraphPad Prism 5通过非线性回归拟合出PRHA2的Km和Vmax值分别为(3.039±0.581)mmol/L和(2.032±0.186)μmol/(min·mg)(图8A)。PRHA3的Km和Vmax值分别为(2.797±0.132)mmol/L和(113.35±1.485)μmol/(min·mg)(图8B)。
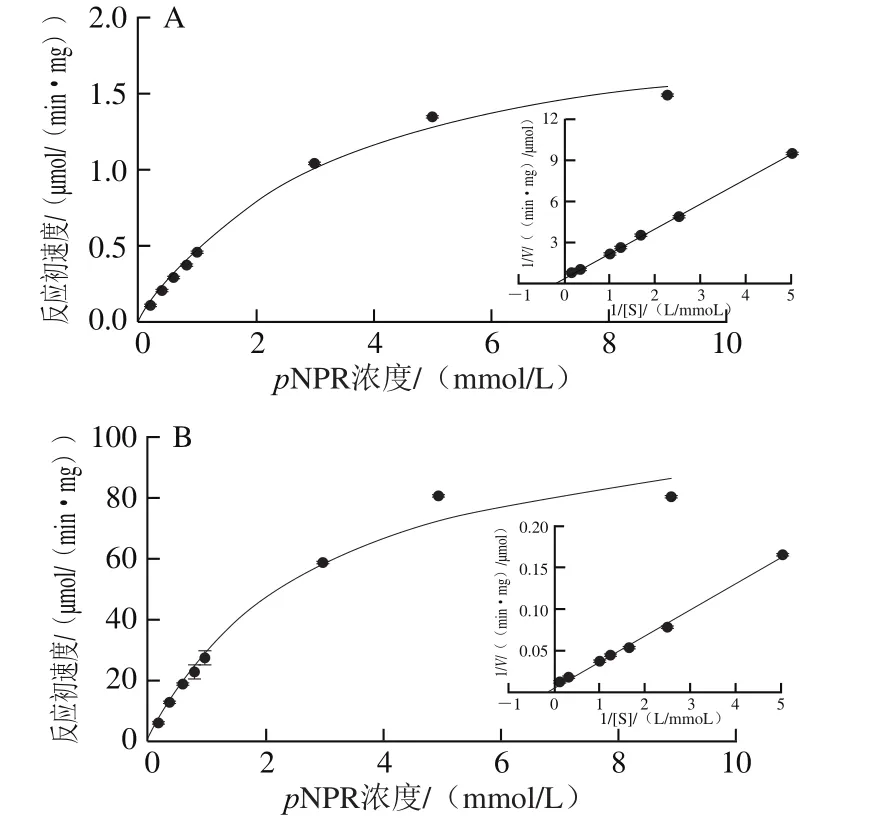
图8 PRHA2(A)和PRHA3(B)的Km和Vmax值Fig. 8 Determination of Km and Vmax of PRHA2 (A) and PRHA3 (B)
2.2.6 化学试剂对PRHA2及PRHA3酶活力的影响
0.05 g/100 mL十二烷基硫酸钠和4 mol/L脲能够强烈抑制PRHA2,1% TritonX-100及0.01 mol/L 咪唑对PRHA2略有抑制作用,5%吐温-80和1%巯基乙醇对PRHA2有较强的抑制作用(图9A)。0.05 g/100 mL十二烷基硫酸钠和4 mol/L脲能够使PRHA3失活,1% TritonX-100对PRHA3酶活力影响不大,0.01 mol/L咪唑、5%吐温-80和1%巯基乙醇对PRHA3有不同程度的抑制作用(图9B)。
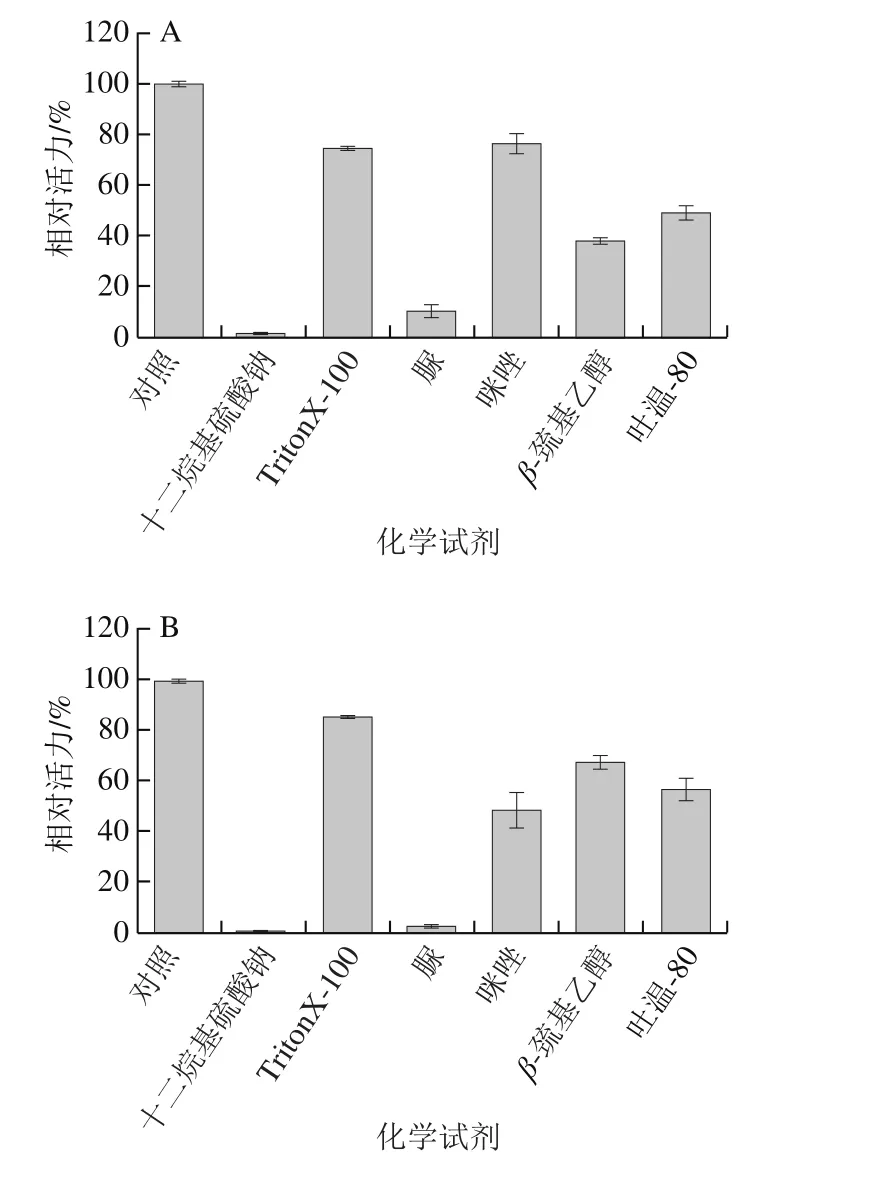
图9 化学试剂对PRHA2(A)和PRHA3(B)酶活力的影响Fig. 9 Effects of chemical reagents on the activity of PRHA2 (A) and PRHA3 (B)
2.2.7 有机试剂对PRHA2及PRHA3酶活力的影响
整体上看,各种有机试剂对PRHA2均有一定的抑制作用,且抑制程度与添加量相关,添加量越高,对PRHA2的抑制作用越强(图10A~C)。另外,乙二醇对PRHA2酶活力的抑制不强,在添加量为10%时仍保持有40%左右的酶活力;而其他几种有机试剂对PRHA2酶活力的抑制较为明显。随着有机溶剂的添加量增大,其对PRHA2的抑制作用越强,这几种有机溶剂对PRHA2有强烈的抑制作用。
整体上看,各种有机试剂对PRHA3均有一定的抑制作用,且抑制程度与添加量相关,添加量越高,对PRHA3的抑制作用越强(图10D~F)。另外,乙二醇及1,3-丙二醇对PRHA3酶活力的抑制不强,在添加量为20%时仍保持有40%左右的酶活力;而其他几种有机试剂对PRHA3酶活力的抑制较为明显。随着有机溶剂的添加量增大,其对RHA3的抑制作用越强且这几种有机溶剂对PRHA3的抑制作用较强。
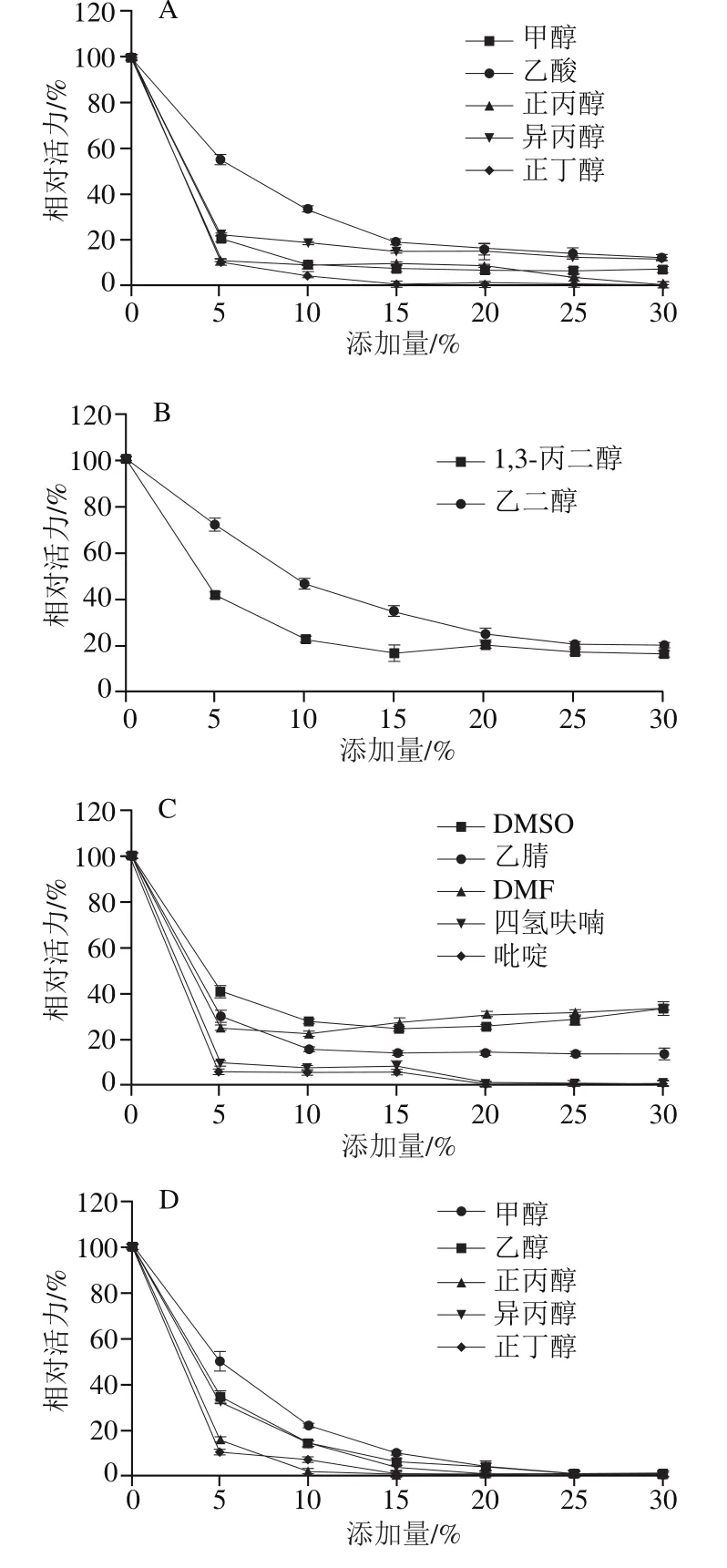
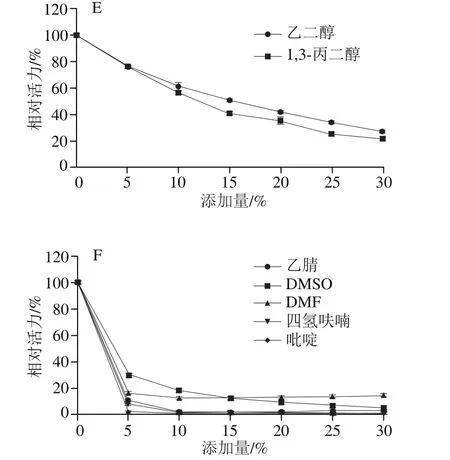
图10 有机试剂对PRHA2及PRHA3酶活力的影响Fig. 10 Effects organic reagents on the activity of PRHA2 and PRHA3
2.2.8 PRHA2及PRHA3的底物特异性分析
从表1可以发现,PRHA2对pNPA有一定的水解活性,对其他芳香类糖苷底物及二糖底物没有活性或仅有微弱活性。PRHA3这些芳香类糖苷底物及二糖底物没有活性或仅有微弱活性。
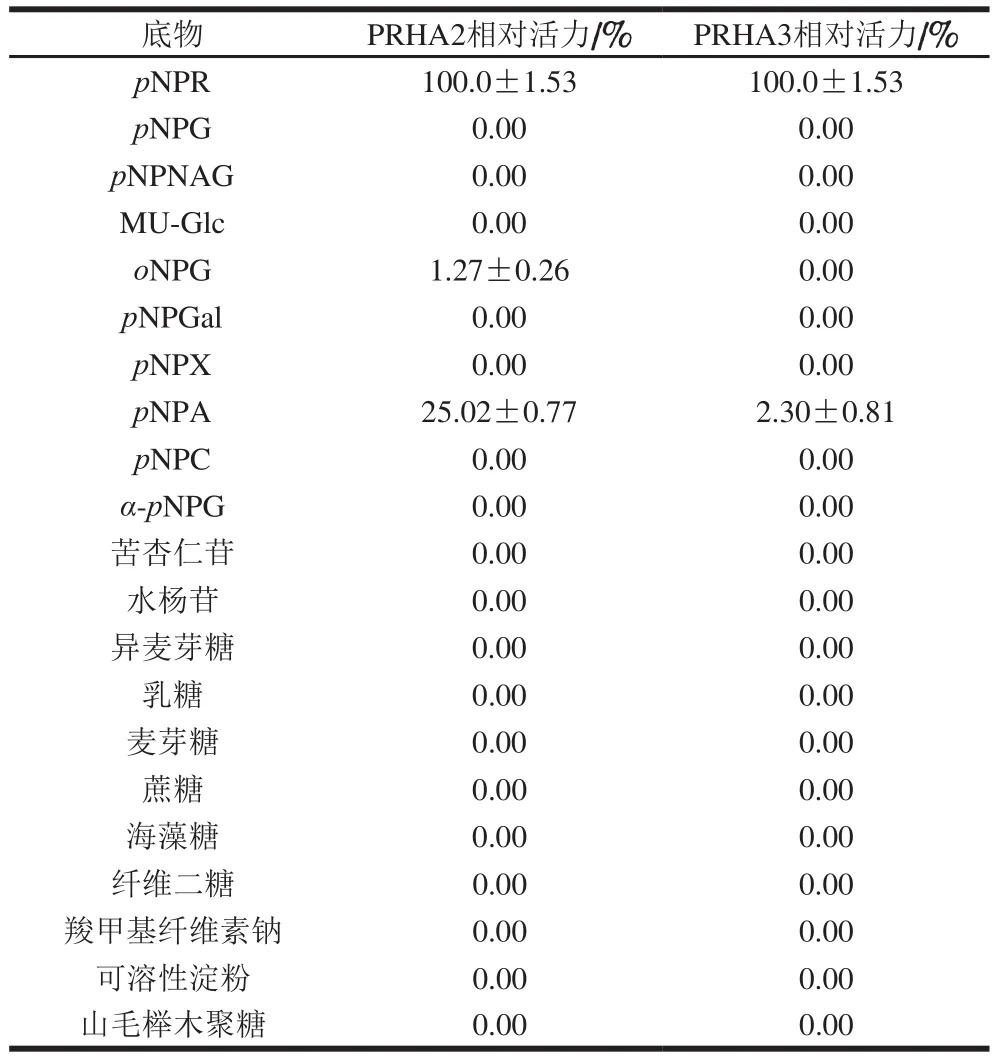
表1 重组酶PRHA2及PRHA3的底物特异性Table 1 Substrate specificity of PRHA2 and PRHA3
2.2.9 其他底物水解特异性分析
表2结果表明,两种重组酶均只能水解橙皮苷及芦丁,这两种物质均为β-Glc-(6→1)-α-Rha糖苷键的物质。

表2 重组酶PRHA2和PRHA3的底物特异性Table 2 Substrate specificity of PRHA2 and PRHA3
2.2.10 重组酶对淫羊藿类物质的水解作用
从表3可看出,PRHA2对淫羊藿类物质均没有水解作用。PRHA3对淫羊藿苷、淫羊藿次苷I、朝藿定A、朝藿定B、朝藿定C这几种物质C-7位的葡萄糖糖苷键有较弱的水解作用。值得注意的是,PRHA3能够水解朝藿定C的C-3位以α-Rha(2→1)α-Rha外侧的鼠李糖糖苷键,即PRHA3能够水解以α-Rha(2→1)α-Rha外侧的鼠李糖糖苷键,但不能水解以β-Glc(2→1)-α-Rha外侧的鼠李糖糖苷键。

表3 重组酶PRHA2、PRHA3作用于淫羊藿类物质的底物特异性Table 3 Substrate specificity of PRHA2 and PRHA3 toward icariins
2.3 重组酶的糖基转移活性
以16 g/100 mL鼠李糖为鼠李糖基供体,HPLC分析转糖苷反应产物发现,PRHA2分别以葡萄糖、纤维二糖为受体的转糖苷反应产物中,检测到低含量的转糖苷产物。PRHA3分别以半乳糖、乳糖为受体的转糖苷反应产物中,检测到低含量的转糖苷产物。PRHA2在以鼠李糖为鼠李糖基供体,以己基-β-D-吡喃葡萄糖苷、庚基-β-D-吡喃葡萄糖苷、n-辛基-β-D-吡喃葡萄糖苷为受体的转糖苷反应产物中,检测到低含量的转糖苷产物,表明重组酶PRHA2对以上化合物具有转糖苷功能。PRHA2和PRHA3在以鼠李糖为鼠李糖基供体,各类短碳链的醇基糖醇类物质、长链醇类、咖啡酸、苯甲酸为受体的转糖苷反应产物中,均未检测到转糖苷产物。
3 结论与讨论
从乳酸片球菌AS1.2696中扩增得到2 个α-L-鼠李糖苷酶基因prha2和prha3,其基因大小分别为1 578 bp、1 962 bp,分别编码525 个和653 个氨基酸。以pSE380为表达载体在E. coliXL1-blue中表达目的基因,通过镍亲和层析纯化重组蛋白,测定重组酶的酶学性质。
PRHA2的最适pH值和最适温度分别为5.0和60 ℃;PRHA3的最适pH值和最适温度分别为5.5和45 ℃。两个重组酶的最适酶反应pH值均偏酸性,与大多数鼠李糖苷酶一致,酶的最适pH值为4~7,少数pH值大于7;最适酶反应温度差异较大,多数在40~60 ℃之间,少数在70 ℃或以上[1,17-18,27,30-34]。两个重组酶虽然来自同一个菌株,但其最适酶反应温度差异较大。PRHA2的Km值为(3.039±0.581)mmol/L,Vmax值为(2.032±0.186)μmol/(min·mg);PRHA3的Km值为(2.797±0.132)mmol/L,Vmax值为(113.35±1.485)μmol/(min·mg)。各种化学试剂和有机试剂对两个重组酶均有不同程度的抑制作用。
对PRHA2和PRHA3的底物特异性进行研究,发现PRHA2和PRHA3不仅能够水解人工底物pNPR,还能够水解α-1,6键的天然底物橙皮苷、芦丁;PRHA3还能够水解朝藿定C。除此之外,重组酶还具有较弱的转糖苷功能,α-L-鼠李糖苷酶催化糖苷键的合成,在合成烷基糖苷、低聚寡糖等方面具有潜在的价值[35]。
橙皮苷在水中几乎不溶,水解橙皮苷,生成橙皮素葡萄糖苷和鼠李糖,而橙皮素葡萄糖苷是天然的甜味剂前体物。芦丁在药理作用和吸收效果等方面也不如其水解产物异槲皮素,本研究中,PRHA2和PRHA3对橙皮苷和芦丁具有较好的水解能力,两个重组酶对芦丁的催化效率高于橙皮苷,且PRHA3对芦丁和橙皮苷的催化效率高于PRHA2。
淫羊藿的主要成分包括黄酮类化合物、木脂素、生物碱、挥发油等,其中黄酮类化合物主要包括淫羊藿苷、朝藿定A、朝藿定B、朝藿定C等。而PRHA3能够水解淫羊藿中的朝藿定C的C-3位以α-Rha(2→1)α-Rha连接的外侧的鼠李糖,从而生成淫羊藿苷,目前尚鲜有文献报道有α-L-鼠李糖苷酶水解朝藿定C制备淫羊藿苷。淫羊藿苷相较于朝藿定C更容易被人体吸收,而且淫羊藿苷及其进一步的水解产物在抗肿瘤方面具有重要作用[36],其苷元脱水淫羊藿素目前已进入临床研究阶段。根据重组酶对淫羊藿类物质的水解结果发现,PRHA3能够水解以α-Rha(2→1)α-Rha连接的外侧的鼠李糖,但不能水解以β-Glc(2→1)-α-Rha连接的外侧的鼠李糖,可针对这一特点进一步研究PRHA3水解糖苷键的成键方式。
与其他糖苷酶相比,鼠李糖苷酶的分子结构及其功能了解仍有很多不足,本研究构建的2 个α-L-鼠李糖苷酶均来自乳酸片球菌AS1.2696,但重组酶PRHA2和PRHA3的基本酶学性质、底物特异性等各方面的差异均较大,丰富了α-L-鼠李糖苷酶的资源。
