氧脂素对赭曲霉孢子产生、赭曲霉毒素A合 成及粮食受侵染程度的影响
2019-03-11李彩艳李可馨彭梦雪梁志宏
高 婧,李彩艳,2,李可馨,彭梦雪,梁志宏,*
(1.中国农业大学 北京食品营养与人类健康高精尖创新中心,食品科学与营养工程学院,北京 100083;2.河南省食品药品审评查验中心,河南 郑州 450000)
赭曲霉(Aspergillus ochraceus)是一种广泛分布于粮食和饲料中的丝状真菌,可以产生有害次级代谢产物赭曲霉毒素。目前已发现超过20 种赭曲霉毒素,其中赭曲霉毒素A(ochratoxins A,OTA)分布最广、危害最大[1]。OTA广泛污染谷物、豆类、葡萄、咖啡等农副产品[2],可以引起人类和动物的肝脏、肾脏损伤,并有致畸、致突变、致癌和免疫抑制作用[3],被国际癌症研究机构列为2B类致癌物,在已知的真菌毒素中,OTA的危害性仅次于黄曲霉毒素[4]。中国、美国、加拿大、澳大利亚、日本、韩国等国家,以及国际食品法典委员会和欧盟等国际组织发布的有关食品中真菌毒素法规中都对OTA的限量标准做出了要求[5]。
近年来在荚膜组织胞浆菌(H i s t o p l a s m a capsulatum)[6]、构巢曲霉(Aspergillus nidulans)[7]、黄曲霉(Aspergillus flavus)[8]等真菌中发现,真菌能够通过群体感应信号调控机制,调节其生长发育和真菌毒素产生。群体感应是微生物调节群体行为的信号交流机制,微生物可以生产特定的小分子物质(成为群体感应信号分子)并分泌到胞外,当胞外信号分子在局部环境中积累达到一定的水平时,可以进入其他微生物细胞内激活特定基因的表达,从而调控菌群生理功能,以适应周围环境的改变[9-10]。群体感应机制在细菌中十分普遍,细菌通过群体感应机制控制其群体行为,如生物发光、毒力因子分泌和生物膜的形成等,从而在种群竞争中占据优势[9]。霉菌中也存在类似于细菌群体感应的密度调节机制,黄曲霉[11]及赭曲霉[12]在侵染脂肪酸含量高的作物时更容易产生毒素,这表明脂肪酸类物质及其代谢产物可能参与了真菌群体感应的调控。
真菌中已发现的群体感应信号分子主要有氧脂素、法尼醇、γ-丁内脂[10],其中氧脂素是多不饱和脂肪酸通过酶促或非酶促反应加氧产生的一类脂氧合物,是霉菌、酵母菌、植物和动物信号转导途径的重要信号分子,可以调节真菌的无性和有性发育之间的平衡,影响真菌毒素的合成[13]。植物来源的亚油酸氧化产物如羟基十八碳二烯酸(hydroxyoctadecaenoic acid,HODE)、氢过氧化十八碳二烯酸(hydroperoxyoctadecadienoic a c i d,H P O D E)和氢过氧化十八碳三烯酸(hydroperoxyoctadecatrienoic acid,HPOTE)等可以影响黄曲霉和构巢曲霉的营养生长、分生孢子、菌核的形成及真菌毒素的合成[14-15]。13S-HPODE和13S-HPOTE可以抑制黄曲霉毒素合成,9S-HPODE能够促进黄曲霉毒素合成[16],13S-HPODE可以促进分生孢子的产生而9S-HPODE可以促进子囊孢子的产生[17]。随着群体密度的增加,黄曲霉逐渐实现从菌核到分生孢子的转换,而当敲除黄曲霉的脂氧化酶基因lox后菌体不能正常产生氧脂素,当孢子接种密度大于105个/mL时菌核数目增加而分生孢子数目减少[18]。与黄曲霉类似,氧脂素也可以调节赭曲霉的形态和毒素产生,赭曲霉AoloxA基因产物脂氧合酶能够催化亚油酸发生加氧反应,生成脂过氧化物9S-HODE和13S-HODE,影响赭曲霉形态及OTA的合成,Reverberi等[19]的实验结果显示,当敲除赭曲霉菌株的lox基因后,与野生型相比,突变的Delta AoloxA菌株氧脂素水平降低,形成的分生孢子数减少,菌核数目增加,OTA合成受到抑制。Punelli等[20]使用水杨基异羟肟酸和白藜芦醇(一种脂氧合酶抑制剂)作用于赭曲霉菌株,发现脂肪氧合酶活性的降低导致OTA产量明显减少,Antonioletti等[21]证明了能够控制OTA生物合成的化合物也显着抑制lox的活性。说明氧脂素在控制赭曲霉OTA生物合成中起主要作用。
赭曲霉的生长发育和OTA合成受到群体密度调控[12],但具体的群体感应信号分子及其调控机制尚不明确,氧脂素可能是赭曲霉的群体感应信号分子之一。因此本实验拟探究氧脂素9S-HODE和13S-HODE是否为赭曲霉群体感应信号分子及其对赭曲霉生长发育和OTA合成的作用,旨在阐明氧脂素在赭曲霉生长发育和毒素产生中所起的作用,丰富赭曲霉的毒素合成调控机理研究。
1 材料与方法
1.1 材料与试剂
赭曲霉AS3.4412购自中科院微生物所,-80 ℃超低温冰箱保存;小麦产自河南省洛阳市;玉米产自河南省焦作市;花生产自吉林省辽源市;大豆产自黑龙江省绥化市。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基 北京索莱宝科技有限公司;赭曲霉毒A残留酶联免疫试剂盒 北京勤邦生物技术有限公司;吐温20国药集团化学试剂有限公司;乙腈(色谱纯) 美国J.T.Baker化学试剂有限公司;甲醇(色谱纯) 中国赛默飞世尔科技有限公司;甲酸(色谱纯) 北京化工厂;9S-HODE、13S-HODE 美国Cayman化学公司。
1.2 仪器与设备
Multiscan Ascent酶标仪 美国Thermo公司;恒温培养箱 上海福玛实验设备有限公司;5804R低温高速离心机 德国Eppendorf公司;普通光学显微镜 南宁松景天伦生物科技有限公司;ALPHA 1-2 LD plus冷冻干燥机 德国Christ公司;SANYO MLS-3750高压蒸汽灭菌锅 江苏省科学器材有限公司;1200-6410B高效液相色谱-质谱联用仪 美国Agilent公司;TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 赭曲霉在不同孢子接种密度下的液体培养
赭曲霉AS3.4412菌株活化后选取长势较好的菌落,挑取少许菌丝,接种在PDA培养皿的中央,于霉菌培养箱28 ℃倒置培养6 d后,可观察到PDA培养皿表面长满赭色孢子,将孢子刮下置于0.9% NaCl(含0.01%吐温20)中,纱布过滤后取孢子滤液。血球计数板计数后将孢子密度稀释至107个/mL和104个/mL,取2.5 mL孢子悬液分别加入22.5 mL PDB培养基中,使得PDB液体培养基中孢子的最终密度分别为106个/mL和103个/mL,于28 ℃摇床培养,分别在培养的3、4、5、6 d取样测定9S-HODE、13S-HODE和OTA含量。
1.3.2 赭曲霉PDA培养皿中氧脂素的添加
打孔器裁下直径1 cm的圆形滤纸片后灭菌,将9S-HODE和13S-HODE标准品用乙醇稀释,终质量浓度1 µg/mL,0.22 µm有机滤膜过滤除菌后浸透滤纸片,待其干燥后铺在接种了赭曲霉孢子的平板中央。添加氧脂素的赭曲霉PDA培养皿于28 ℃培养6 d,观察赭曲霉菌落形态,之后以滤纸片为中心,将滤纸片周围直径为3 cm范围内的赭曲霉孢子刮下计数;另以滤纸片为中心,将滤纸片周围直径为3 cm范围内的培养基取出,提取培养基中的OTA测定含量。
1.3.3 赭曲霉中氧脂素含量的测定
PDB液体培养基中分离赭曲霉菌丝球,于-80 ℃冷冻8 h后用真空冷冻干燥机干燥24 h。将冻干后的菌丝球在液氮中均质,用氯仿-甲醇(2∶1,V/V)溶液抽提菌丝球2 次,取氯仿层;在1 mL的氯仿的体系中加入2 mg三苯基膦作为抗氧化剂;氮气吹干,500 µL甲醇重溶后过0.22 µm有机滤膜除去大颗粒杂质,采用高效液相色谱-质谱联用仪测定氧脂素含量。
色谱条件:采用等度洗脱,流动相为乙腈-0.1%甲酸溶液90∶10(V/V);流速0.3 mL/min;进样量5 µL;色谱柱采用Agilent Eclipse plus C18柱(2.1 mm×50 mm,3.5 μm),柱温30 ℃。
质谱条件:电喷雾离子源负离子模式;串联四极杆质量分析器;离子源温度100 ℃;干燥气温度350 ℃;干燥气流速8.0 min;雾化气压力35.0 psi;碎裂电压为135 V;检测方式选择多重反应监测模式。
1.3.4 赭曲霉培养基中OTA含量的测定
采用酶联免疫试剂盒法测定OTA含量。取液体培养基置于离心管中,调pH 1~2,加1 mL三氯甲烷混匀,10 000×g离心5 min后取下层有机清液于新的离心管,氮气吹干后加1 mL甲醇复溶。酶联免疫吸附法检测OTA含量,根据需要量将浓缩酶结合物用结合物稀释液稀释,微孔中加入标准品/样本,然后加入酶结合物工作液避光反应,去离子水洗板4~5 次,显色5 min后加入终止液,最后使用酶标仪于波长450 nm处测定每孔OD值。
1.3.5 赭曲霉对种子的侵染
将选取的种子用7 5%乙醇溶液消毒1 m i n,0.05% NaClO溶液消毒3 min,无菌水冲洗数次,将种子用灭菌的的纱布擦干,置于三角瓶中。称取200 g种子浸没在200 mL无菌水(CK)或孢子悬浮液中,摇床200 r/min摇30 min,过滤后种子放入锥形瓶,于28 ℃培养箱暗培养7 d。
1.3.6 种子发芽率的计算
发芽率是指在规定的条件和时间内长成的正常幼苗数占供检验种子数的百分率。测定方法参照GB/T 3543.4—1995《农作物种子检验规程 发芽试验》,随机数取3 组试样:花生、大豆、玉米种子以50 粒为一组(50×3),小麦种子以100粒为一组(100×3)。无菌水浸种24 h之后均匀排列在垫有两层滤纸的培养皿中,将滤纸浸湿,置于28 ℃恒温培养箱中培养,花生、大豆、玉米、小麦的培养时间分别为5、5、4、4 d。种子发芽率的计算公式如下,结果用3 组实验结果的平均值表示。
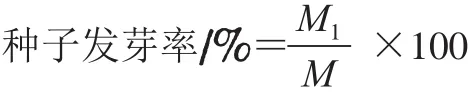
式中:M1为全部正常发芽粒数;M为供试种子粒数。
1.3.7 粮食营养成分的测定
为分析赭曲霉侵染粮食后,花生、大豆、玉米和小麦的营养成分损失情况,依据国标方法测定脂肪(GB 5009.6—2016《食品中脂肪的测定》)、蛋白质(GB/T 5009.5—2016《食品中蛋白质的测定》)、VB1(GB/T 5009.84—2016《食品中维生素B1的测定》)、VE(GB/T 5009.82—2016《食品中维生素E的测定》)的含量。
1.4 统计分析
采用IBM SPSS V 20.0软件分析实验数据,平均值的差异性用单因素方差分析(one-way ANOVA)中的最小显著性差异法检验分析,P<0.05,差异显著。数值用表示,实验重复3 次。统计分析图采用Microsoft Office Excel 2016绘制。
2 结果与分析
2.1 群体密度对赭曲霉的氧脂素和OTA产量的影响
为明确赭曲霉的群体密度对9S-HODE和13S-HODE及OTA产量的影响,测定赭曲霉在低密度群体(初始孢子接种密度103个/mL)和高密度群体(初始孢子接种密度106个/mL)中9S-HODE、13S-HODE和OTA的产量变化,结果如图1所示。9S-HODE和13S-HODE分别可以促进和抑制黄曲霉中毒素的产生[22],故用9S-HODE/13SHODE分析其对OTA产量的影响。
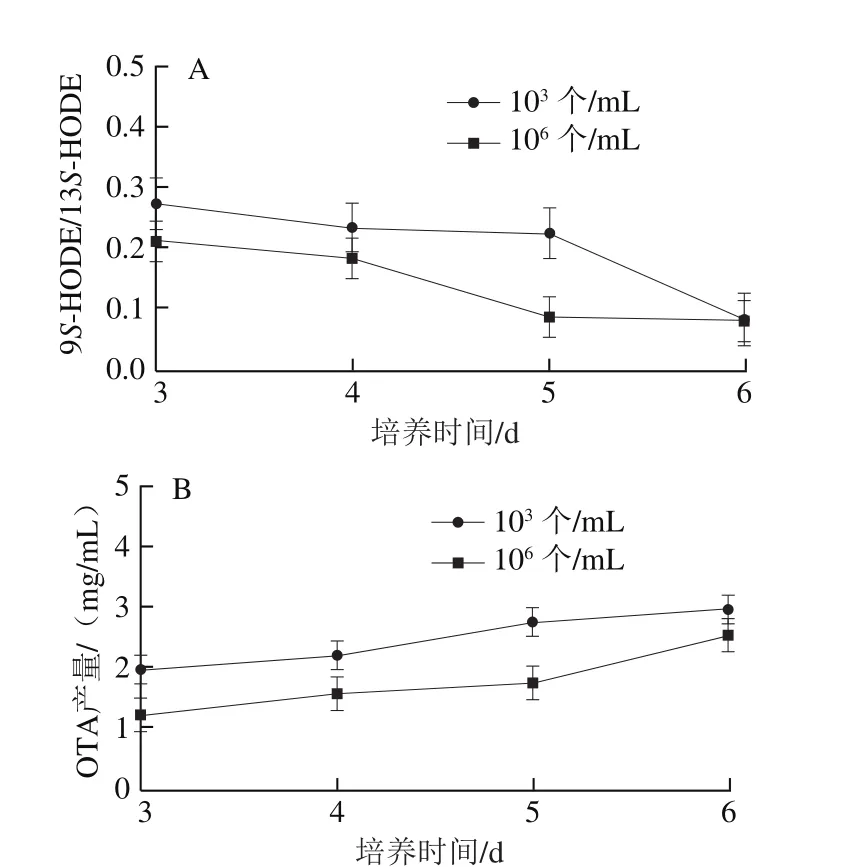
图1 不同培养时间和接种密度对赭曲霉的氧脂素(A)和OTA产量(B)的影响Fig. 1 Effects of culture time and inoculum density on ochratoxin (A)and OTA yield (B)
低群体密度的赭曲霉所产9S-HODE/13S-HODE比值高于高群体密度的赭曲霉,并产生更多的OTA。接种后赭曲霉产生9S-HODE/13S-HODE的比值在不断下降,初始接种密度为103个/mL的赭曲霉9S-HODE/13S-HODE比值开始时高于106个/mL的赭曲霉,随培养时间的延长二者趋于一致(图1A)。低群体密度赭曲霉的OTA产量高于高群体密度赭曲霉,随培养时间的延长逐渐趋于一致(图1B)。
在低群体密度(103个/mL)构巢曲霉中添加氧脂素,青霉素的产量提高[7];在黄曲霉中添加脂氧合物13S-HPODE明显抑制黄曲霉毒素合成,加入9S-HPODE促进黄曲霉毒素合成[23]。微生物产生特定的小分子化学物质并分泌到胞外,当胞外信号分子在局部环境中积累达到一定水平时,可以进入其他微生物细胞内激活特定基因的表达,从而调控群体行为适应环境的变化[16],这种通过密度依赖机制调节生物行为的机制最早在细菌中发现,称为群体感应。实验推测在赭曲霉中氧脂素9S-HODE和13S-HODE作为信号分子调控OTA产量。
2.2 添加9S-HODE、13S-HODE对赭曲霉生长发育和OTA产量的影响
为进一步分析氧脂素对赭曲霉生长发育和OTA产生的影响,在赭曲霉PDA培养基中外源添加9S-HODE和13S-HODE,观察赭曲霉菌落生长,测定产生的孢子数和OTA的产量。添加9S-HODE抑制赭曲霉菌落生长和孢子生成,促进OTA的产生;添加13S-HODE促进赭曲霉菌落生长和孢子生成,抑制OTA产生。观察菌落数量和形态,添加乙醇的对照组未显示出明显的促进或抑制菌落生长的作用,添加9S-HODE的滤纸周围菌落生长量最少,添加13S-HODE的滤纸周围长出了较多菌落(图2A)。计数结果与平板上观察到的现象相符,孢子产量:13S-HODE组(7×107个)>乙醇对照组(5×107个)>9S-HODE组(4×107个),说明9S-HODE确实抑制赭曲霉孢子产生,13S-HODE促进赭曲霉孢子产生(图2B)。测定OTA产量,9S-HODE组(90 ng/mL)>乙醇对照组(60 ng/mL)>13S-HODE组(35 ng/mL),表明9S-HODE可以促进OTA的产生,而13S-HODE可以抑制OTA的产生(图2C)。
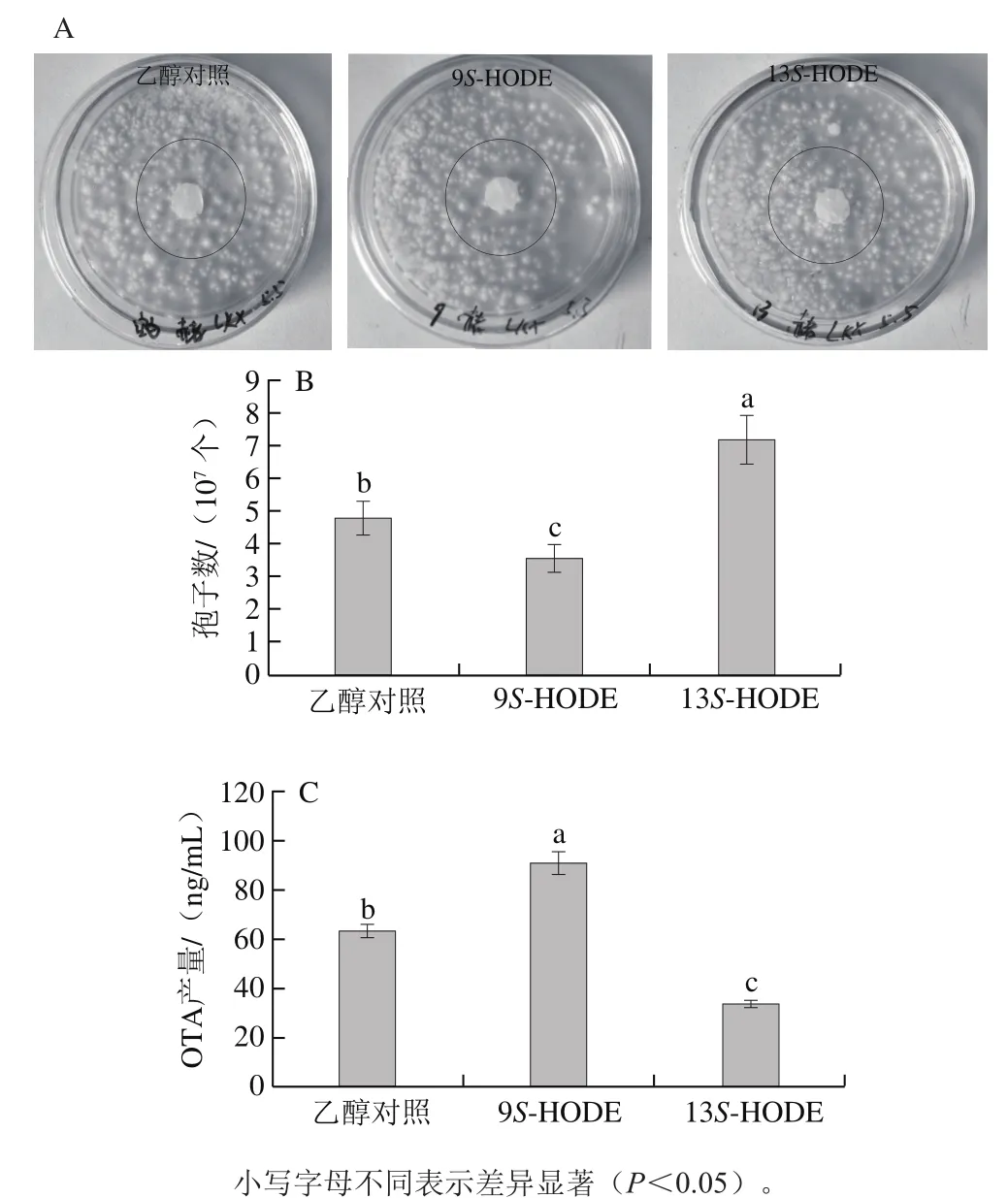
图2 添加9S-HODE和13S-HODE对赭曲霉菌落生长(A)、孢子数(B)、OTA产量(C)的影响Fig. 2 Effects of addition of 9S-HODE and 13S-HODE on colony growth (A), spore number (B), and OTA production (C) of A. ochraceus
Brown等[8]研究发现,氧脂素作为群体感应的信号分子,调节黄曲霉生长发育和黄曲霉毒素产生。在黄曲霉培养基中外源加入13S-HPODE会抑制黄曲霉毒素(aflatoxin,AF)合成,促进黄曲霉孢子产生;加入9S-HPODE会促进AF合成,抑制黄曲霉孢子产生[22]。氧脂素对赭曲霉与黄曲霉的生长发育和次级代谢产物影响类似,推测氧脂素作为赭曲霉的群体感应信号分子影响赭曲霉的生长发育和OTA产量,9S-HODE抑制赭曲霉孢子生成,促进OTA的产生;13S-HODE促进赭曲霉孢子生成,抑制OTA产生。
2.3 不同群体密度赭曲霉孢子侵染粮食规律
2.3.1 赭曲霉侵染对粮食发芽率的影响
为研究不同密度群体赭曲霉对花生、大豆、玉米、小麦等大宗农作物的侵染能力,测定赭曲霉侵染后的种子发芽率(图3)。从被103、106个/mL的赭曲霉孢子悬浮液侵染的花生、大豆、玉米中挑选出种子50 粒,从小麦中挑出种子100 粒进行发芽实验。侵染浓度106个/mL的赭曲霉比103个/mL的赭曲霉对粮食发芽的损伤更大。低密度赭曲霉侵染后花生、大豆、玉米、小麦发芽率分别下降了29%、21%、17%、14%;高密度赭曲霉侵染后花生、大豆、玉米、小麦发芽率分别下降了35%、29%、20%、22%,赭曲霉侵染可能对脂肪和蛋白质含量高的作物如花生、大豆的危害更大。脂类物质与氧脂素的生物合成有密切的关系,植物来源的亚油酸氧化产物可以影响曲霉的营养生长、分生孢子、菌核的形成及真菌毒素的合成[14-15],赭曲霉对粮食的侵染可能受到氧脂素的调控。
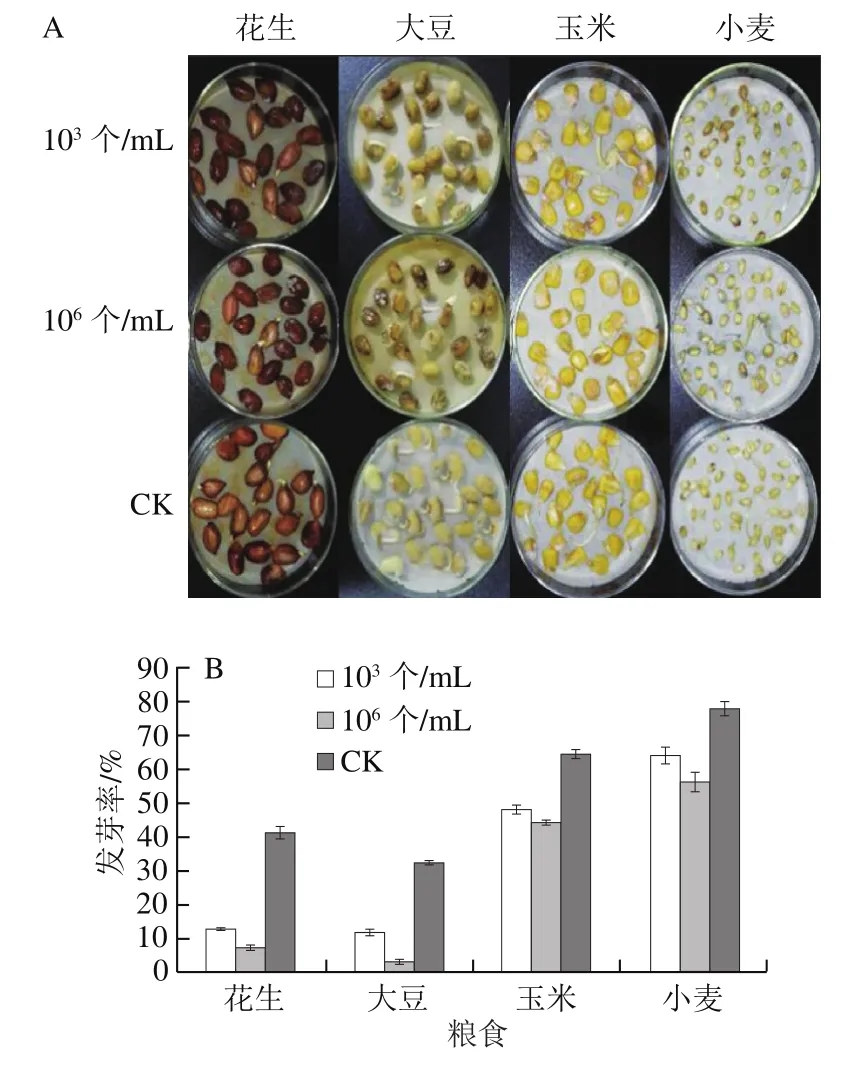
图3 花生、大豆、玉米和小麦被不同孢子密度赭曲霉侵染后的生长情况(A)和发芽率(B)Fig. 3 Growth (A) and germination rate (B) of peanut, soybean, corn and wheat infected with different spore densities of A. oryzae
植物氧脂素和曲霉属真菌氧脂素在生理作用上有相似性,植物中催化脂肪酸形成氧脂素的酶是脂肪氧合酶(lipoxygenase,LOX),LOX的主要作用是催化含有顺,顺-1,4-戊二烯结构的多元不饱和脂肪酸(如亚油酸、亚麻酸及花生四烯酸等)进行加氧反应,氧原子可添加在亚油酸碳氢链的第9或第13位的碳原子上,从而形成9S、13S脂肪酸氢过氧化物(9S-HPODE、13S-HPODE),它们影响黄曲霉侵染作物种子过程中黄曲霉的生长、孢子产生以及黄曲霉毒素的生物合成[24]。黄曲霉侵染玉米和花生种子,诱导种子中编码9-LOX的基因表达上调,9S-HPODE含量增加,黄曲霉毒素产量增加[25]。发现黄曲霉侵染对脂肪含量高的作物危害更大,推测是作物本身产生的9S-HPODE会诱使黄曲霉产生更多的黄曲霉毒素,同时促进有性孢子产生[16]。本研究发现赭曲霉的侵染规律同黄曲霉,从另一个角度验证氧脂素影响赭曲霉生长发育和次级代谢产物生成。
2.3.2 粮食受赭曲霉侵染后的营养成分分析
为测定赭曲霉侵染对粮食的损伤程度,进行赭曲霉侵染后粮食的营养成分分析。密度分别为103个/mL和106个/mL的赭曲霉孢子接种到花生、大豆、玉米和小麦上,未被侵染的种子作为对照,分析粮食营养成分的变化(图4)。发现赭曲霉侵染种子后蛋白质、脂肪、灰分、水分、VB1、VE等指标中,VE下降最显著(P<0.05),103个/mL和106个/mL的赭曲霉孢子侵染后的花生、大豆、玉米和小麦VE分别下降了50%、27%、8%、25%和40%、59%、11%、46%。
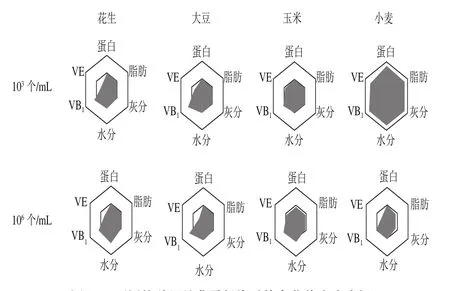
图4 不同接种量赭曲霉侵染后粮食营养成分分析Fig. 4 Nutritional analysis of grains infected with different inoculum concentrations of A. ochraceus
VE普遍存在于植物体内,是一种能阻断自由基链式反应的抗氧化剂。真菌侵染宿主后,宿主产生活性氧作为防御武器[26],诱导真菌细胞死亡,而真菌病原体产生次级代谢产物来抵抗氧化应激压力,如黄曲霉中黄曲霉毒素[27]、禾谷镰刀菌中的单萜烯B[28]、赭曲霉中的OTA[29]的积累,这是真菌与植物宿主互作所产生的适应性机制。推测被侵染的种子营养成分中具有抗氧化活性的VE损失最多就是赭曲霉侵染导致宿主氧化应激压力增大,生成活性氧,导致具抗氧化活性的VE含量下降。
3 结 论
本研究探讨了9S-HODE和13S-HODE对赭曲霉生长发育和OTA产生的作用。结果发现赭曲霉群体密度可以影响9S-HODE、13S-HODE及OTA合成,在低密度群体下产生的9S-HODE/13S-HODE比值高于高群体密度,产生更多的OTA。9S-HODE抑制赭曲霉菌落生长和孢子产生,促进OTA产生,而13S-HODE促进赭曲霉菌落生长和孢子产生,抑制OTA产生,表明外源添加氧脂素可以影响赭曲霉孢子产生和OTA合成。赭曲霉对油料作物如花生和大豆的侵染程度强于玉米和小麦。群体密度可以影响赭曲霉氧脂素和OTA的产生,氧脂素9S-HODE和13S-HODE可能作为赭曲霉的群体感应的信号分子,调节赭曲霉的生长发育和OTA的产量,脂肪和蛋白质含量高的粮食种子可能更易受到赭曲霉的侵染。群体感应可能是OTA合成的调控机理之一,明确氧脂素在赭曲霉生长发育和毒素产生中所起的作用,可以丰富赭曲霉的毒素合成调控机理的研究。
