三疣梭子蟹UHRF1基因在胚胎、幼体和性腺发育过程中的表达分析
2019-03-11孟宪亮环朋朋孙东方
蔡 影 孟宪亮 刘 萍, 李 健 环朋朋 孙东方
(1. 中国水产科学研究院黄海水产研究所, 农业部海洋渔业可持续发展重点实验室, 青岛 266071; 2. 青岛海洋科学与技术国家实验室, 海洋渔业科学与食物产出过程功能实验室, 青岛 266235; 3. 上海海洋大学水产与生命学院, 上海 201306)
表观遗传是指由非DNA序列改变引起的、可遗传的基因表达改变, 它主要包括DNA甲基化、组蛋白修饰、RNA调控和染色质重塑等现象[1]。大量研究表明, 表观遗传在真核生物的生长、发育、生殖等生命过程中都发挥着重要的作用[2]。
泛素样含PHD和环指域蛋白1(UHRF1)是近年来新发现的一种核蛋白, 被认为是表观遗传的核心蛋白, 是连接DNA甲基化和组蛋白修饰的重要纽带, 能够通过其特殊的结构域识别表观遗传学标记并结合相应的催化酶, 调控DNA甲基化[3]、组蛋白甲基化和组蛋白乙酰化[4, 5]等表观遗传修饰的水平。研究表明,UHRF1在脊椎动物发育编程中发挥重要作用。UHRF1表达异常能够造成个体发育缺陷, 甚至死亡。敲除UHRF1能够使斑马鱼(Danio rerio)胚胎的整体甲基化水平显著降低, 进而导致胚胎肝脏、眼等发育缺陷, 胚胎发育至幼体阶段便死亡[6]。在哺乳动物中的研究发现,UHRF1在配子发生过程中, DNA甲基化水平的维持具有重要作用[7]。UHRF1突变小鼠的卵母细胞DNA甲基化水平显著低于正常小鼠, 虽然卵母细胞的发育并未受到影响, 但大部分卵细胞受精发育到囊胚期之前便已死亡[8]。
UHRF1在脊椎动物中研究广泛, 但在甲壳动物中还未见相关报道。三疣梭子蟹(Portunus trituberculatus)是我国重要的海水养殖经济蟹类。为探讨PtUHRF1基因在三疣梭子蟹发育过程中的作用, 本实验采用SMART RACE方法克隆了三疣梭子蟹PtUHRF1基因cDNA全长并分析了其结构特征。采用实时定量技术, 检测了PtUHRF1基因在三疣梭子蟹胚胎时期、幼体时期和性腺发育时期表达情况,研究结果为进一步深入探讨PtUHRF1在三疣梭子蟹及甲壳动物中的发育调控提供重要依据。
1 材料与方法
1.1 实验材料与取样
实验所用三疣梭子蟹取自本实验室昌邑实验基地。选取附肢完整的三疣梭子蟹, 体重为25—250 g, 甲宽为42.51—90.94 mm。在室内养殖池中用自然海水暂养7d。水温为(21±2)℃, 盐度为33, 每天定时换海水1/3, 清理池底, 定时投喂蓝蛤, 不间断充氧气。
2016年7月到2017年4月, 在实验基地连续采集三疣梭子蟹卵巢和精巢发育不同时期的样品以及早期胚胎、溞状幼体、大眼幼体样品。每个时期设置3个重复。样品采集2份, 一份保存于液氮中,另一份采用4%多聚甲醛固定。根据管卫兵等[9]和吴旭干等[10]对三疣梭子蟹精、卵巢分期的方法, 对采集精巢和卵巢样品初步分期, 从分期的每组样品中选取7个样品切片、HE染色, 在显微镜下观察性腺的组织学特征(图版Ⅰ), 根据叶海辉等[11]和吴旭干等[10]对精巢、卵巢分期的方法来最终确定精巢、卵巢的发育成熟时期。
1.2 实验方法
三疣梭子蟹总RNA的提取和RACE模板的合成利用Trizol试剂提取肌肉、卵巢、胃、精巢、肝胰腺、鳃、肠、胸腺等组织总RNA, 采用紫外分光光度计和琼脂糖凝胶电泳检测提取的RNA质量以及完整性。选取其中质量较好的卵巢总RNA, 按照SMART RACE Amplification Kit 说明书的方法合成3′和5′ RACE 模板。
三疣梭子蟹PtUHRF1基因cDNA全长克隆根据三疣梭子蟹性腺转录组数据中UHRF1基因片段序列, 使用primer3在线引物设计软件设计UHRF1的3′和5′端特异性引物(表 1)。使用TaKaRa LATaq酶、RACE通用引物UPM、NUP, 采用巢式扩增,两轮PCR。PCR扩增程序: 94℃ 5min, 94℃ 30s,60℃ 30s, 72℃ 2min, 72℃ 10min 4℃保存, PCR产物经2%的琼脂糖凝胶电泳、DNA回收试剂盒回收得到扩增的目的片段, 紫外分光光度计检测回收DNA浓度, 用pMD18-T载体连接所得目的片段, 10 μL体系程序为16℃, 3h。连接液转入DH5α感受态中,于冰上放置40min后热激45s, 加入1 mL LB, 37℃摇床培养50min, 100 μL涂于氨苄抗性的培养板上,37℃过夜, 挑菌摇床培养, M13引物检测菌液PCR,琼脂糖电泳检测并送电泳条带大小合适的测序。
1.3 PtUHRF1基因的组织表达分析
采用Trizol方法提取三疣梭子蟹肌肉、卵巢、精巢等组织以及性腺、胚胎、幼体各时期总的RNA, 参照PrimeScript RT reagent Kit说明书反转录合成20 μL体系cDNA。
根据三疣梭子蟹PtUHRF1基因的开放阅读框(ORF)设计一对荧光定量引物(UHRF1-F1、UHRF1-R1)以及一对内参引物(β-actin-F、β-actin-R), 使用ABI 7500 Real Time PCR仪和TaKaRa SYBR Premix ExTaqⅡ试剂分析PtUHRF1基因在三疣梭子蟹性腺、胚胎、幼体不同发育时期以及组织分布表达情况。反应体系参照TaKaRa SYBR Premix ExTaqⅡ说明书, 10 μL反应体系包括: 5 μL SYBR Premix ExTaqⅡ (2×)、0.4 μL的正反向引物、3.0 μL DEPC水、0.2 μL ROX Reference DyeⅡ (50×)、1.0 μL cDNA。反应程序: 95℃ 30s; 95℃5s, 60℃ 30s, 40个循环; 95℃ 15s, 60℃ 1min, 95℃15s。PtUHRF1基因相对表达分析采用2-ΔΔCt法, 用SPSS19.0进行单因素方差分析, Origin2016作图。

表 1 实验引物序列Tab. 1 Primer used in this study
1.4 PtUHRF1基因的生物信息学分析
使用DNAstar拼接软件将测序得到目的序列和三疣梭子蟹PtUHRF1基因的EST序列拼接得到PtUHRF1基因的序列全长。用DNAstar中的Edit-Seq或在线软件ORFfinder预测PtUHRF1基因的开放阅读框(ORF)并进行氨基酸翻译, 用NCBI Blastx软件分析PtUHRF1基因和其他物种相似性,SingalP4.1 Server (http://www.cbs.dtu.dk/services/SignalP/) ExPASy、NCBI Conserved damain (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)等在线软件预测PtUHRF1基因的分子量和等电点以及分析其蛋白质功能结构域。将从GenBank中下载的其他物种的UHRF1氨基酸序列同三疣梭子蟹PtUHRF1氨基酸序列, 采用MEGA4.0软件构建PtUHRF1氨基酸NJ系统进化树。
2 结果
2.1 PtUHRF1基因的cDNA全长及序列同源性分析
三疣梭子蟹PtUHRF1基因全长为2849 bp,GenBank登录号为MG734836, 3′和5′ UTR分别为410和141 bp, 开放阅读框(ORF)长2298 bp, ORF编码765个氨基酸, 预测PtUHRF1表达蛋白的分子量86.72 kD, 理论等电点是8.37, PtUHRF1氨基酸序列。PtUHRF1具有UBL、TTD、PHD、SRA、RING finger 5个结构域(图 1)。通过在线Blastp对比不同物种UHRF1基因氨基酸序列, 结果显示, PtUHRF1氨基酸序列保守性相对较高, 三疣梭子蟹编码的氨基酸序列和桃蚜(Myzus persicae)的同源性为55%。利用MEGA4.0软件采用邻接法构建三疣梭子蟹PtUHRF1系统进化树, 结果显示三疣梭子蟹PtUHRF1同桃蚜(M. persicae)UHRF1进化关系最近聚为一支, 再和茶翅蝽(Halyomorpha halys)和烟粉虱(Bemisia tabaci)聚为一支(图 2)。
2.2 PtUHRF1基因在三疣梭子蟹胚胎时期和幼体时期的表达分析
在早期胚胎发育阶段,PtUHRF1基因呈现先下降后上升的趋势, 在受精卵时期的表达显著高于其他时期(P<0.05), 是多细胞时期表达量的2.5倍(图3)。在幼体时期,PtUHRF1的表达呈现先上升后下降的趋势, 在蚤状幼体Ⅱ和大眼幼体第3天,PtUHRF1的表达量最高并且显著高于同一时期的其他组织(P<0.05)(图 4)。
2.3 PtUHRF1基因在三疣梭子蟹中组织分布以及在性腺不同时期表达分析

图 1 三疣梭子蟹PtUHRF1蛋白结构域位置Fig. 1 The sites of domains in PtUHRF1 in P. trituberculatus
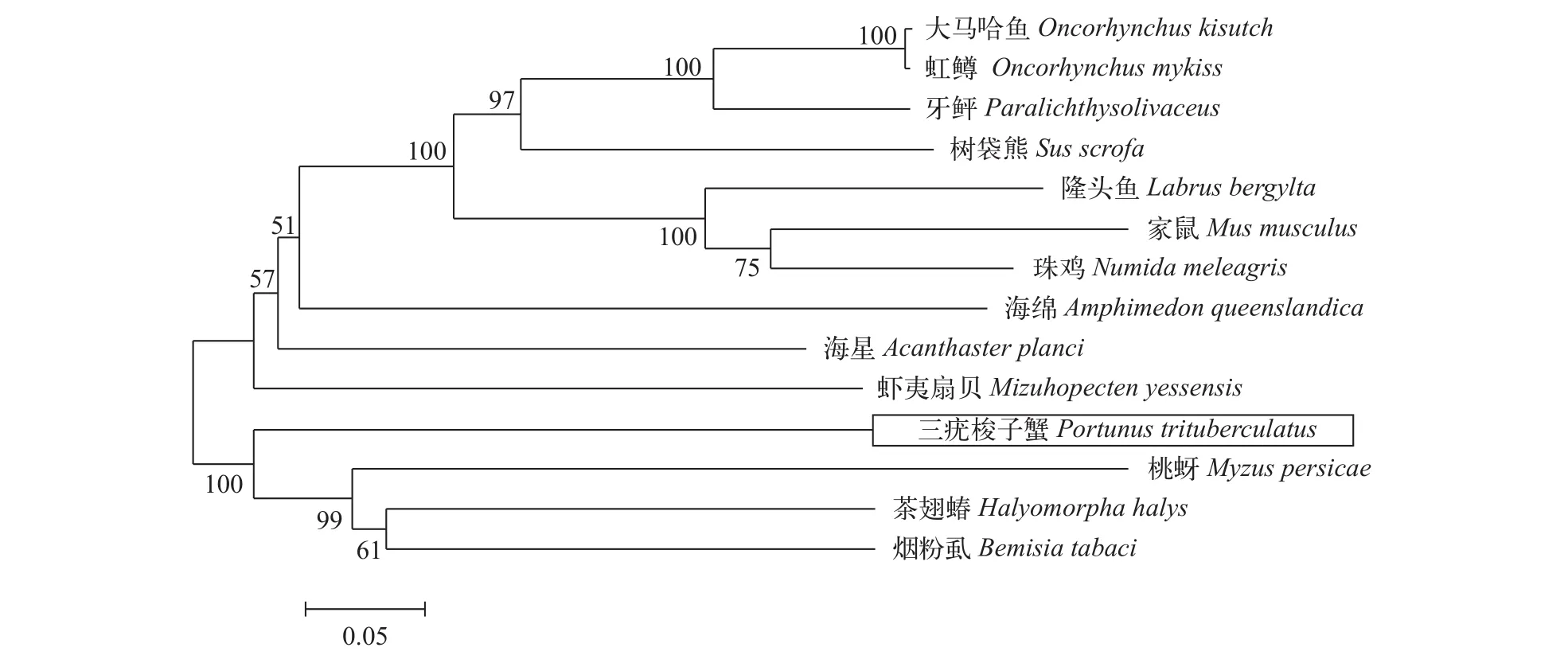
图 2 基于UHRF1氨基酸序列构建的NJ进化树Fig. 2 NJ tree based on UHRF1 amino acid sequences
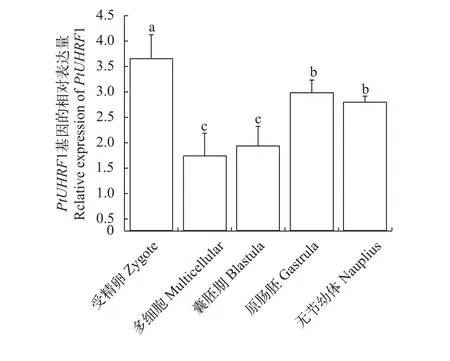
图 3 PtUHRF1基因在三疣梭子蟹胚胎时期的表达Fig. 3 Expression of PtUHRF1 in embryonic development ofPortunus trituberculatus
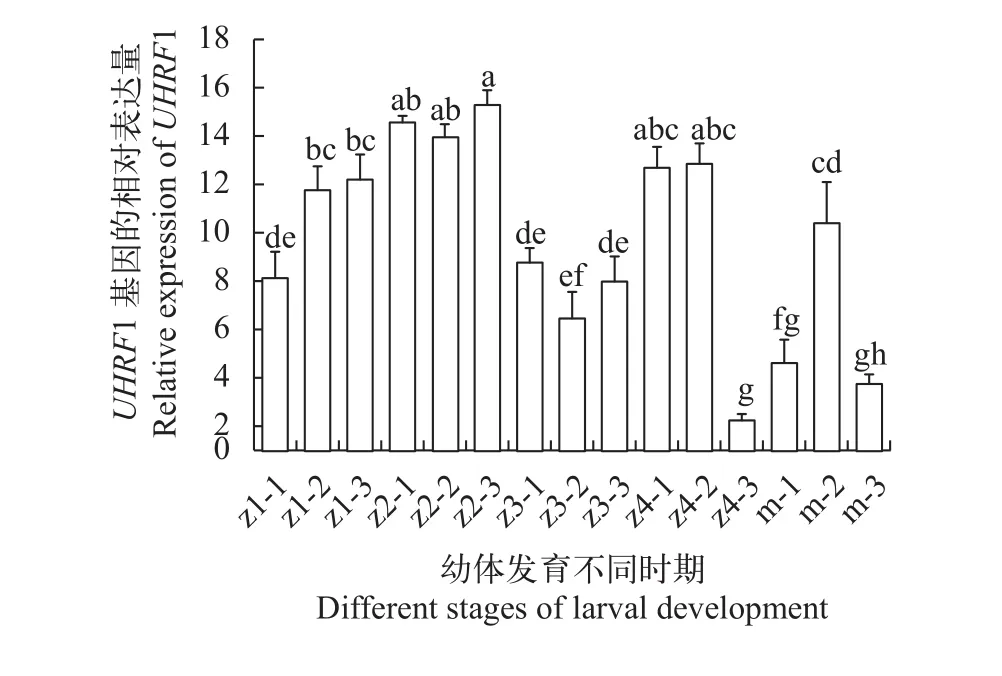
图 4 PtUHRF1基因在三疣梭子蟹蚤状幼体和大眼幼体时期的表达Fig. 4 The expression of PtUHRF1 in zoea and megalops larva of Portunus trituberculatus
利用Real-time PCR技术, 我们分析了PtUHRF1基因在不同组织和性腺中的表达情况, 结果表明,PtUHRF1基因在所有的组织中均有表达, 精巢中的表达量显著高于其他组织(P<0.05), 肌肉次之, 接下来依次是心脏、卵巢、眼柄、肝胰腺、胸腺、肠、胃和脑神经(图 5)。对三疣梭子蟹卵巢不同时期的表达分析显示,PtUHRF1的表达量呈现先上升后下降的趋势, 在卵巢发育Ⅱ期的表达量显著高于其他时期(P<0.05), 是最低Ⅲ期的2倍(图 6)。而在精巢中,PtUHRF1的表达量则呈现逐渐递减的趋势, 在I期的表达量显著高于其他时期(P<0.05), 其表达量是最低Ⅲ期的4.5倍(图 7)。
3 讨论
3.1 PtUHRF1基因 cDNA 全长克隆及序列分析
本实验克隆了三疣梭子蟹PtUHRF1基因, 该基因cDNA全长为2849 bp, 编码765个氨基酸。该基因编码的蛋白质包含典型的UHRF1功能结构域, 包括UBL(Ubiquitin-like domain)结构域、TTD(Tandem tudordomian)结构域、PHD(Plant homeodomain)结构域、SRA(SET and Ring-associated domain)结构域和RING(Really interesting new gene)结构域。其中, PHD和TTD功能域能够识别并参与修饰常染色质和异染色质中的组蛋白[12]; SRA(SET和RING)功能域能够识别半甲基化的CpG位点, 在DNA复制时, 能够募集甲基转移酶1(Dnmt1)维持新合成的DNA半甲基化状态[5]; UBL与RING结构域拥有泛素连接酶的活性, 可以特定泛素化包括细胞周期相关蛋白等重要代谢因子[13],PtUHRF1的结构特征暗示其很有可能在三疣梭子蟹的表观遗传调控中发挥重要作用。

图 5 三疣梭子蟹PtUHRF1基因在不同组织中的表达分布Fig. 5 The expression of PtUHRF1 in different tissues of Portunus trituberculatus
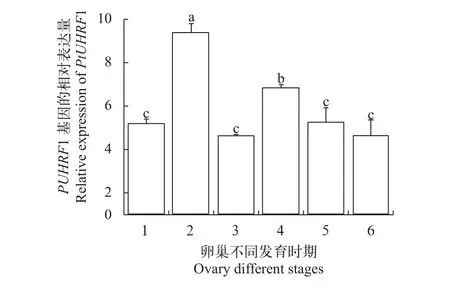
图 6 三疣梭子蟹PtUHRF1基因在卵巢发育不同时期的表达Fig. 6 The expression of PtUHRF1 in ovary of Portunus trituberculatus in different gonadal stages
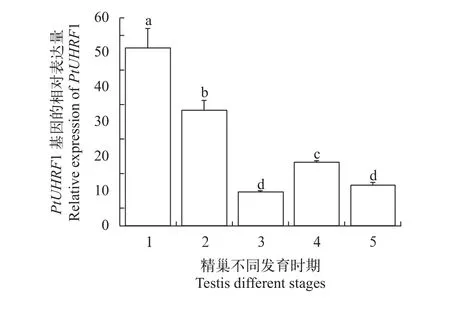
图 7 三疣梭子蟹PtUHRF1基因在精巢发育不同时期的表达Fig. 7 Expression of PtUHRF1 gene in testis of Portunus trituberculatus in different gonadal stages
3.2 PtUHRF1基因在性腺发育不同时期表达分析
已有研究表明, 表观遗传修饰在配子发生中发挥重要的作用[7, 8], 如参与基因组印记的维持, X-染色体的失活等[14, 15]。UHRF1能促进小鼠配子发生过程中DNA甲基化的维持[8],UHRF1突变小鼠卵细胞Dnmt1的表达明显下调, 卵细胞整体甲基化水平明显下降, 导致胚胎无法正常发育[8]。组织分布和性腺表达分析结果显示,PtUHRF1在三疣梭子蟹所有组织中均有表达, 但在不同组织中表达差异显著,其在精巢中表达量最高(P<0.05), 表明该基因可能在三疣梭子蟹精子发生过程中具有重要作用。性腺不同发育时期表达分析结果显示,PtUHRF1基因在三疣梭子蟹卵巢发育不同时期表达差异显著, 其在Ⅱ期和Ⅳ期表达量显著高于其他时期。Ⅱ期和Ⅳ期分别为内源性卵黄和外源性卵黄积累的重要时期[10], 因此, 推测PtUHRF1基因可能在三疣梭子蟹卵黄积累调控过程中发挥重要作用。PtUHRF1基因在精巢Ⅳ期的表达显著高于Ⅲ和Ⅴ期, Ⅳ期为精子期, 暗示PtUHRF1基因可能参与调控三疣梭子蟹精子的成熟过程[9]。
3.3 PtUHRF1基因在胚胎发育不同时期表达分析
三疣梭子蟹胚胎发育不同时期RT-PCR结果发现,PtUHRF1表达量在不同发育时期差异显著, 随着胚胎的发育呈现先下降后上升的趋势, 受精卵时期表达显著高于其他时期(P<0.05), 表明其可能在三疣梭子蟹胚胎发育调控中发挥重要作用。PtUHRF1与斑马鱼胚胎发育过程中该基因表达模式相似[6]。在斑马鱼中的研究发现,UHRF1通过调节DNA甲基化水平参与胚胎发育调控。敲除UHRF1基因, 会造成胚胎整体DNA甲基化水平显著下降, 进而造成肝脏、眼等发育缺陷, 导致斑马鱼胚胎死亡。在本实验中,PtUHRF1在V期卵巢中的表达要显著高于受精卵, 提示受精卵中的PtUHRF1可能为母源表达。该基因在多细胞期和囊胚期的表达显著低于受精卵期, 可能是由于母源mRNA的逐渐降解。以往的研究发现, 敲除成熟的卵细胞还是受精卵中的UHRF1, 胚胎发育到囊胚期或原肠胚时期基本死亡[8]。综合以上结果表明,UHRF1基因在真核生物的胚胎发育中有重要的功能。
本实验首次克隆获得三疣梭子蟹PtUHRF1基因cDNA全长, 分析了PtUHRF1在三疣梭子蟹不同组织, 以及胚胎、幼体和性腺发育不同时期表达差异, 推测其参与了三疣梭子蟹胚胎、幼体和性腺生长发育的调控, 该结果为进一步了解UHRF1基因对三疣梭子蟹和其他甲壳动物生长发育中的作用提供参考。
