转B、T淋巴细胞衰减子基因树突状细胞诱导大鼠肝移植免疫耐受的作用及机制
2019-03-11李军良郭天康张东黄军悦田宏伟王涛
李军良,郭天康,张东,黄军悦,田宏伟,王涛
(甘肃省人民医院 1. 普通外科 2. 医疗质量控制科 3. 肾内科,甘肃 兰州 730030)
B、T淋巴细胞衰减子(BTLA)是免疫球蛋白超家族成员,与疱疹病毒侵入介质(HVEM)结合提供T淋巴细胞的负性调节第2信号,BTLA在体内广泛表达于T细胞、B细胞、NK细胞、树突状细胞(DC)和巨噬细胞等多种免疫细胞表面。已有研究[1-7]表明BTLA信号通路在炎症免疫调控、肿瘤免疫逃避和自身免疫性疾病中起到重要作用,但BTLA信号通路和肝脏移植物的免疫耐受间的相关性尚缺乏研究。本研究拟采用慢病毒介导BTLA基因转染DC后回输肝移植术后大鼠,观察其对移植肝脏的免疫保护作用及相关机制。
1 材料与方法
1.1 实验动物
供体为DA大鼠,体质量18~220 g,受体为Lewis大鼠,体质量250~300 g,均为雄性,SPF级,由北京维通利华公司提供,实验于甘肃中医药大学SPF实验室完成,实验动物饲养及实验过程符合实验动物伦理相关规定。
1.2 BTLA慢病毒载体的构建及鉴定
根据GeneBank公布的大鼠BTLA基因mRNA序列(NM_213630.1),委托上海生工生物技术有限公司合成引物,构建ORF慢病毒表达质粒LV-BTLA,继而构建慢病毒LPP-Mm26645-Lv203-400,用此慢病毒感染293T细胞,培养48 h后使用荧光显微镜进行绿色荧光蛋白观察。
1.3 目标DC的获取和鉴定[8]
D A大鼠10%水合氯醛腹腔注射麻醉后,1250 U肝素阴茎背静脉注射,腹主动脉抽血共计20 mL,加入大鼠淋巴细胞分离液600 g离心20 min,取淋巴细胞层清洗2次,用含100 ml/L胎牛血清的RPM11640悬浮细胞,加入20 ng/mL GMCSF、10 ng/mL IL-4、4 µg/L的重组大鼠TNF-α(recombinant rat tumor necrosis factor α,rrTNF-α),1 mL/L双抗(链霉素、青霉素),37 ℃、5% CO2孵箱中培养。隔日半量换液,10 d后可见半悬浮状态成团聚集的细胞。采用流式细胞术检测CD80、CD86、MHCII、OX62的表达。
1.4 慢病毒和DC共培养及BTLA的表达鉴定
取上述培养5 d后的DC细胞将其收集于12孔细胞培养板中,24 h后以感染复数为15向细胞培养孔中加入携带BTLA基因的重组慢病毒液,37 ℃、5% CO2孵箱中培养48 h后Western blot法检测BTLA在修饰DC细胞中的蛋白表达水平,使用Image J软件进行图像处理分析。
1.5 大鼠原位肝移植模型的建立[9-11]
1.5.1 供体手术 DA大鼠10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉后仰卧位胶布固定,肋缘下T字型切口入腹,顺时针游离供肝,依次切断右三角韧带、冠状韧带,结扎并切断左膈下静脉、肝和食管间的交通支血管,结扎并切断幽门静脉,经阴茎背静脉注射1250 U肝素液完成供体肝素化。贴近下腔静脉结扎右肾上腺静脉,分离并结扎切断右肾静脉。暴露肝门,左右肝管汇合部下方5 mm V字形剪开胆总管前壁置入胆管内支架,5-0丝线固定。穿刺腹主动脉置入小儿头皮针并血管夹固定,0~4 ℃乳酸钠林格氏液20 mL(含肝素5 U/mL)缓慢灌注,剪开膈肌,阻断胸主动脉,剪开右心耳放血,完成供肝灌注。紧贴肝上下腔静脉膈肌环离断肝上下腔静脉,脾静脉交汇上方离断门静脉,左肾静脉上方离断肝下下腔静脉,完成供肝摘取。
1.5.2 供肝修整 冰盐水中修剪肝上膈肌环,完整去除膈肌。肝下下腔静脉置入6.7-F心脏导管外鞘制成的套管并5-0丝线固定,门静脉内置入5.6-F心脏导管外鞘制成的套管并5-0丝线固定,至此完成供肝修整。
1.5.3 受体手术 Lewis大鼠术前30 min肌注0.03 mg阿托品,10%水合氯醛(0.3 mL/100 g)腹腔麻醉满意后仰卧位胶布固定,取上腹正中切口。游离并依次切断肝周韧带,肝固有动脉起始段结扎并切断。左右肝管汇合处离断胆总管远端置入胆管内支架并5-0丝线活结临时固定。紧贴肝下下腔静脉结扎右肾上腺静脉,右肾静脉上方哈巴狗血管夹阻断下腔静脉,幽门静脉上方血管夹阻断门静脉,穿刺门静脉分叉处缓慢推注2 mL生理盐水完成自身输血。小儿Satinsky钳带少量膈肌阻断肝上下腔静脉,门静脉分叉处离断门静脉,紧贴肝脏离断肝下下腔静脉,摘除受体肝脏。移入供肝8-0丝线两定点法完成肝上下腔静脉端端吻合,门静脉断端套入供体套管并5-0丝线固定,开放受体门静脉阻断钳和肝上下腔静脉阻断钳结束无肝期,可见肝脏颜色缓慢变红。同法套入肝下下腔静脉并开放右肾静脉上方血管夹,可见右肾颜色缓慢复原。拆除受体胆总管支架,套入供体胆总管支架完成胆总管重建,至此完成受体肝脏移植。
1.6 实验分组和检测指标
将36只模型大鼠分为3组,每组12只。模型组:仅行原位大鼠肝移植,术后不作任何处理;DC组:受体Lewis大鼠行肝移植术后即刻、术后3 d经尾静脉回输无B T L A基因的重组慢病毒Lv.GFP转染的DC细胞;BTLA-DC组:受体Lewis大鼠行肝移植术后即刻、术后3 d经尾静脉回输重组慢病毒LPP-Mm26645-Lv203-400转染的DC细胞。以上3组各6只大鼠于术后3、7 d尾静脉采血全自动生化仪检测天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总胆红素(TBIL),术后7 d尾静脉采血ELISA检测血清白细胞介素10(IL-10)、干扰素(IFN-γ)含量。每组2只大鼠术后7 d吸入乙醚麻醉后摘取供肝,10%福尔马林4 ℃固定过夜,石蜡包埋,切片4 µm厚,经HE染色后在光学显微镜下观察供肝病理改变,参照肝移植排斥反应Banff标准。其余每组6只用于生存分析。
1.7 统计学处理
所有资料用SPSS 25.0统计软件分析。计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,受体大鼠生存时间采用Kaplan-Meier生存曲线分析并用Log-rank秩和检验。
2 结 果
2.1 DC细胞的体外培养与鉴定
隔日半量换液1次,培养10 d后显微镜下观察可见成团聚集呈悬浮状态的细胞,流式细胞仪检测细胞表面CD80、CD86、MHCII、OX62的表达分别为41.79%,55.18%,57.93%,61.77%,为成熟DC(mDC)的特征(图1)。
2.2 重组慢病毒LPP-Mm26645-Lv203-400转染DC
LPP-Mm26645-Lv203-400与Lv.GFP感 染293T细胞48 h后倒置荧光显微镜下可见明显的绿色荧光蛋白表达。取被转染的DC行Western blot检测BTLA蛋白表达情况,结果显示,携带BTLA基因重组慢病毒载体感染的DC较空白对照DC与不携带BTLA基因重组慢病毒载体感染的DC的BTLA蛋白表达含量明显升高,Image J软件行灰度分析结果显示,差异有统计学意义(P<0.01)(图2)。

图1 流式细胞术检测mDC细胞表面分子标志物Figure1 Surface molecular markers of mDCs determined by flow cytometry
2.3 造模情况
本组共完成大鼠原位异体肝移植模型36例(图3),以术后存活72 h以上视为模型成功,成功率100%。其中供体手术时间(22.5±3.0)min,受体手术时间(67.1±5.2)m i n,受体无肝期(18.7±1.9)m i n,供肝冷缺血时间(52.0±3.9)min。
2.4 术后血清学指标变化
肝移植术后受体大鼠血清AST、ALT、TBIL、IL-10,IFN-γ含量变化见图4。术后3、7 d,BTLA-DC组的ALT、AST、TBIL水平均明显低于模型组和DC组(均P<0.05),术后3 d,DC组ALT、AST、TBIL水平与模型组差异无统计学意义(P=0.436、0.082、0.624),但术后7 d的ALT、AST、TBIL水平均明显高于模型组(均P<0.05)。与模型组比较,BTLA-DC组术后7 d的IFN-γ水平明显降低、IL-10水平明显升高(均P<0.05),DC组术后7 d的IFN-γ水平明显升高、IL-10水平明显降低(均P<0.05)。

图4 各组大鼠肝移植术后血清学指标变化Figure4 Changes in serum biochemical variables in each group of rats after liver transplantation
2.5 病理学检查结果
移植肝病理检查结果显示,模型组与DC组汇管区大量淋巴细胞浸润,累及周围肝实质,胆管上皮可见炎性细胞浸润,肝静脉内膜下炎细胞浸润明显,而BTLA-DC组汇管区和胆管上皮少量炎性细胞浸润。按Banff方案肝移植术后病理评价。模型组术后7 d RAI评分平均为7分,为III级重度排斥反应。DC组术后7 d RAI评分平均为8分,为III级重度排斥反应。BTLA-DC组术后7 d RAI评分1~2分,为I级轻度排斥反应(图5)。
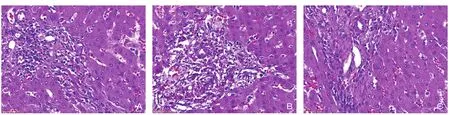
图5 移植肝脏HE染色(×400) A:模型组;B:DC组;C:BTLA-DC组Figure5 HE staining of the liver transplants (×400) A:Model group; B:DC group; C:BTLA-DC group
2.6 生存分析
模型组的中位生存时间为15 d,DC组的中位生存时间为13 d,BTLA-DC组的中位生存时间为79 d,3组的累积生存率曲线差异有显著统计学差异(χ2=16.14,P=0.0003)(图6)。
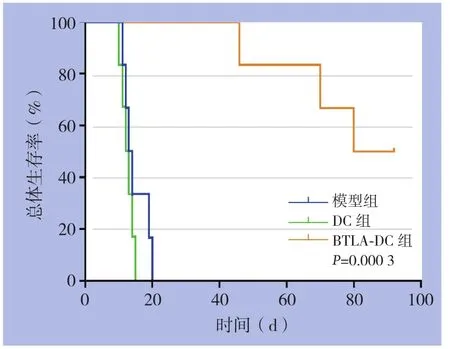
图6 各组肝移植术后大鼠生存曲线Figure6 Survival curves of each group of rats after liver transplantation
3 讨 论
肝脏移植已经成为治疗各种终末期肝病的最有效的方法之一,然而,排斥反应的发生限制了移植肝和受体的长期存活。临床上应用各种免疫抑制药物预防排斥反应已经取得了不错的疗效,但是长期服用免疫抑制剂会诱发血压升高、血糖升高,感染机率增高,肿瘤发生率增高等,甚至会引起严重的肝肾功能损害[12-13]。因此,寻找新的免疫耐受方案成为合理的选择,并有望最终替代免疫抑制类药物的使用。
T细胞作为肝脏移植免疫排斥的主要效应细胞发挥作用,T细胞的激活需要双信号通路[14],以往免疫耐受研究主要集中在正向刺激信号的阻断[15-16],近年来负性共刺激通路BTLA的作用逐渐受到重视[17-19],Grabmeier-Pfistershammer等[20]报道使用抗体阻断BTLA信号通路可以有效上调HIV感染患者的CD8+T细胞数量。Simon等[21]报道BTLA高表达的DC可以有效的上调调节性T细胞的数量。人体中存在多种抗原呈递细胞(APC),DC是迄今为止所知的呈递抗原能力最强的APC。DC的功能具有复杂性[22-23],未成熟DC(imDC)表面低表达共刺激分子OX80、XO86、MHCII,与T细胞结合后不能有效传递第二信号,从而导致T细胞发生抗原特异性免疫耐受。mDC细胞表面高表达共刺激分子OX80、XO86、MHCII,可以有效传递T细胞激活的第二信号。经典理论[24]认为基于细胞因子分泌情况和转录因子表达情况,T细胞可以向分泌IFN-γ和IL-2的Th1细胞分化,从而引起移植肝细胞的损伤,也可以向分泌IL-4和IL-10为主的Th2细胞分化,从而抑制对移植肝细胞的损伤。基于基因工程的方法修饰DC细胞被认为是最有前景的免疫治疗方法之一[25]。
本研究采用BTLA基因的重组质粒,利用慢病毒作为载体,和供体来源的DA大鼠DC细胞共培养,获得稳定表达后经阴茎背静脉回输入肝移植术后大鼠,慢病毒介导的BTLA基因高表达的BTLA-DC组术后3、7 d的ALT、AST、TBIL较模型组和DC组明显降低。代表Th2细胞分泌的细胞因子IL-10的含量较模型组和DC组明显升高。术后7 d移植肝脏的病理改变较模型组和DC组的RAI评分明显减低。DC组较模型组在7 d时的ALT、AST、TBIL明显升高,代表Th1细胞分泌的细胞因子IFN-γ较模型组明显增高,移植肝脏病理评分也明显增高,说明单纯输注DC细胞会进一步增强免疫排斥反应。
本研究结果表明,高表达BTLA的DC细胞会诱导Th1/Th2细胞漂移,进而导致T细胞对移植肝脏产生抗原特异性免疫耐受,本研究有助于揭示修饰DC负性通路导致肝移植免疫耐受的机制,从而为肝脏移植免疫耐受提供一种可能的新方法。
