携带人mda-7/IL-24基因溶瘤腺病毒SG600-IL24构建及其选择性杀伤肝癌细胞的机制研究
2019-03-11肖朝文郑小林蔡常春郑建伟申铭
肖朝文,郑小林,蔡常春,郑建伟,申铭
(1. 华中科技大学同济医学院附属武汉中心医院 肝胆胰外科,湖北 武汉 430014;2. 华中科技大学同济医学院附属同济医院 肝胆胰外科,湖北 武汉 430030)
mda-7/IL-24基因最初被命名为黑色素瘤分化相关基因7(melanoma differentiation associated gene 7,mda-7),又名IL-24,是Fisher教授利用亚减法技术从黑色素瘤细胞中经人干扰素β(IFN-β)和PKC激活剂mezerin(MEZ)诱生而获得的[1]。研究[2-5]发现该基因不仅能引起黑色素瘤细胞生长抑制和凋亡,而且能促进其他多种癌细胞的生长抑制和凋亡,但是对正常细胞却没有发现明显毒性作用,被誉为21世纪最令人激动的可以攻克肿瘤的基因之一[6]。携带人mda-7/IL-24的溶瘤腺病毒,是一种复制非缺陷型病毒(溶瘤腺病毒),已经显示出了更高的转染效率,因为外源基因能选择性在肿瘤细胞DNA内复制、增殖、裂解肿瘤细胞,而对正常细胞几乎没有影响。课题组前期研究[7-8]已经从多个方面证实了携带人mda-7/IL-24溶瘤腺病毒SG600-IL24杀伤肝癌细胞株高选择性,那么其选择性杀伤肝癌细胞机理到底如何?为了进一步探讨这些问题,本课题组运用溶瘤腺病毒SG600-IL24干预肝癌细胞株HepG2、HCCLM3和正常肝细胞株L02,检测干预后肝癌细胞株HepG2、HCCLM3和正常肝细胞株L02内不同时间点总STAT3以及信号通路下游信号分子c-myc、Bax、Bcl-2、Bcl-xl、cyclin D2、survivin、XIAP、OPN、MMP-2、MMP-9和VEGF基因和蛋白的表达变化,同时检测各细胞株在溶瘤腺病毒SG600-IL24处理后,磷酸化STAT3的表达变化。
1 材料与方法
1.1 材料与试剂
目的基因、载体和细胞:p Z D 55-I L 24、pClon9、pUC19-INS、SG502-ΔCR2及腺病毒骨架质粒ppE3均购于上海新基因公司;HepG2、L02及高转移性人肝癌细胞株HCCLM3购于上海复旦大学肝癌研究所;氨苄青霉素抗性的大肠杆菌DH5a及HEK293细胞株为第二军医大学东方肝胆外科研究所钱其军教授惠赠。引物:依据GeneBank(NM006850)hIL-24的cDNA序列,选其编码序列(coding sequence,CDS)为目的片段,大小约640 bp,设计上、下游引物分别为VT371与VT372。序列分别为5'-GAC TCG AGA TGA ATT TTC AAC AGA-3';5'-ATG GAT CCT CAG AGC TTG TAG AAT-3',由上海英骏生物技术有限公司合成。试剂:限制性内切酶XbaI、BamHI、EcoRI、HindIII、ScaI,高保真pfu酶及快速连接试剂盒(DNA ligation kit)购于New England Biolabs(NEB)公司,质粒小样提取试剂盒、胶回收试剂盒购于QIAGEN公司,肝癌细胞株HepG2、HCCLM3细胞,用高糖DMEM培养基(含10%胎牛血清,青霉素100 U/mL,链霉素100 U/mL),正常肝细胞株L02细胞用1640培养基(含10%胎牛血清,青霉素100 U/mL,链霉素100 U/mL)。RT-PCR试剂盒(TAKARA公司),一抗mda-7/IL-24(英国Abcam公司),兔抗人mda-7/IL-24为英国Abcam公司产品;兔抗人STAT3、p-STAT3、survivin、XIAP、OPN和MMP-2为美国SANTA CRUZ公司产品;鼠抗人c-myc、Bax、Bcl-2、Bcl-xl、cyclin D2和VEGF为均为美国SANTA CRUZ公司产品;引物的设计、合成由上海生工生物技术有限公司完成。
1.2 携带目的基因的溶瘤腺病毒载体的构建
酶切质粒Z D 55-I L 24得到I L 24连接到pClon9-INS-IL24,将pClon9-INS-IL24共酶切得到INS+IL24片段,装入SG502-ΔCR2载体中,获得重组质粒pSG600-IL24,并将其送上海英骏生物技术有限公司进行测序,测序结果与GeneBankNM006850的基因序列完全相符。将293细胞培养于6孔板中(1×106个/孔),当细胞汇合率达90%左右时,取纯化的穿梭质粒SG600-IL24及腺病毒骨架质粒ppE3,用Lipofectamine 2000试剂盒共转染293细胞,待9~14 d空斑出现后挑取空斑,经过3次病毒空斑纯化,提取病毒DNA,应用PCR进行鉴定,鉴定正确的腺病毒命名为SG600-IL24,即携带人mda-7/IL-24基因的溶瘤腺病毒SG600-IL24,储存于-80 ℃。
1.3 溶瘤腺病毒的扩增、纯化和滴度测定
293细胞在75 cm2的培养瓶中培养,当细胞生长至80%~90%满时,以10~20病毒颗粒/细胞接种腺病毒,2~3 d后当细胞出现CPE反应后收集细胞,反复冻融3次,取病毒上清液再感染293细胞进行大量扩增,2~3 d后收集细胞,PBS重悬,反复冻融,为了得到滴度更高的病毒,反复“感染-收集-冻融”3次,最后CsCl离心纯化。滴度测定时将HEK293细胞接种于96孔板,然后用50%组织培养感染剂量法(TCID50)来测定病毒滴度。
1.4 病毒感染及实验分组
溶瘤腺病毒SG600-IL24和SG600-EGFP(携带对照基因EGFP)由本实验室在293细胞内同源重组的方法构建,构建成功后在293细胞中扩增,CsCl超速离心法纯化,病毒滴度由TCID50法测定,溶瘤腺病毒按感染复数(multiplicity of infection,MOI)=10感染上述细胞。将实验细胞(HepG2、HCCLM3、正常肝细胞L02)各分为3组:空白对照组(无血清DMEM培养)、SG600-EGFP组(感染对照病毒载体SG600-EGFP)、SG600-IL24组(感染溶瘤腺病毒SG600-IL24)。
1.5 RT-PCR检测多种基因mRNA的表达变化
取对数期的肝癌细胞HepG2、HCCLM3和正常肝细胞L02,按上述方法感染,分别于感染24、48、72 h后按TRIzol试剂盒说明提取各组细胞总mRNA,测定RNA的浓度和纯度后,进行半定量RT-PCR扩增。目的基因的上、下游引物和扩增片段长度分别如表1所示,反应条件:94 ℃预变性5 min,94 ℃ 30 s、56 ℃ 30 s、72 ℃ 1 min,共30个循环;72 ℃延长10 min。同反应条件β-actin扩增片段,长度为20l bp,产物经1%琼脂糖凝胶电泳,溴化乙啶(EB)染色,紫外灯下观察结果并拍照保存,用相关软件测量灰度值进行数据分析,以目的基因与β-actin的比值表示该目的基因的相对含量,对其进行半定量分析。
1.6 Western bolt检测多种蛋白的表达变化
取肝癌细胞和正常细胞铺于6孔板中,按以上方法加入适量病毒,分别于感染24、48、72 h后,按不同时段收集细胞悬浮于裂解液并进行Bradford法蛋白定量。配制8%~15%的SDS-PAGE凝胶电泳板,每孔加50 μg蛋白样品,100 V电泳2 h,聚偏氟乙烯(PVDF)转膜,5%脱脂奶粉封闭后,再分别加入相应的一抗,4 ℃孵育过夜,漂洗后加入辣根过氧化物酶标记的二抗,室温孵育2 h,漂洗后加入DAB显色,凝胶成像测灰度值行数据分析。
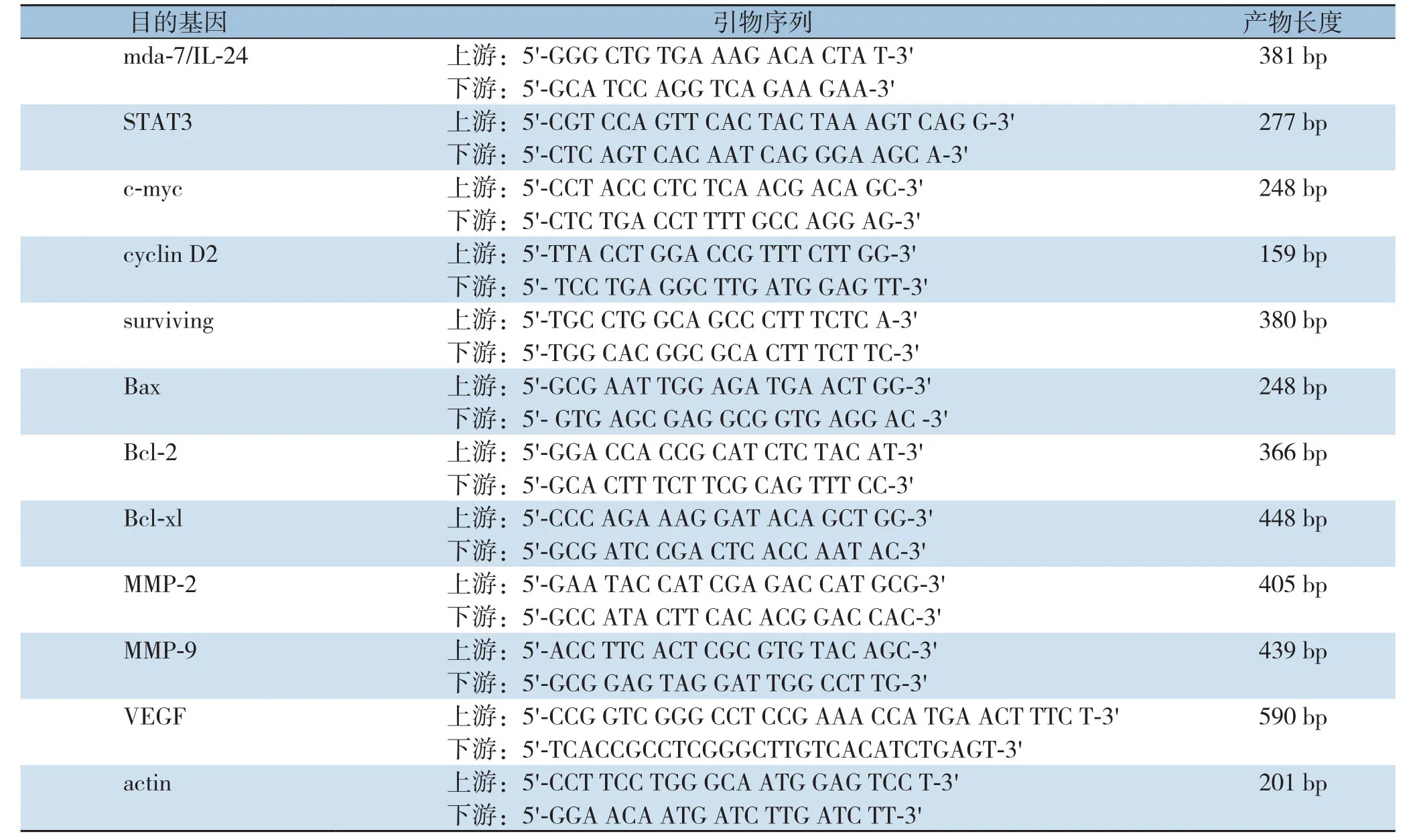
表1 基因的引物序列Table1 The primer sequences
1.7 统计学处理
数据以均数±标准差(±s)表示,用SPSS 14.0统计软件处理。组间比较采用单向方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 溶瘤腺病毒病毒克隆的鉴定
光镜观察:可见感染后的HEK293细胞特征性CPE,细胞变大、变圆、漂浮,呈葡萄串聚集。PCR鉴定:取病毒DNA各2 μL为模板,通过PCR方法扩增出约640 bp的特异性片段,其大小与阳性对照相符,而阴性对照则无片段扩增,表明所得的腺病毒即为携带人mda-7/IL-24基因的溶瘤腺病毒SG600-IL24(图1)。
2.2 纯化后病毒上清的滴度测定
溶瘤腺病毒S G 600-I L 24可在H E K 293细胞中大量扩增,裂解细胞后收取病毒液,经CsCl密度梯度离心,可获高浓度、高纯度的灰白色病毒带,TCID50测定法测得纯化后病毒滴度为2.25×1010PFU/mL,SG600-EGFP滴度为2.79×1010PFU/mL。
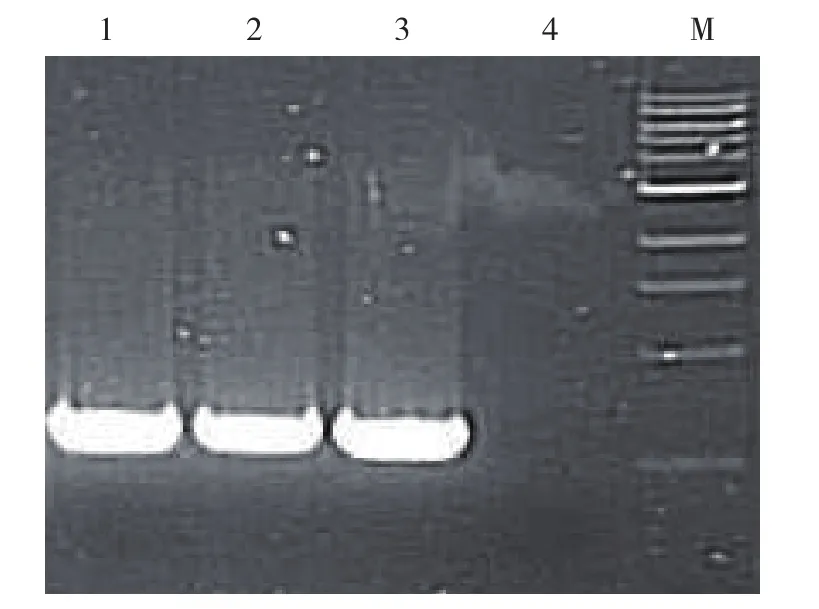
图1 溶瘤腺病毒的PCR鉴定 M:100 bp DNA阶梯;1:阳性对照(SG600-IL24质粒);2、3:SG600-IL24病毒;4:阴性对照Figure1 PCR identification of oncolyic adenovirus M:100 bp DNA Ladder; 1:Positive control (SG600-IL24 plasmid); 2, 3:SG600-IL24 adenovirus; 4:Negative control
2.3 RT-PCR检测结果
RT-PCR检测结果显示,肝癌细胞HepG2、HCCLM3和正常肝细胞L02均有mda-7/IL-24基因的表达,而SG600-EGFP组和对照组没有发现mda-7/IL-24基因的表达。肝癌细胞HepG2和HCCLM3在感染SG600-IL24后的不同时间点STAT3及其下游的信号通路基因survivin、c-myc、Bax、Bcl-2、Bcl-xl、cyclin D2、MMP-2、MMP-9和VEGF发生一系列的变化,除Bax随时间的延长表达逐步增强外,其余STAT3及其下游的信号通路基因表达均下调,随着感染时间的延长,基因表达逐步下降(部分P<0.05),而正常肝细胞L02无上述的改变(均P>0.05)(图2)(表2)。
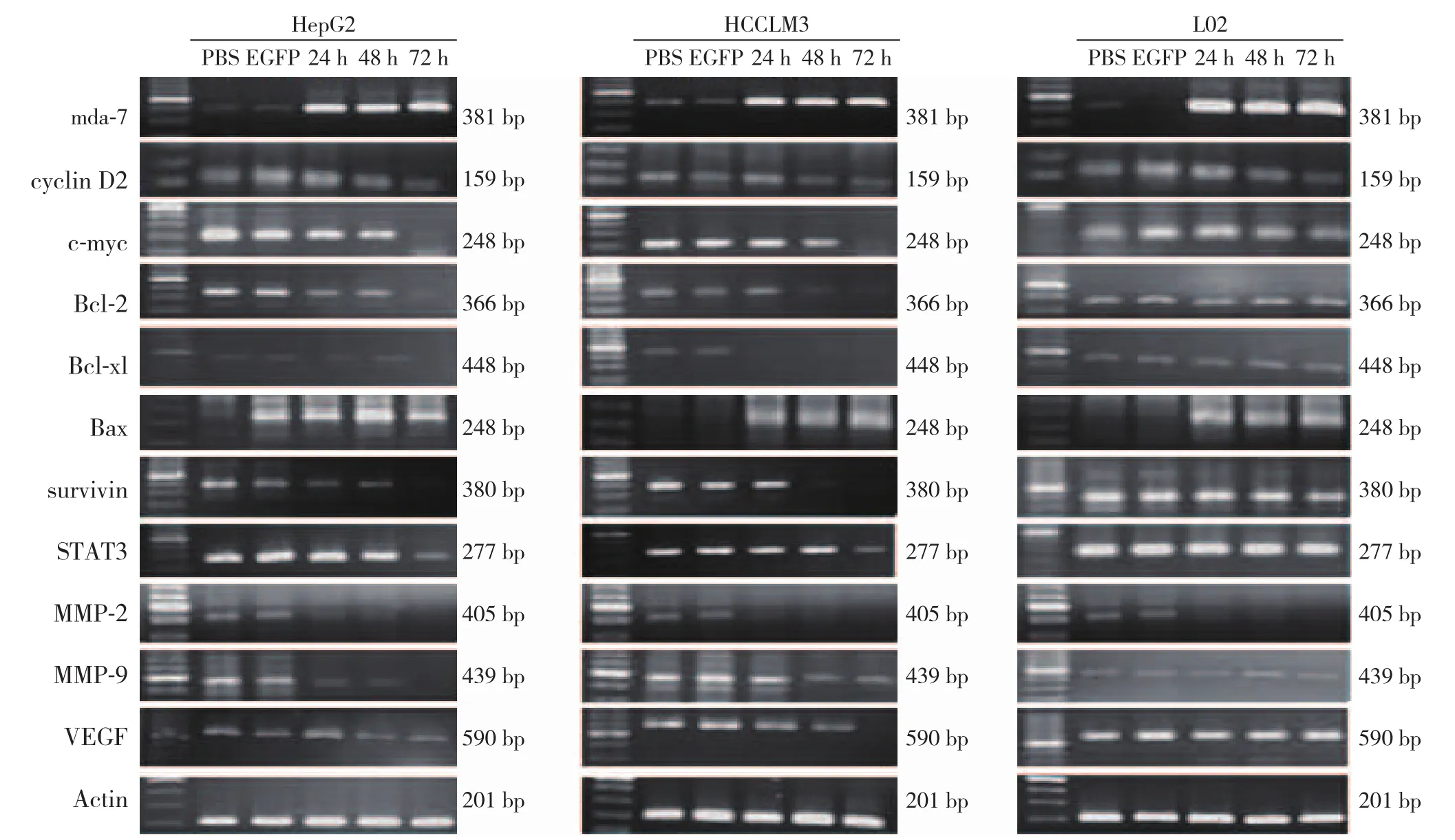
图2 SG600-IL24感染后mda-7/IL-24、STAT3及下游信号通路相关基因的表达Figure2 Gene expressions of mda-7/IL-24, STAT3 and the its downstream signaling molecules after SG600-IL24 infection
表2 SG600-IL24感染后mda-7/IL-24、STAT3及下游信号通路相关基因mRNA相对表达量(±s)Table2 Relative mRNA expression levels of mda-7/IL-24, STAT3 and the its s downstream signaling molecules after SG600-IL24 infection (±s)
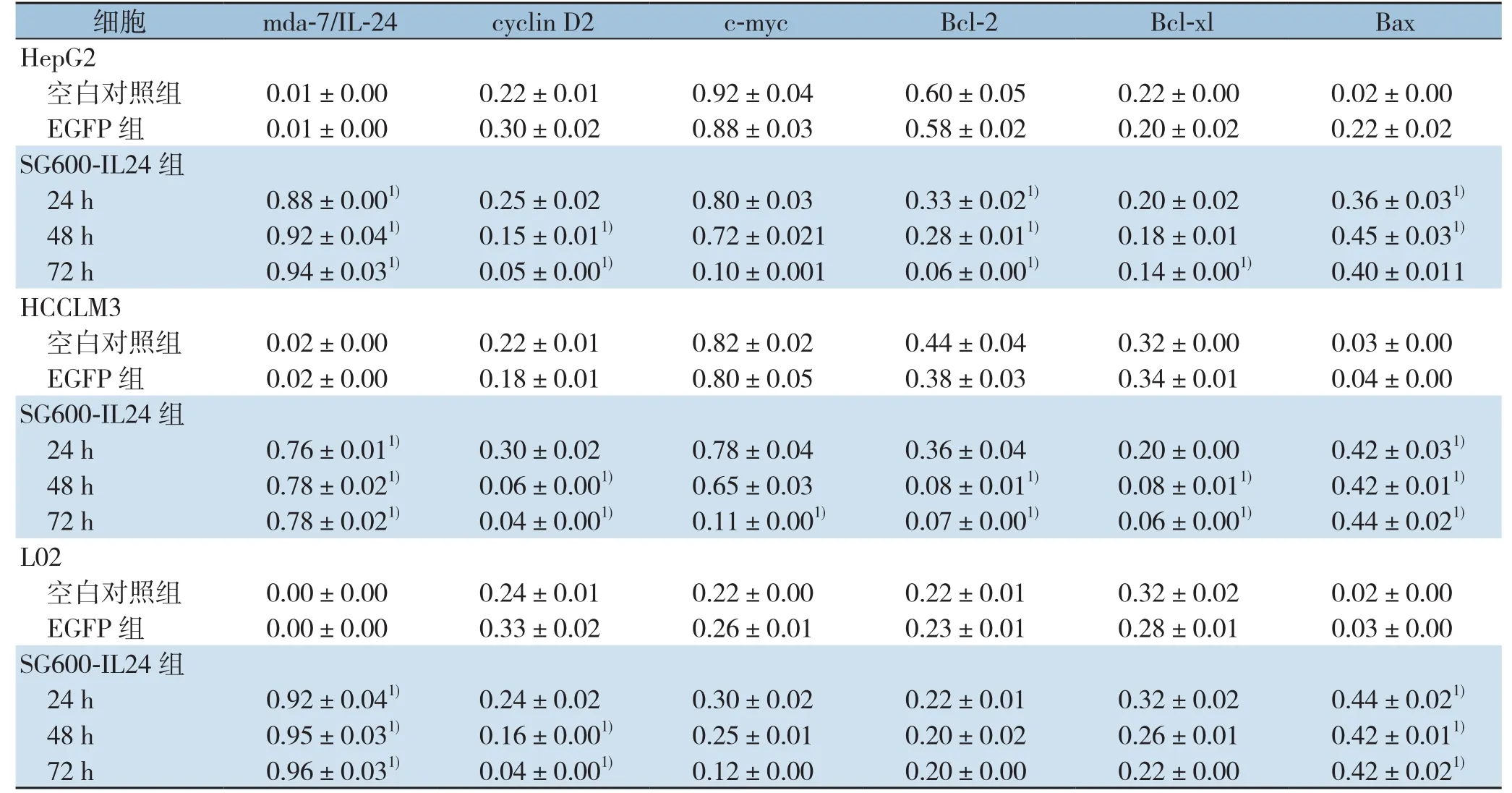
表2 SG600-IL24感染后mda-7/IL-24、STAT3及下游信号通路相关基因mRNA相对表达量(±s)Table2 Relative mRNA expression levels of mda-7/IL-24, STAT3 and the its s downstream signaling molecules after SG600-IL24 infection (±s)
注:1)与空白对照组比较,P<0.05Note:1) P<0.05 vs. blank control group
细胞 mda-7/IL-24 cyclin D2 c-myc Bcl-2 Bcl-xl Bax HepG2空白对照组 0.01±0.000.22±0.010.92±0.040.60±0.050.22±0.000.02±0.00 EGFP 组 0.01±0.000.30±0.020.88±0.030.58±0.020.20±0.020.22±0.02 SG600-IL24组24 h 0.88±0.001) 0.25±0.020.80±0.030.33±0.021) 0.20±0.020.36±0.031)48 h 0.92±0.041) 0.15±0.011) 0.72±0.0210.28±0.011) 0.18±0.010.45±0.031)72 h 0.94±0.031) 0.05±0.001) 0.10±0.0010.06±0.001) 0.14±0.001) 0.40±0.011 HCCLM3空白对照组 0.02±0.000.22±0.010.82±0.020.44±0.040.32±0.000.03±0.00 EGFP 组 0.02±0.000.18±0.010.80±0.050.38±0.030.34±0.010.04±0.00 SG600-IL24组24 h 0.76±0.011) 0.30±0.020.78±0.040.36±0.040.20±0.000.42±0.031)48 h 0.78±0.021) 0.06±0.001) 0.65±0.030.08±0.011) 0.08±0.011) 0.42±0.011)72 h 0.78±0.021) 0.04±0.001) 0.11±0.001) 0.07±0.001) 0.06±0.001) 0.44±0.021)L02空白对照组 0.00±0.000.24±0.010.22±0.000.22±0.010.32±0.020.02±0.00 EGFP 组 0.00±0.000.33±0.020.26±0.010.23±0.010.28±0.010.03±0.00 SG600-IL24组24 h 0.92±0.041) 0.24±0.020.30±0.020.22±0.010.32±0.020.44±0.021)48 h 0.95±0.031) 0.16±0.001) 0.25±0.010.20±0.020.26±0.010.42±0.011)72 h 0.96±0.031) 0.04±0.001) 0.12±0.000.20±0.000.22±0.000.42±0.021)
表2 SG600-IL24感染后mda-7/IL-24、STAT3及下游信号通路相关基因mRNA相对表达量(±s) (续)Table2 Relative mRNA expression levels of mda-7/IL-24, STAT3 and the its s downstream signaling molecules after SG600-IL24 infection (±s) (continued)
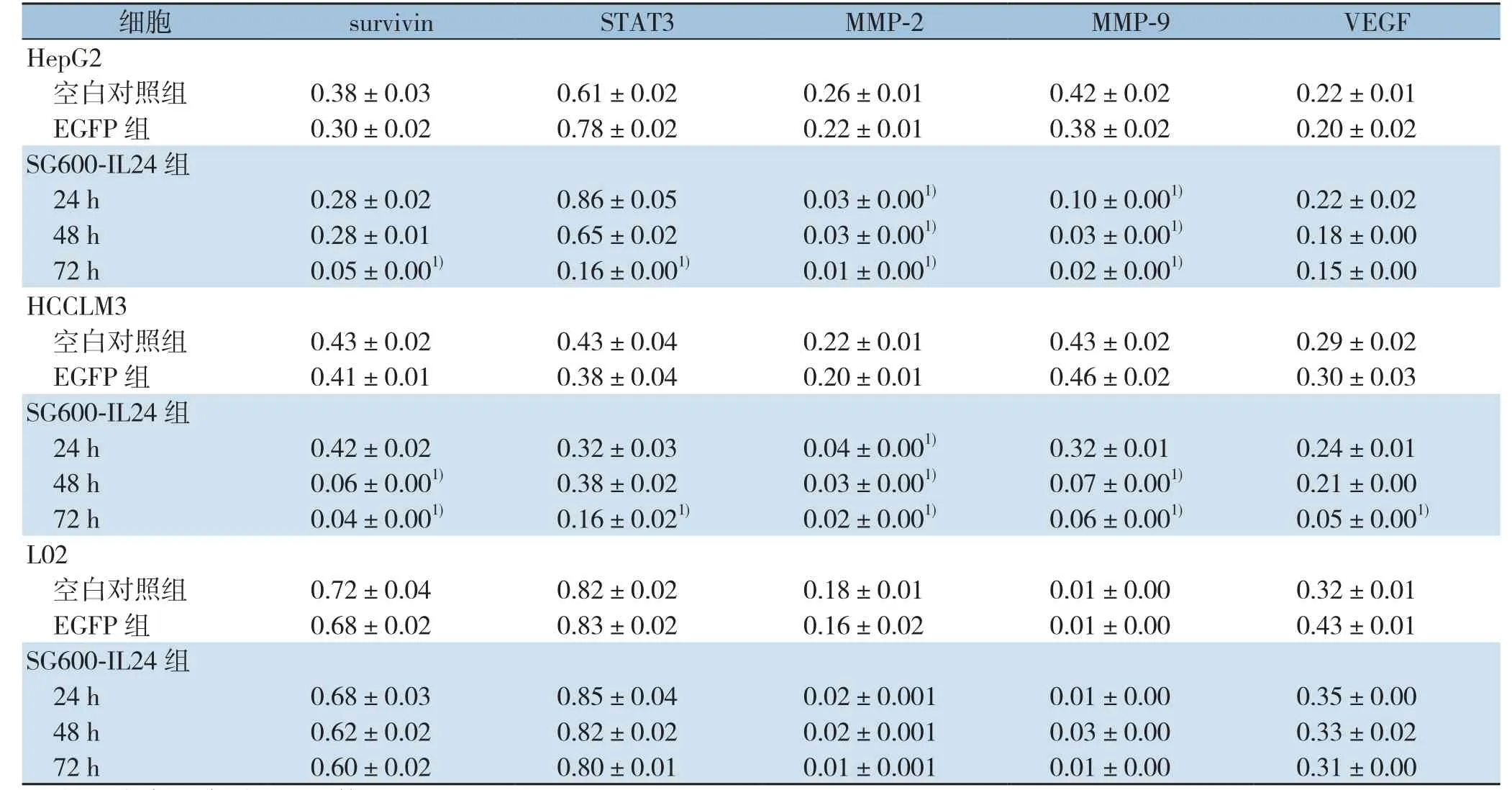
表2 SG600-IL24感染后mda-7/IL-24、STAT3及下游信号通路相关基因mRNA相对表达量(±s) (续)Table2 Relative mRNA expression levels of mda-7/IL-24, STAT3 and the its s downstream signaling molecules after SG600-IL24 infection (±s) (continued)
注:1)与空白对照组比较,P<0.05Note:1) P<0.05 vs. blank control group
细胞 survivin STAT3 MMP-2 MMP-9 VEGF HepG2空白对照组 0.38±0.030.61±0.020.26±0.010.42±0.020.22±0.01 EGFP 组 0.30±0.020.78±0.020.22±0.010.38±0.020.20±0.02 SG600-IL24组24 h 0.28±0.020.86±0.050.03±0.001) 0.10±0.001) 0.22±0.0248 h 0.28±0.010.65±0.020.03±0.001) 0.03±0.001) 0.18±0.0072 h 0.05±0.001) 0.16±0.001) 0.01±0.001) 0.02±0.001) 0.15±0.00 HCCLM3空白对照组 0.43±0.020.43±0.040.22±0.010.43±0.020.29±0.02 EGFP 组 0.41±0.010.38±0.040.20±0.010.46±0.020.30±0.03 SG600-IL24组24 h 0.42±0.020.32±0.030.04±0.001) 0.32±0.010.24±0.0148 h 0.06±0.001) 0.38±0.020.03±0.001) 0.07±0.001) 0.21±0.0072 h 0.04±0.001) 0.16±0.021) 0.02±0.001) 0.06±0.001) 0.05±0.001)L02空白对照组 0.72±0.040.82±0.020.18±0.010.01±0.000.32±0.01 EGFP 组 0.68±0.020.83±0.020.16±0.020.01±0.000.43±0.01 SG600-IL24组24 h 0.68±0.030.85±0.040.02±0.0010.01±0.000.35±0.0048 h 0.62±0.020.82±0.020.02±0.0010.03±0.000.33±0.0272 h 0.60±0.020.80±0.010.01±0.0010.01±0.000.31±0.00
2.4 Western blot检测结果
在感染SG600-IL24的3个时间点,肝癌细胞HepG2、HCCLM3和正常肝细胞L02都有mda-7/IL-24蛋白的表达,而SG600-EGFP组和对照组细胞中,未发现mda-7/IL-24蛋白的表达。HepG2和HCCLM3在分别感染24、48、72 h后STAT3及其下游的信号通路蛋白survivin、c-myc、Bax、Bcl-2、Bcl-xl、cyclin D2、OPN、XIAP、MMP-2和VEGF发生一系列的变化,除Bax蛋白随时间的延长表达逐步增强外,其余STAT3及其下游的信号通路蛋白表达均下调,随着感染时间的延长,蛋白表达逐步下降(部分P<0.05),而正常肝细胞L02无上述改变(均P>0.05)(图3)(表3)。
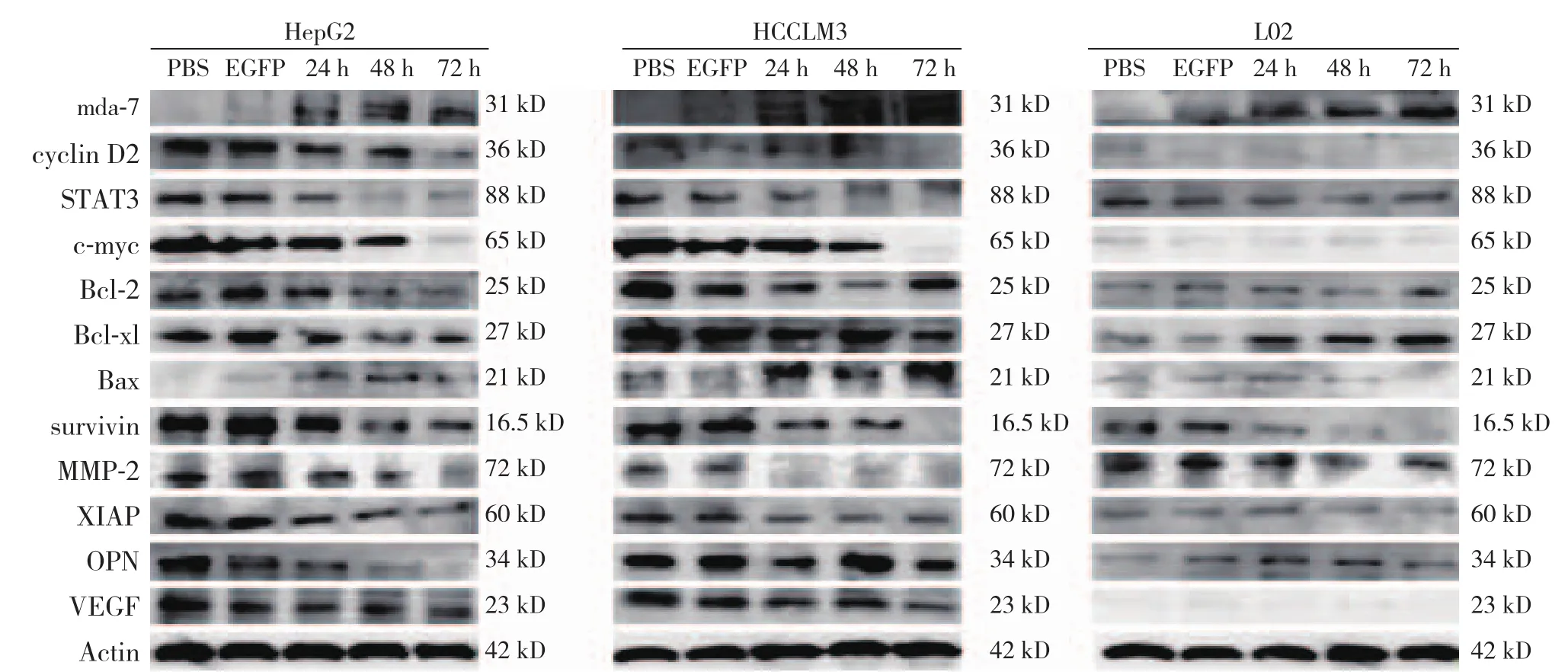
图3 SG600-IL24感染后mda-7/IL-24、STAT3及下游信号通路相关蛋白的表达Figure3 Protein expressions of mda-7/IL-24, STAT3 and the its downstream signaling molecules after SG600-IL24 infection
表3 mda-7/IL-24、STAT3及下游信号通路相关蛋白相对表达量(±s)Table3 Relative protein expression levels of mda-7/IL-24, STAT3 and the its s downstream signaling molecules after SG600-IL24 infection (±s)
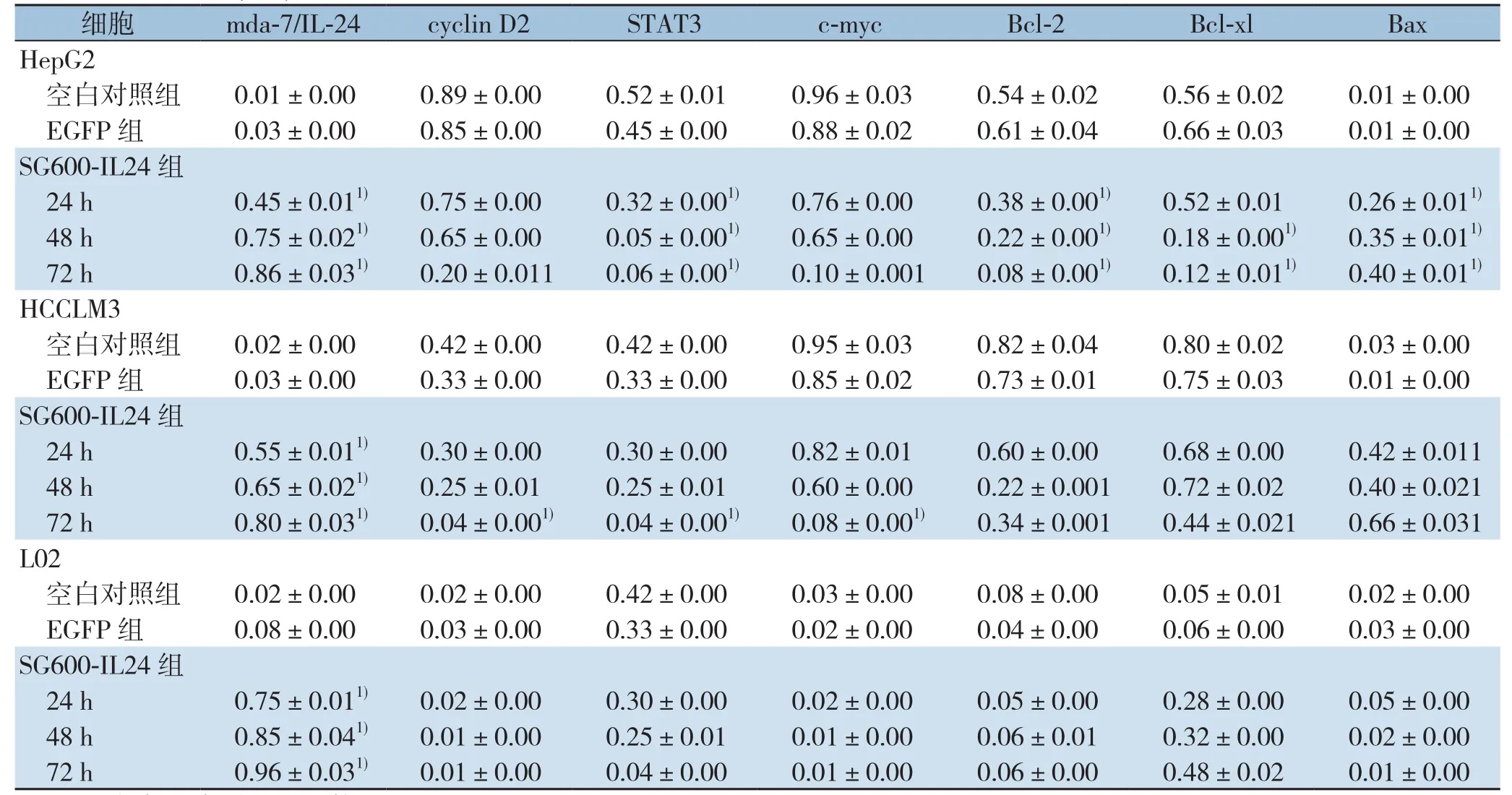
表3 mda-7/IL-24、STAT3及下游信号通路相关蛋白相对表达量(±s)Table3 Relative protein expression levels of mda-7/IL-24, STAT3 and the its s downstream signaling molecules after SG600-IL24 infection (±s)
注:1)与空白对照组比较,P<0.05Note:1) P<0.05 vs. blank control group
细胞 mda-7/IL-24 cyclin D2 STAT3 c-myc Bcl-2 Bcl-xl Bax HepG2空白对照组 0.01±0.000.89±0.000.52±0.010.96±0.030.54±0.020.56±0.020.01±0.00 EGFP 组 0.03±0.000.85±0.000.45±0.000.88±0.020.61±0.040.66±0.030.01±0.00 SG600-IL24组24 h 0.45±0.011) 0.75±0.000.32±0.001) 0.76±0.000.38±0.001) 0.52±0.010.26±0.011)48 h 0.75±0.021) 0.65±0.000.05±0.001) 0.65±0.000.22±0.001) 0.18±0.001) 0.35±0.011)72 h 0.86±0.031) 0.20±0.0110.06±0.001) 0.10±0.0010.08±0.001) 0.12±0.011) 0.40±0.011)HCCLM3空白对照组 0.02±0.000.42±0.000.42±0.000.95±0.030.82±0.040.80±0.020.03±0.00 EGFP 组 0.03±0.000.33±0.000.33±0.000.85±0.020.73±0.010.75±0.030.01±0.00 SG600-IL24组24 h 0.55±0.011) 0.30±0.000.30±0.000.82±0.010.60±0.000.68±0.000.42±0.01148 h 0.65±0.021) 0.25±0.010.25±0.010.60±0.000.22±0.0010.72±0.020.40±0.02172 h 0.80±0.031) 0.04±0.001) 0.04±0.001) 0.08±0.001) 0.34±0.0010.44±0.0210.66±0.031 L02空白对照组 0.02±0.000.02±0.000.42±0.000.03±0.000.08±0.000.05±0.010.02±0.00 EGFP 组 0.08±0.000.03±0.000.33±0.000.02±0.000.04±0.000.06±0.000.03±0.00 SG600-IL24组24 h 0.75±0.011) 0.02±0.000.30±0.000.02±0.000.05±0.000.28±0.000.05±0.0048 h 0.85±0.041) 0.01±0.000.25±0.010.01±0.000.06±0.010.32±0.000.02±0.0072 h 0.96±0.031) 0.01±0.000.04±0.000.01±0.000.06±0.000.48±0.020.01±0.00
表3 mda-7/IL-24、STAT3及下游信号通路相关蛋白相对表达量(±s)(续)Table3 Relative protein expression levels of mda-7/IL-24, STAT3 and the its s downstream signaling molecules after SG600-IL24 infection (±s) (continued)
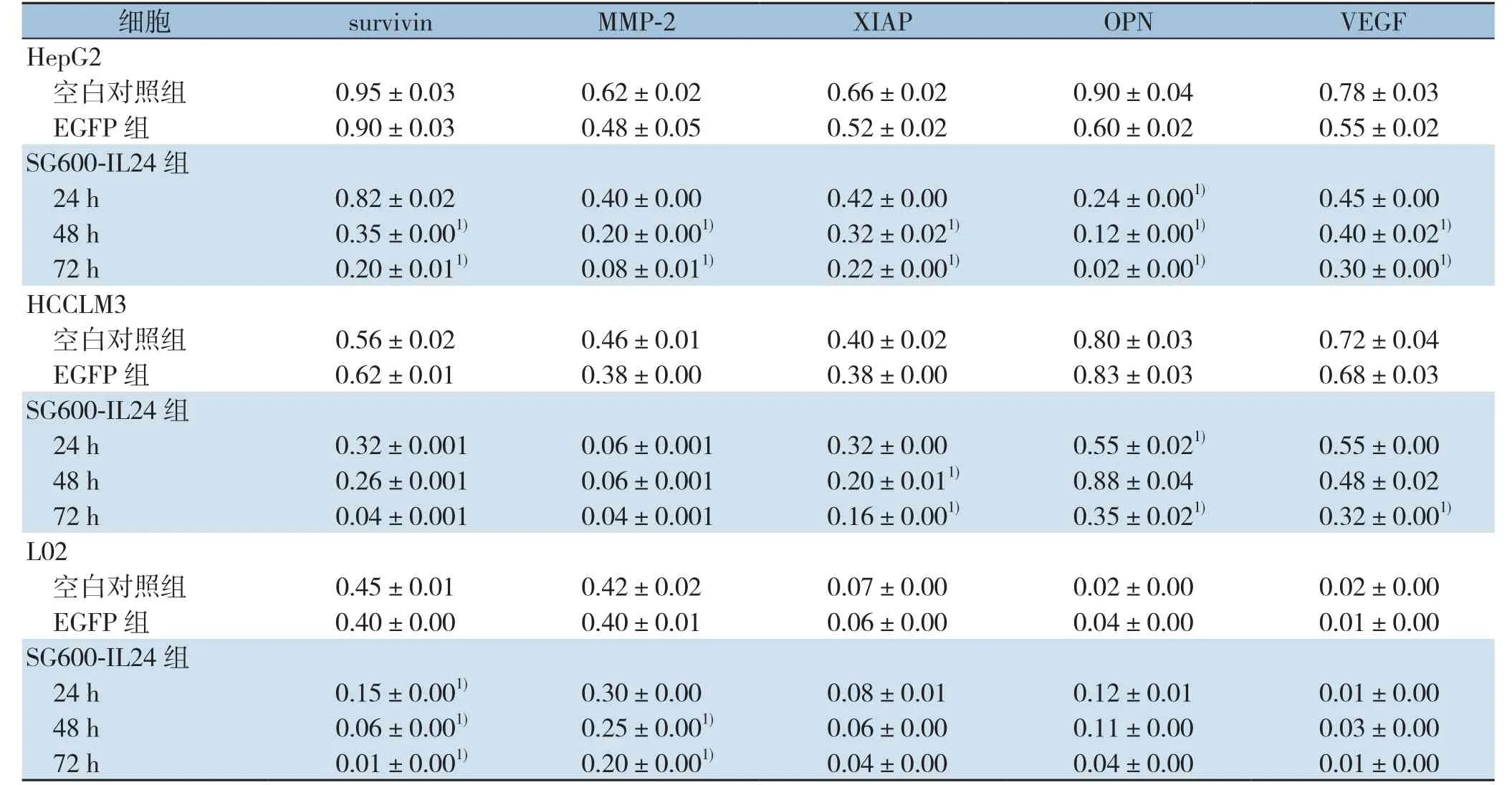
表3 mda-7/IL-24、STAT3及下游信号通路相关蛋白相对表达量(±s)(续)Table3 Relative protein expression levels of mda-7/IL-24, STAT3 and the its s downstream signaling molecules after SG600-IL24 infection (±s) (continued)
注:1)与空白对照组比较,P<0.05Note:1) P<0.05 vs. blank control group
细胞 survivin MMP-2 XIAP OPN VEGF HepG2空白对照组 0.95±0.030.62±0.020.66±0.020.90±0.040.78±0.03 EGFP 组 0.90±0.030.48±0.050.52±0.020.60±0.020.55±0.02 SG600-IL24组24 h 0.82±0.020.40±0.000.42±0.000.24±0.001) 0.45±0.0048 h 0.35±0.001) 0.20±0.001) 0.32±0.021) 0.12±0.001) 0.40±0.021)72 h 0.20±0.011) 0.08±0.011) 0.22±0.001) 0.02±0.001) 0.30±0.001)HCCLM3空白对照组 0.56±0.020.46±0.010.40±0.020.80±0.030.72±0.04 EGFP 组 0.62±0.010.38±0.000.38±0.000.83±0.030.68±0.03 SG600-IL24组24 h 0.32±0.0010.06±0.0010.32±0.000.55±0.021) 0.55±0.0048 h 0.26±0.0010.06±0.0010.20±0.011) 0.88±0.040.48±0.0272 h 0.04±0.0010.04±0.0010.16±0.001) 0.35±0.021) 0.32±0.001)L02空白对照组 0.45±0.010.42±0.020.07±0.000.02±0.000.02±0.00 EGFP 组 0.40±0.000.40±0.010.06±0.000.04±0.000.01±0.00 SG600-IL24组24 h 0.15±0.001) 0.30±0.000.08±0.010.12±0.010.01±0.0048 h 0.06±0.001) 0.25±0.001) 0.06±0.000.11±0.000.03±0.0072 h 0.01±0.001) 0.20±0.001) 0.04±0.000.04±0.000.01±0.00
2.5 STAT3蛋白磷酸化检测结果
p-STAT3在SG600-IL24分别感染0、5、30、60、120、240 min后,表达水平先上升后下降,在感染2 h达到峰值,HepG2、HCCLM3蛋白相对表达量分别为1.35±0.12、0.88±0.06,而STAT3在此时间段却变化不明显。正常肝细胞STAT3及p-STAT3蛋白变化均不明显(图4)。
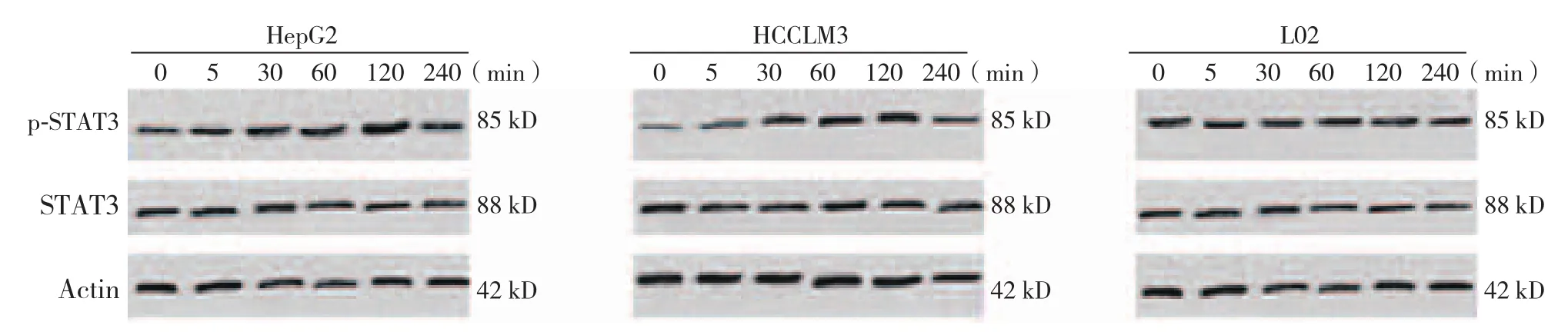
图4 SG600-IL24干预后STAT3及p-STAT3蛋白的表达Figure4 Expressions of STAT 3 and p-STAT3 protein after SG600-IL24 infection
3 讨 论
目前肝癌的基因治疗方法较多,但多数方法在杀伤肿瘤细胞的同时也杀伤正常细胞,即不具肿瘤特异性,因而限制了其临床应用。因此,探寻既可选择性杀伤肿瘤细胞同时又不影响正常细胞的治疗性基因已成为肿瘤基因治疗的研究热点。溶瘤病毒和基因治疗研究的不断深入促进了基因病毒疗法的发展,这种疗法利用携带抗癌基因的溶瘤腺病毒在肿瘤细胞内的特异性增殖及复制的特性,使抗癌基因的拷贝数大量增加,从而数百倍乃至上万倍地提高抗癌基因的表达水平,最终杀灭肿瘤细胞,达到治疗的目的[9]。本研究采用端粒酶反转录酶基因启动子(TERTp)和缺氧基因启动子HRE来分别调控病毒复制必须基因E1A和E1B的表达,同时去除了E1A区与Rb蛋白结合的区域,使病毒只能在肿瘤细胞内复制,比非溶瘤型的腺病毒Ad.mda-7效果要好,同时具备肿瘤特异性,课题组前期的研究[10]工作做过证实。我们构建的SG600-IL24腺病毒正是应用以上的策略来达到在肿瘤细胞内特异性复制的目的,对正常细胞影响很小,从而提高其有效性和安全性[11]。
酪氨酸激酶(JAK)家族和信号转导子和转录激活子家族(STAT家族)在不同的信号转导通路方面发挥了重要的作用,参与了细胞增值,分化,生存和凋亡等[12]。大量的研究结果证明STAT家族,尤其是信号转导子和转录激活子STAT3,被认为是原癌基因,STAT3在很多人类肿瘤中被异常激活,包括肝癌,淋巴瘤,多种骨髓瘤,前列腺癌,乳腺癌,肺癌,头颈部肿瘤,卵巢癌,胃癌等,STAT3信号通路已经成了研究抗肿瘤基因治疗的靶点[13-17]。基因表达的变化包括STAT3的持续激活代表着关键的分子事件,导致了细胞周期调控和凋亡的失衡,于是促进了肿瘤细胞的增生并大量繁殖,大量异型细胞的形成,最后导致肿瘤发生。影响STAT3持续激活的基因很多,其中包括细胞周期调节蛋白,如cyclin D1[18]和cyclin D2[19]等。STAT3基因的持续激活也会上调生存相关因子,Bcl-2、Bcl-xl和Mcl-1,凋亡抑制家族成员,survivin[20]和XIAP[21]等,另外还有诱导肿瘤血管生成的因子,如VEGF[22-24]等。STAT3在STAT家族7个成员中特别引起人们关注,因为STAT3被看作是恶性肿瘤治疗的有效靶点。在恶性肿瘤细胞中抑制STAT3的持续激活已经显示出了能抑制肿瘤细胞的生长并诱导凋亡的发生。另外,细胞周期调节蛋白也被认为是调节STAT3活性的信号转录子,基于上述的理论基础,我们观察溶瘤腺病毒SG600-IL24在STAT3信号传导方面所发挥的重要作用,探讨其下游的信号通路抗凋亡的机理。
本实验运用溶瘤腺病毒SG600-IL24干预肝癌细胞,实验结果表明溶瘤腺病毒SG600-IL24能抑制STAT3以及信号通路下游信号分子的基因和蛋白表达水平,SG600-IL24能抑制肿瘤细胞的生长,促进肿瘤细胞的凋亡,并且对正常肝细胞没有明显的影响。研究结果也发现异常的STAT3在促进肝癌细胞生存,促进其异型性方面发挥了重要的作用,结果提示STAT3以及信号通路下游信号分子c-myc、Bcl-xl、Bcl-2、cyclin D2、survivin、MMP-2、MMP-9、XIAP、OPN和VEGF基因和蛋白的表达水平均下调,随着感染时间的延长,基因和蛋白表达水平逐步下降,而Bax随时间的延长基因和蛋白表达逐步增强,磷酸化STAT3蛋白在感染后先上升后下降,在感染2 h达到峰值,而正常肝细胞L02却没有上述的变化。以前有研究[25]提示mda-7/IL-24选择性杀伤黑色素瘤细胞是通过IL-20受体依赖途径介导而不依赖于STAT3信号通路,然而,本研究利用溶瘤腺病毒SG600-IL24干预治疗肝癌细胞却发现SG600-IL24抗肿瘤的活性是通过抑制STAT3的活性来促进肿瘤细胞的凋亡,并抑制肿瘤的转移。研究结果表明内源性的STAT3下降的非常明显,提示溶瘤腺病毒SG600-IL24很可能通过抑制肝癌细胞STAT3信号通路,最终导致肝癌细胞的凋亡。
综上所述,本研究揭示了溶瘤腺病毒SG600-IL24选择性杀伤肝癌细胞的机制,结果表明异常的STAT3和其在促进肝癌细胞生长和异型性方面发挥了重要的作用。溶瘤腺病毒SG600-IL24可能通过抑制STAT3及下游的信号通路的基因和蛋白来达到抑癌的作用,而正常肝细胞几乎不受此影响,使得溶瘤腺病毒SG600-IL24具有显著的选择性抗肿瘤效应。所以可以预见,溶瘤腺病毒SG600-IL24将会是一种有效的抗肿瘤治疗的手段,未来的病毒基因治疗将在临床上将发挥越来越关键的作用。
