慢性脑缺血与表观遗传学关系的研究进展
2019-03-08余能伟
杨 旭,余能伟
(1.西南医科大学临床医学院,四川 泸州 646000;2.四川省医学科学院·四川省人民医院神经内科,四川 成都 610072)
随着我国人口老龄化进展,脑血管疾病的发病率逐渐增高,居于我国疾病发病前列。目前中国心血管病人数2.9亿,其中脑卒中1300万,居于首位,2003~2015年中国脑血管病死亡率呈上升趋势,农村地区高于城市地区[1],可见脑血管疾病严重加重了我国疾病负担。在我国最新版《中国脑血管疾病分类2015》中,新增的慢性脑缺血疾病分类引起广泛关注。对于缺血性脑血管事件而言,急性脑卒中起病急骤,易被发现且更受重视,但易导致严重临床不良结局发生,慢性脑缺血起病隐匿,易受忽视,最终可发展为急性脑卒中、阿尔茨海默病等,但慢性脑缺血属于可逆性疾病,因此在疾病早期给予干预可预防疾病进一步发展。
1 慢性脑缺血
慢性脑缺血作为独立的疾病诊断长期存在争议,2017年中华医学会神经病学分会脑血管病学组正式发布《中国脑血管疾病分类2015》标准,其中专门增加了慢性脑缺血(chronic cerebral hypoperfusion,CCH)这一疾病类型,并提出慢性脑缺血为脑整体水平血液供应减少状态[脑血流量25~45 ml/(100 g·min)]而非局灶性的脑缺血。患者多为老年人,常感觉头重、头晕、头痛,除有动脉硬化或脑动脉狭窄外,无局灶性神经系统缺损的症状和体征,也无颅脑影像学异常(即无结构性改变)[2],但在疾病分类中尚未提出慢性脑缺血诊断标准,故临床诊断仍存在一定争议。2018年9月,北京中西医结合学会卒中专业委员会发布《慢性脑缺血中西医诊疗专家共识》[3],建议将慢性脑缺血的定义概况为:由于长期的血管病变或循环障碍所导致的脑供血减少,因失代偿而引发的一系列临床综合征,患者症状出现时间一般在失代偿后3个月以上,可持续存在或间断性发作。并综合国内外学者提出的诊断标准提出临床诊断标准为:①患者年龄原则上大于60岁;起病隐袭,病程长,病史一般超过3个月;症状可程波动性。②具有慢性脑功能不全的表现。如头晕、头昏、头胀痛,记忆力减退,反应迟钝,注意力不集中,情绪不稳定,工作能力减退,睡眠障碍及情绪障碍等。③具有脑血管病危险因素,如高血压病、糖尿病、血脂异常和冠心病病史。④无脑部的局灶神经系统体征。⑤实验室检查:存在支持脑动脉硬化的证据;眼动脉、颞动脉、桡动脉等周围动脉硬化表现,或可闻及脑灌注动脉的血管杂音;脑血管检查可发现脑动脉狭窄或梗阻性病变的证据。⑥头CTA/MRI无血管性器质性脑改变。⑦脑灌注影像检查证实存在脑部低灌注,建议将CTP及PWI作为诊断的基本条件,以充实慢性脑缺血诊断的准确性。⑧排除其他可导致相关临床症状的神经、精神疾病;排除相关疾病如癔病、焦虑躯体化障碍、抑郁及各种变性病或主观性头晕等引起的慢性脑功能不全。
慢性脑缺血时因血管狭窄或血液动力学、血液流变学等因素导致脑血流量降低而出现脑慢性缺血缺氧改变。正常脑血流量约为50~55 ml/(100 g·min);当脑血流量减少至40 ml/(100 g·min)可导致脑中葡萄糖利用障碍;当脑血流量降至<30 ml/(100 g·min)时会出现蛋白质合成障碍;当脑血流量降至25~10 ml/(100 g·min)时,神经元活动开始丧失,神经功能障碍,但是仍然没有神经元永久性损伤。然而,当脑血流量低于8 ml/(100 g·min)时,可出现细胞膜破坏导致细胞死亡以及永久性神经坏死[4]。新版脑血管疾病分类将慢性脑缺血血液供应减少定为25~45 ml/(100 g·min)可引起葡萄糖利用及蛋白质合成障碍等。慢性脑缺血发病机制复杂[5~7],包括胶质细胞增殖活化、氧化应激反应、细胞凋亡、突触改变、神经递质紊乱等,针对发病机制给予干预,可更有效预防慢性脑缺血疾病进展。
2 表观遗传学
近年表观遗传学作为一门新兴学科逐渐成为研究热点,表观遗传是指DNA序列不发生变化,而基因表达发生可逆可遗传改变的现象。表观遗传修饰在正常生长发育及疾病中发挥重要作用,主要包括DNA甲基化、组蛋白修饰、非编码RNA调控等。
DNA甲基化修饰指在DNA甲基化转移酶(DNMTs)作用下将S-腺苷甲硫氨酸(SAM)作为甲基供体将甲基连接到胞嘧啶5位碳原子上形成5-甲基胞嘧啶(5 mc)的过程,主要发生于CpG二核苷酸位点,在不同生理过程及疾病阶段呈现动态变化[6],此时形成的5 mc在TET氧合酶家族(α-酮戊二酸和Fe2+依赖的双加氧酶)作用下依次将5-mc氧化为5-羟甲基胞嘧啶(5 hmc)、5-甲酰基胞嘧啶(5fc)、5-羧基胞嘧啶(5caC),最后5caC脱羧基为胞嘧啶完成循环(图1[7]),因此5 mc是DNA甲基化形式,而5 hmc、5fc、5caC为去甲基化过程的中间体[8]。继5-mc之后,新近发现的5-hmc逐渐进入人们视野,与5-mc在各组织中有稳定数量相比,5-hmc在各组织中差异较大,具有组织特异性。相关研究显示,5-hmc在胚胎干细胞及脑组织中的含量最高[9,10],可高达其余组织的10倍[11,12],且越来越多的研究提示5-hmc与许多神经系统疾病存在关联,其可以导致突触可塑性改变、少突胶质细胞异常,出现学习、记忆功能障碍等。
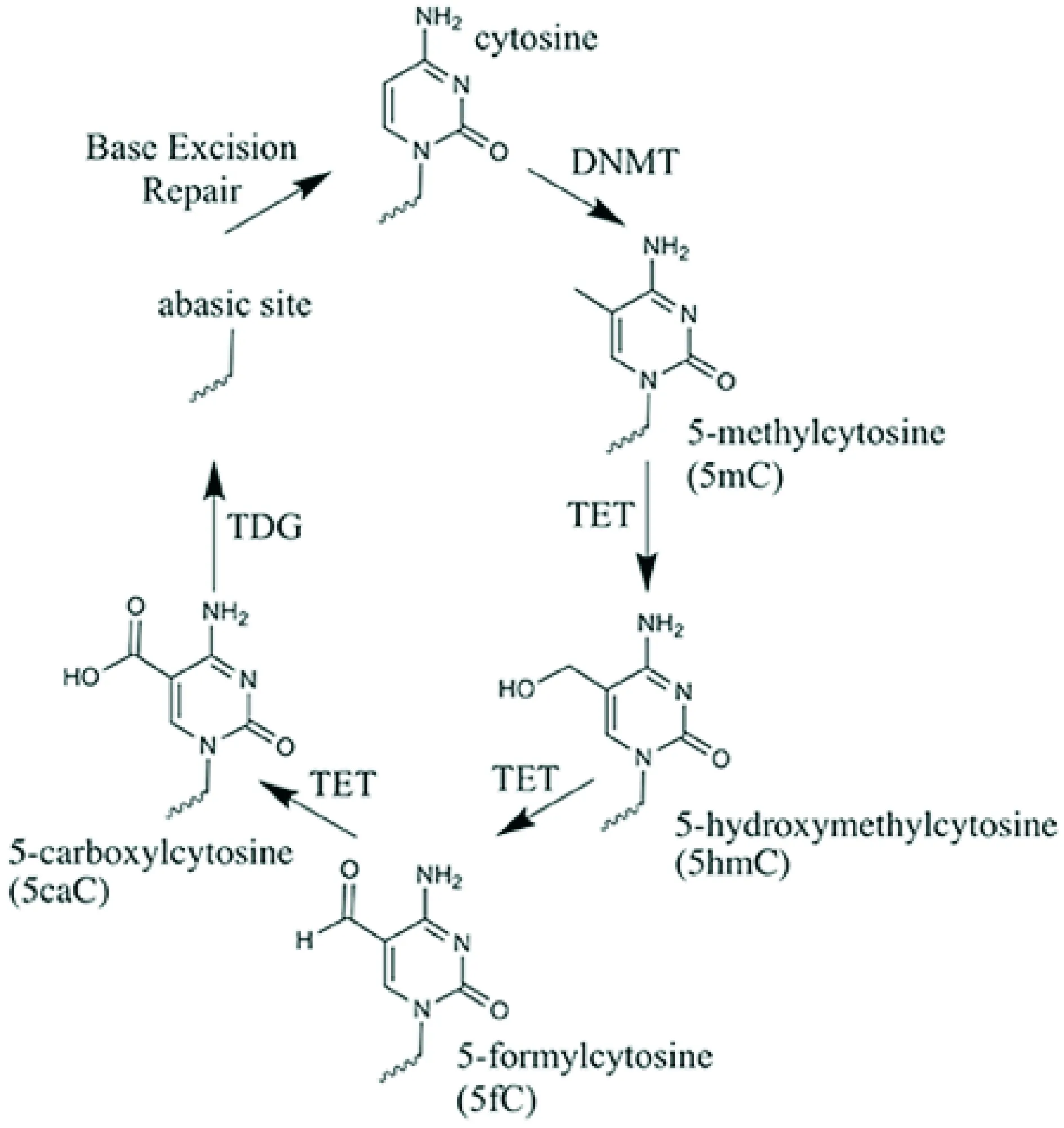
图1 胞嘧啶氧化循环
组蛋白修饰是指组蛋白在相关酶的作用下发生一系列修饰变化的过程。组蛋白作为核小体核心在基因转录过程中发挥重要作用,组蛋白尾部游离的N-端可接受各种各样的修饰,包括乙酰化、甲基化、磷酸化、泛素化、小类泛素化等[13],可影响染色质组装及凝集程度,其中相对研究较多的是组蛋白乙酰化过程。组蛋白乙酰化是由组蛋白乙酰化酶(HATs)和组蛋白去乙酰化酶(HDACs)两个酶系共同作用控制的动态过程,两者之间的平衡在基因表达调节和发育过程及疾病状态调控中发挥重要作用[14]。组蛋白乙酰化及去乙酰化异常可引起突出可塑性异常、长时程记忆形成障碍而出现学习、记忆功能障碍等神经系统相关症状[15]。有相关研究提示阿尔茨海默病、帕金森病等神经系统疾病中可出现组蛋白修饰改变[16],故对其研究可能将为某些神经系统功能变异或疾病的早期识别与治理提供理论依据。
非编码RNA[17,18]是指不能翻译为蛋白质的RNA分子,包括rRNA、tRNA、snRNA、snoRNA、microRNA等,其中microRNA研究最清楚。非编码RNA根据长度是否超过200 nt可分为长链非编码RNA(lncRNA)和短链非编码RNA(sncRNA)。RNA修饰通过调节基因表达可影响正常发育过程[19],这些修饰可在细胞状态转变期间控制转录物的转化或翻译,在组织发育及稳态中发挥重要作用。在中枢神经系统疾病中,非编码RNA在急性缺血性卒中、阿尔茨海默病、帕金森病、亨廷顿病等中发挥重要作用。急性缺血性卒中时[20,21]其可通过兴奋性毒性作用、氧化应激、神经炎性反应及细胞凋亡等作用可导致急性缺血性卒中患者第二次脑损伤并阻碍脑功能的恢复,在脑缺血及卒中后恢复中发挥重要作用。非编码RNA也可通过调节APP、BACE1表达及tau磷酸化等在阿尔茨海默病中发挥重要作用[22]。总体而言,非编码RNA种类繁多,功能特性复杂,随着基础研究的进行,其在疾病中的作用将会得到进一步挖掘。
3 慢性脑缺血与表观遗传
慢性脑缺血时,脑血流量慢性持续减少引起脑组织长期缺血缺氧,导致持续性神经退行性变,细胞应对缺氧反应时,表观遗传通过组蛋白修饰、DNA甲基化及相关酶学变化等调控低氧诱导转录因子(HIF)家族与转录靶点结合及稳定性[23],介导突触重塑,预防长时间暴露于低氧环境引起的兴奋性毒性神经退行性病变,改变突触递质[24]等发挥重要作用。
目前对于慢性脑缺血与表观遗传关系的研究主要集中在组蛋白修饰及DNA甲基化修饰,可影响全基因组DNA甲基化及组蛋白乙酰化从而影响基因转录[25,26]。通过结扎小鼠双侧颈总动脉模拟慢性脑缺血模型,在结扎术后10天的急性阶段,DNA甲基化(5 mc)首先呈现出甲基化水平降低的结果,随着缺血时间延长,全基因组5 mc表达水平逐渐升高,在术后90天,与假手术组相比,全基因组5 mc水平增加了54%,在术后180天,全基因组5 mc水平为假手术组两倍,同时伴随DNA甲基转移酶(DNMT3 a)水平降低及甲基结合蛋白(MBD2)水平升高。此外慢性脑缺血时,还出现组蛋白H3乙酰化及组蛋白去乙酰化酶(HDAC2)水平降低,组蛋白H4乙酰化水平无显著变化,而乙酰转移酶(HAT)水平升高[27],其具体原因尚未完全明了,需要更进一步研究完善。而不同的研究却提示慢性脑缺血时虽然全基因组5 mc水平升高,但某些特殊基因如APP、BACE1却呈低甲基化状态,同时出现DNMT3 a水平升高,组蛋白H4乙酰化水平升高,H3水平无显著变化,而补充DNA甲基供体S-腺苷甲硫氨酸(SAM)可通过上调乙酰胆碱及脑源性神经营养因子(BDNF)逆转上述改变从而逆转慢性脑缺血小鼠学习、记忆损害[28],故早期提供SAM可能成为慢性脑缺血治疗靶点。
5 hmc作为一种重要的表观遗传标志物,在慢性脑缺血中亦发挥重要作用,表现出升高趋势。慢性脑缺血与衰老及疾病导致的白质改变有关[29],白质5 hmc改变涉及小胶质细胞浸润和少突胶质前体细胞(OPCs),在慢性脑缺血动物模型中,模型鼠一月后胼胝体5 hmc阳性细胞、Iba1阳性炎性小胶质细胞、NG2阳性少突胶质前体细胞比例明显增高,5 hmc水平升高与炎性小胶质细胞增多有密切联系,因此5 hmc在小鼠慢性脑缺血中表现出白质束和细胞类型的特异性动态改变。在脑缺血再灌注损伤时,总5 hmc在损伤后24小时开始表达增加,随着时间延长表达逐渐增高,到48小时达到高峰,线粒体5 hmc亦明显增高,在24小时达高峰,随后逐渐略有降低,但仍高于假手术组。与5 hmc相比,总5 mc在缺血后36小时明显增加,而后随着时间延长表达逐渐下降,线粒体5 mc未见明显改变[30]。缺血性脑损伤时,也可出现TET2介导血液中5 hmc含量增加,在大脑中动脉闭塞小鼠模型中使用TET2抑制剂SC1减少TET2或敲除TET2可加重缺血性脑损伤[31]。可见在多种类型的脑缺血损伤中均可能出现5-hmc的改变。
表观遗传中非编码RNA亦在许多神经系统疾病表观遗传调控中发挥重要作用,多种类型的非编码RNA水平变化在慢性脑缺血导致的认知损害中占重要地位。多项研究表明非编码RNA主要通过调节APP、BACE1等表达,影响突触重塑、树突变性、神经元活性等在慢性脑缺血及脑缺血引起的痴呆中发挥作用。慢性脑缺血时,在血清、脑脊液、海马、皮质等区域可出现miR-9-5p、miR-96、miR-9等含量增加,通过增加BACE1及下调CREB含量引起学习记忆损害进一步发生痴呆,应用miR拮抗剂可减轻记忆损害等表现,且可挽救胆碱能神经元功能、神经元丢失、氧化应激、降低自噬体数量影响自噬过程等[32~34]。然而在神经系统尤其是海马及皮质中高表达的非编码RNA如miR-181c[35]在慢性脑缺血引起的低氧环境中出现表达降低,其高表达时可改善细胞活性及神经重塑,减少凋亡细胞数量。表明不同类型的非编码RNA在慢性脑缺血时出现差异性变化,最终均可导致学习记忆损害甚至认知功能障碍等。
4 问题及展望
慢性脑缺血时,由于脑组织缺血缺氧引起胶质细胞激活、炎性反应、神经递质紊乱等,长期持续性缺血缺氧可进一步导致能量衰竭、ATP耗尽以及大量活性氧系列(ROS)的产生从而导致神经元损伤,脑组织长期的这些改变可能引起表观遗传的变化,除此之外,引起慢性脑缺血众多的危险因素如高龄、吸烟、饮酒、高血压、糖尿病、高血脂等引发机体内环境改变也可能造成表观遗传的改变。因此在慢性脑缺血疾病进程中,究竟是脑缺血自身变化还是如年龄等危险因素的作用引起表观遗传改变需要进一步的研究探索。
表观遗传学作为一种可逆可遗传性基因表达改变在各种疾病中发挥重要作用。已有相关研究显示慢性脑缺血时表观遗传改变可引起学习、记忆损害,但目前对于两者关系的研究相对比较局限,主要集中在少量动物实验,尚缺乏临床研究,主要涉及对DNA甲基化及组蛋白修饰研究,且研究结果存在差异,而大部分表观遗传改变的具体机制尚未明了,需要更多的基础及临床试验证实两者关系。在以后的研究中,除了需要进一步完善相关动物实验更加明确两者之间的关系外,我们更需要进一步探索临床中慢性脑缺血患者表观遗传学变化情况,突破动物实验的局限性,为慢性脑缺血预防及治疗带来突破性进展。
