面包树果实凝集素的提取纯化及理化性质分析
2019-03-08张晓青杨愈丰
张晓青,施 青,杨愈丰*
1遵义医科大学珠海校区;2珠海市中药基础与应用研究重点实验室,珠海 519040
凝集素是一类能通过特异地结合碳水化合物而可逆地识别或附着于细胞表面的非酶蛋白质[1],广泛存在于动物、植物和微生物等多个物种。植物凝集素主要分布在植物的储藏器官和繁殖器官[2],可用于检测机体癌变过程中细胞表面糖基的变化[3,4],从而协助肿瘤的诊断和治疗[5]。另外,植物凝集素还可以用于阻碍病毒的再次感染[6,7],或者作为抗生素的有效辅助剂[8]。目前,凝集素已经是细胞生物学、免疫学乃至临床医学的重要检测或诊断工具。
FTL是一种能够特异性结合α-D-半乳糖的糖蛋白[9],主要来源于面包树果实籽,可以通过分离纯化获得[10]。FTL是一个四聚体分子,每个单体包含一个α链和一个β链,主要由β折叠构成形成四个糖结合位点,属于Jacalin家族[11,12],分子量大小为17.1 KD。研究表明,FTL可以用于肿瘤标志物的检测,如前列腺癌的诊断等[11]。另外,FTL还具有诱导宫颈癌细胞凋亡和抑制癌细胞增殖等作用[13],提示其可能存在潜在的抗癌作用。
关于FTL的分离纯化,国外已有相关报道,主要通过浸提、沉淀和亲和层析得到纯品[10]。但该方法并没有详细的优化,且生产周期较长,成本较高,并不是特别适合工业化生产。另一方面,学术界对包括FTL在内的多种凝集素均有重组表达的尝试,尽管已有多种优化方案,但产量均极低(约20 mg/L),显然难以满足工业化的要求[14]。在重组表达产量未有质的突破,而FTL应用前景又十分广阔的当下,重新优化提取纯化的方案仍然很有必要。因此,本论文根据FTL自身的特点,采用在较高温度条件下浸提和硫酸铵沉淀的方法快速得到FTL粗提物,并通过阳离子交换层析进一步纯化得到FTL纯品。本论文通过对各个提取条件的优化,建立了一个优化的FTL分离纯化方案。该方案能明显缩短FTL的提取时间,提高FTL分离纯化效率,总体上降低FTL的生产成本。最后本论文还对所提FTL的部分理化性质进行了研究,为后续对FTL的深入研究奠定了基础。
1 材料和方法
1.1 实验材料
面包树果实采摘自珠海市三灶镇金湾区安和生化科技有限公司珠海安和园;健康小鼠购自广东省医学实验动物中心;V型96孔板购自广州市浩特伟生物制品有限公司;XK1620层析柱和阳离子交换层析填料均为GE产品;BCA蛋白定量试剂盒购自宝日医生物技术(北京)有限公司;其它试剂均为国产分析纯。
1.2 仪器与设备
Multifuge XIR型台式高速冷冻离心机:美国Thermo Scientific公司;匀浆机:广东小熊电器有限公司;恒温水浴锅:汕头市医用设备有限公司;pH计:上海仪电科学仪器有限公司;AKTA纯化仪:通用电气医疗;电泳仪:北京君意东方电泳设备有限公司;Multiskon Go 酶标仪:美国 Thermo Scientific。
1.3 实验方法
1.3.1 FTL粗品的制备
称取新鲜的面包树果实籽50 g,加入100 mL的Tris-HCl缓冲液(含0.02 mol/L Tris,0.2 mol/L NaCl,pH=7.2),经匀浆机打匀成浆,于50 ℃的条件下浸提2 h,用4层纱布过滤。滤液于4 ℃、5 000 rpm条件下离心20 min,取上清液。在上清液中加入固体硫酸铵至饱和度为20%,静置2 h,4 ℃、5 000 rpm条件下离心20 min,取上清液。上清液中继续加入固体硫酸铵至饱和度为80%,静置2 h,4 ℃、5 000 rpm条件下离心20 min,弃上清液,沉淀用4 mL Tris-HCl缓冲液(0.02 mol/L Tris,0.2 mol/L NaCl,pH=7.2)重悬,得FTL粗品。
1.3.2 凝血试验
1.3.2.1 2%小鼠红细胞悬液的制备:参照文献[15],用浓度为5%的水合氯醛对小鼠进行麻醉,眼眶采血约2 mL,置于含有50 μL肝素钠的10 mL离心管中,经4 ℃、2 000 rpm,离心10 min,弃上清液,再加入5 mL左右的TBS缓冲液(含0.02 mol/L Tris-HCl,0.15 mol/L NaCl,pH=7.4),轻摇混匀,4 ℃、1 500 rpm离心5 min,弃上清液,如此重复3~4次,直至上清液无色为止。最后按红细胞挤压体积加入相应量的TBS-Ca2+溶液(含0.02 mol/L Tris-HCl,0.15 mol/L NaCl,0.1 mol/L CaCl2,pH=7.4)配置成2%的红细胞悬液。
1.3.2.2 红细胞凝集试验:FTL的红细胞凝集试验采用血凝法[16],首先在V型96孔板的每一孔中加入25 μL的TBS-Ca2+溶液,然后在各行的首孔中加入25 μL 的FTL,混匀后,从首孔中吸出25 μL 于第二孔中,再混匀后,吸出25 μL于第三孔中,依此类推做倍比稀释,到最后一孔时,混匀后,吸去25 μL。最后,每孔加入25 μL的2%小鼠红细胞悬液轻吹混匀。室温放置60 min后,观察凝集现象。无凝集反应时,红细胞在V型96孔板底部沉积为一光滑的小圆点;发生凝集反应时,红细胞聚集成絮状物。当出现凝集现象时的最大稀释倍数的倒数定义为一个活力单位[10],用稀释倍数(2n)表示凝集效价[17]。
1.3.3 FTL粗品提取条件的优化
按照1.3.1中的步骤,对FTL粗品依次进行硫酸铵饱和度、浸提液体积、硫酸铵沉淀时间、浸提时间和浸提温度优化。以上每个优化试验均重复4次,取凝集效价值最小的试验结果作为最终结果。
1.3.4 FTL粗品的纯化
取30 mL的FTL粗品于截留分子量为7 KD的透析袋中,4 ℃条件下透析24 h。透析后的FTL样品用20倍体积的层析缓冲液I(20 mmol/L NaH2PO4-Na2HPO4,pH6.5)稀释,4 ℃、13 000 rpm离心30 min,取上清液上平衡好的阳离子交换层析柱,流速为5 mL/min,上样结束后用层析缓冲液I冲洗至基线平衡。最后使用层析缓冲液II(20 mmol/L NaH2PO4-Na2HPO4,500 mmol/L NaCl,pH6.5)进行连续梯度洗脱,洗脱时间为30 min,流速10 mL/min,收集每个洗脱峰,并将收集的洗脱峰分别进行凝血试验。活性组分用截留分子量为10 KD的超滤浓缩管浓缩备用。
1.3.5 FTL纯品的纯度检测
采用聚丙烯酰胺凝胶电泳法进行FTL的纯度检测[18],分离胶浓度为15%,浓缩胶浓度为5%。
1.3.6 FTL纯品的蛋白定量
蛋白质含量的测定采用BCA法[19],以牛血清白蛋白浓度为标准,在562 nm波长处测定蛋白质含量。
1.3.7 FTL纯品的理化性质研究
1.3.7.1 糖抑制试验:参照文献[15],分别配制浓度为0.2 mol/L的D-甘露糖、半乳糖、木糖、D-果糖、蔗糖、D-葡萄糖和麦芽糖溶液,然后将FTL纯品和各种糖溶液按照1∶1的比例混合后,静置1 h。首先在V型96孔板各孔中加入25 μL的TBS-Ca2+溶液,然后在各行的首孔中分别加入用各种糖处理后的FTL纯品并做倍比稀释,最后一孔吸去25 μL。每孔加入25 μL 2%的小鼠红细胞悬液,轻吹混匀。以TBS-Ca2+溶液作对照。室温静置30 min后观察并记录实验结果。
1.3.7.2 热稳定性试验:参照文献[15],取FTL纯品于5个EP管中,每管50 μL,标记后分别置于50-90 ℃条件下水浴3 h。对不同温度处理的FTL纯品做凝血试验,观察并记录实验结果。
1.3.7.3 pH稳定性试验:参照文献[15],配制不同的缓冲体系: 0.1 mol/L 的乙酸-乙酸钠缓冲液(pH:2.6~5.6);0.1 mol/L的柠檬酸-柠檬酸钠缓冲液(pH6.6); 0.1 mol/L 的Tris-HCl缓冲液(pH7.6);0.1 mol/L甘氨酸-氢氧化钠缓冲液(pH:8.6~10.6)。按照上述糖抑制试验方法,将不同的糖溶液换成不同的pH值缓冲液做凝血试验,观察并记录试验结果。
1.3.7.4 金属离子稳定性试验:参照文献[15],分别配制浓度为0.2 mol/L的K+、Ca2+、Fe3+、Mg2+、Ni+、Mn2+、Ba2+、Zn2+、Al3+溶液。按照上述糖抑制试验方法,将不同的糖溶液换成不同的金属离子缓冲液做凝血试验,观察并记录试验结果。以上每个试验均重复4次,取凝集效价值最小的试验结果作为最终结果。
2 结果与分析
2.1 FTL粗提条件的优化
当硫酸铵饱和度为60%时,第6孔底部开始产生沉淀(形成小圆点),当硫酸铵饱和度为70%~100%时,都是第7孔底部开始产生沉淀,由此可见硫酸铵饱和度70%以后FTL沉淀已经充分,无法再通过提高硫酸铵饱和度来提高产率,确定第二次硫酸铵饱和度为70%(图1)。

图1 第二次硫酸铵沉淀Fig.1 The second ammonium Sulfate saturation注:为简化描述,所有凝血试验结果经记录后整理成表1。Note:For describe the result tersely,all haemagglutinating activity result was counted and tabulated as table 1.
基于传统的沉淀模式,我们在确定第二次硫酸铵沉淀的饱和度后,希望通过确定第一次硫酸铵沉淀的饱和度去掉部分杂蛋白。结果显示当硫酸铵饱和度达到10%时,便有FTL沉淀出,沉淀物的SDS-PAGE电泳结果显示有明确的FTL条带,且杂蛋白量很少(数据没有提供),提示该步骤能去除的杂蛋白量并不多。因此,为了兼顾回收率和提取效率,最终确定不进行两步硫酸铵沉淀,而是直接用70%的硫酸铵一步沉淀得到FTL粗品。料液比试验结果显示比例为1∶2时提取效率最佳。当硫酸铵沉淀时间达到4 h时,FTL已沉淀充分。当浸提时间为2 h时, FTL已得到充分浸提。随着浸提温度升高,所得FTL的凝集效价先高后低。当浸提温度为50~60 ℃时,FTL的凝集效价最大。因此,最终的浸提温度确定为50 ℃。浸提温度的升高在一定的范围内可以有效地缩短浸提时间,提高浸提效率。同时还可能导致部分热稳定性差的杂蛋白变性析出,简化后续的分离纯化过程。

表1 FTL的提取优化
注:硫酸铵饱和度优化每间隔10%设置一个梯度,第二个硫酸铵饱和度优化范围为60%~100%,第一个硫酸铵饱和度优化范围为10%~50%;浸提液体积优化的料液比梯度范围是1∶1~1∶5(g/mL);硫酸铵沉淀时间优化的梯度范围是2~8 h,每间隔2个小时设置一个梯度;浸提时间优化的梯度范围是1~4 h,每间隔1个小时设置一个梯度;浸提温度优化的梯度范围是40~80 ℃,每间隔10 ℃设置一个梯度。
Note:The second ammonium sulfate saturation ranges from 60% to 100%,while the first one ranges from 10% to 50%,of which the concentration gradient of 10% was set.The ratio of material to liquid ranges from 1∶1 to 1∶5 (g/mL).The precipitation time of ammonium sulfate ranges from 2 to 8 h with two hours of interval.The extraction time ranges from 1 to 4 h with one hour of interval.The extraction temperature ranges from 40 ℃ to 80 ℃ with 10 ℃ of interval.
2.2 FTL的阳离子交换层析
FTL在所设条件下与阳离子交换层析填料结合力不是很强,当NaCl浓度为0.15 mol/L时,有一个很明显的洗脱峰,洗脱峰组分经SDS-PAGE和凝血试验检测确定为目的蛋白,洗脱液做超滤浓缩得FTL纯品。

图2 FTL粗品的阳离子交换层析Fig.2 Cation exchange chromatography of crude FTL
2.3 FTL纯品的SDS-PAGE电泳
FTL有两个条带,分子量分别约为15.5、12.0 kD(图2),可能为糖基化程度不同的两条α链,大小与相关文献报道一致[10,14]。另外在27 KD和20 KD附近有三微弱的条带,可能是样品浓度过高产生的二聚体,总体上看FTL的纯度比较高。
2.4 FTL纯品的蛋白定量
2.4.1 蛋白浓度标准曲线图
根据蛋白质含量标准曲线测得FTL纯品的浓度为117.5 mg/mL。
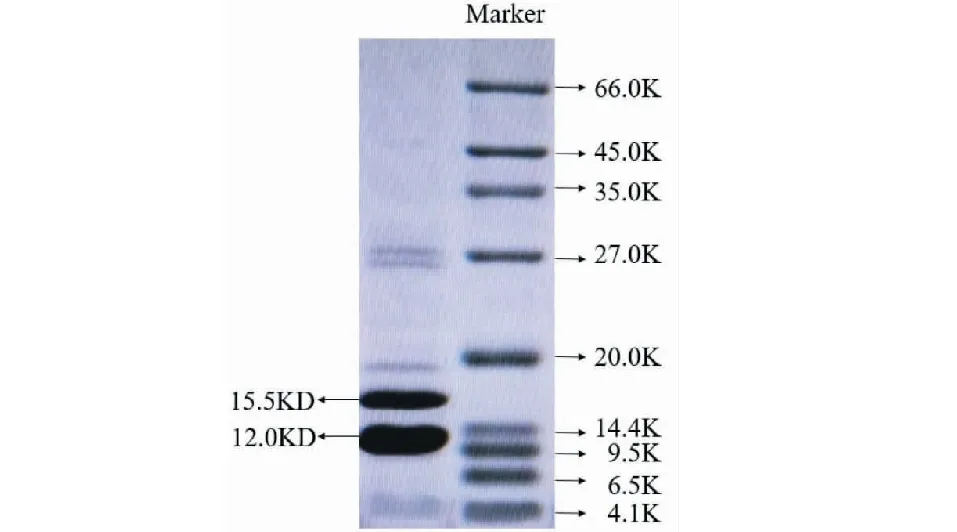
图3 FTL的SDS-PAGE电泳Fig.3 SDS-PAGE of FTL注:泳道1:FTL纯品;泳道2:蛋白Marker。Note:Lane 1,purified FTL;Lane 2,protein Marker.
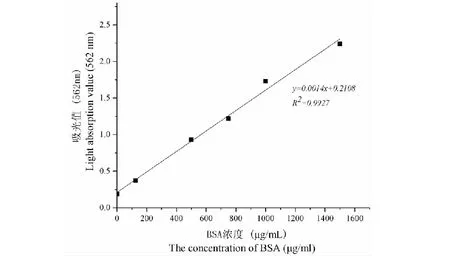
图4 蛋白浓度标准曲线Fig.4 Standard curve of protein concentration
2.4.2 FTL分离纯化过程分析
FTL粗品的总蛋白量为843.3 mg,比活力为4 128.5 U/mg,是Tris-HCl浸提液的比活力的1.5倍,蛋白回收率为46%。经过阳离子交换层析后,FTL纯品的比活力达到6 201.3 U·mg-1,纯化倍数为2.2,蛋白回收率达到22%(表2)。

表2 FTL分离纯化过程
2.5 FTL纯品的理化性质研究
试验中所用的糖对FTL的凝血活性几乎无影响,提示FTL不会被试验中所用的糖所抑制;当温度为50 ℃时,FTL的凝集效价最大,随着温度的升高,FTL的凝集效价逐渐降低,表明FTL是一种热稳定性较好的凝集素。60 ℃以下时,其凝集效价保持稳定。金属离子稳定性试验结果显示FTL对试验中所用的金属离子均不敏感,说明FTL并不依赖于金属离子来发挥其凝血活性。FTL在pH值为2.6到10.6的环境下处理1 h,其凝集效价依然与未处理时相同,表明FTL对酸碱的耐受性较高,对化学变性剂有较强的抵抗力(表3)。

表3 FTL纯品的理化性质研究
注:CK为空白对照。
Note:CK is short for blank control.
3 结论
本论文利用FTL的热稳定性等特点建立了一个较高温度条件下较短时间浸提的提取和纯化工艺。总体而言,所建立FTL分离纯化方案较为简单,耗时短,总体成本较低,回收率较高,有较好的应用价值。
