低温燃料化学特性对湍流预混火焰传播的影响
2019-03-08钟生辉尧命发彭志军
张 帆,任 哲,钟生辉,尧命发,彭志军
天津大学内燃机燃烧学国家重点实验室,天津 300072
1 引言
在实际的内燃机械中,燃料混合气的湍流燃烧是热功能量转化的重要方式。目前,已有许多学者就Lewis数、扩散、压力等多元参数对于火焰结构及湍流燃速的影响开展了大量研究1–3,但大多研究主要着眼于不存在低温化学反应的小分子气态碳氢燃料,如甲烷、氢气等4。现实中主要使用的交通输运燃料大多为类似正庚烷、异辛烷等的大分子高碳氢含量燃料,在高压、中低温度的条件下普遍具有低温化学反应与两阶段点火的燃烧特性5,6。对于这类燃料,低温化学反应会消耗大部分初始反应物,产生如CO、CH2O、C2H4等中间物质,显著改变反应物组成与混合气温度、减少反应物平均分子质量、影响能量吸收及转变过程,使燃料的组分、输运特性以及化学特性等发生急剧改变,继而影响湍流火焰的燃烧速度及火焰结构。
研究者通过实验与模拟的途径7–11已经发现燃料的低温化学反应会影响湍流火焰的动力学特性。Lawes等人采用高速纹影成像技术,在湍流燃烧弹内实验测量了不同湍流速度、不同当量比及不同压力条件下正辛烷的湍流燃烧速度12。Won等人在自主设计的槽型湍流反应器(RATS)燃具内,使用激光诱导荧光(PLIF)检测技术对庚烷的湍流燃烧速度及火焰分区进行实验研究,得到正庚烷因初始反应物温度、入口速度、加热流动滞留时间的不同会导致燃料氧化及低温化学反应程度的不一,存在四种火焰分区,并深入探究了燃料的低温化学反应程度对湍流燃烧速度的影响13–15。本论文正是基于其试验数据开始的数值模拟研究。近年来随着计算技术的快速发展,直接数值模拟(DNS)在燃料燃烧领域得到了广泛应用。在新型均质压燃(HCCI)与火花塞辅助压燃(SAHCCI)环境下,Gou等人16使用多时间尺度(MTS)与简化动力学模型模拟了庚烷的点火、火焰分区以及各个分区间的转化,发现火焰的分区状况会受初始温度梯度与压力的影响;低温化学反应的存在使得低温火焰与高温火焰具有迥异的动力学和输运特性以及传播速度;此外发现,负温度系数效应会促进超音速自点火,在低温度梯度下极大影响了点火锋面与声波的相互作用。Krisman等人17采用二维DNS模拟了二甲醚低温反应产生的“冷焰”对于二甲醚两阶段自点火尤其是高温点火HTC的影响,与均匀混合气相比,冷焰的产生将导致较浓混合气区域内第一阶段自燃的点火延时在减小,并影响自燃核形成的位置及时间。之后Krisman等人18详细模拟了在4000 kPa,400 K与900 K理想柴油机条件下二甲醚的湍流两阶段点火特性,发现其点火是个包含LTC/HTC/预混及非预混燃烧的复杂多级过程。Zhang等人采用三维DNS模拟研究了标准参考燃料PRF70在部分预混燃烧(PPC)内燃机工况下的自点火及废气排放情况,并分析了燃烧中间产物CO的变化以深入了解部分预混燃烧区结构以及燃烧污染物的产生机理19,20。
过去的研究大多基于传统Borghi图的燃烧模型,仅考虑了与层流火焰结构有关的火焰燃烧时间尺度。在一些先进燃气涡轮燃烧器的高压(> 2000 kPa)或高温(> 1000 K)环境下,大分子碳氢燃料的低温点火延迟时间将急剧缩短至1 ms以内,与湍流积分时间尺度及混合层流动滞留时间具有可比性,此时传统的小火焰假设与Borghi图都不再适用14。因此高温高压环境下点火的影响也会成为影响火焰分区的重要因素之一,湍流与化学相互作用对于低温燃烧的影响作用仍待探究。
本文主要着眼于燃料的负温度系数区域,研究了不同入口参数条件下正庚烷/空气预混混合气的流场、组分和温度变化,探索了低温反应对湍流火焰的影响,并结合湍流时间尺度、流动时间尺度与点火时间尺度,初步提出湍流/化学相互作用下新的火焰区域划分依据。
2 数值模拟模型
2.1 计算方法
本文根据文献14中的试验装置,使用OpenFOAM平台构建数值计算模型。此模型可以分为自由发展段与火焰生成区两部分。预混混合气首先以不同入口温度、速度条件流动通过自由发展段,发生不同程度的低温化学反应;随后进入火焰生成区后经由引燃火焰点火并形成稳定火焰面。其初始参数由文献14给出。
在自由发展段,燃料是否会发生低温反应以及反应进行的程度会各有不同,导致进入火焰生成区的物质组分发生重大改变。为准确获取火焰生成区入口处的实际组分含量,可将该部分正庚烷混合气看作处于一维绝热的流动过程,不受外界影响而完全由初始状态自由发展。通过对反应流初始温度与速度的设置,经过一段时间后反应流将完全流通达到稳定状态,此时出口处各组分的含量即可视作该工况下进入火焰生成区的实际组分。
预混混合气经过自由发展段后直接进入火焰生成区,三维计算区域尺寸为140 mm × 82 mm ×90 mm,采用非均匀化网格对中间火焰部分进行加密处理,网格数总数为799200。图1a–c分别是RATS燃具示意图,计算域和三维网格划分情况。图1a中黑色虚线部分为计算域,在三维图中显示为图1b,c。在计算域内部充满了处于常温常压下的空气。计算模型底面100 mm ×10 mm部分为预混燃料混合气入口,即RATS燃具中的喷嘴出口。图1c中显示的中间网格密集处即为产生火焰的主要位置。在入口两旁各有100 mm × 1 mm的长槽面作为化学当量比条件下的甲烷高温引燃火焰,进口计算域的最底面为燃料与引燃火焰的入口,通道平行且邻近主反应物流动通道的每一侧,如图2a所示。在模型入口边界上,燃料混合气的组分给定初始值。本文是使用直接数值模拟的方法先生成了一个满足一定湍流强度的各项同性湍流场,然后叠加在主流速度之上作为燃烧器的入口条件。在本算例的三维计算中,采用的RANS方法,湍流模型是k-ε。以初始反应物温度700 K,入口速度10 m·s-1为例,按实验数值设置初始湍流积分尺度为2.75 mm,湍流强度取12.5%,图2b显示了初始湍流速度场分布。
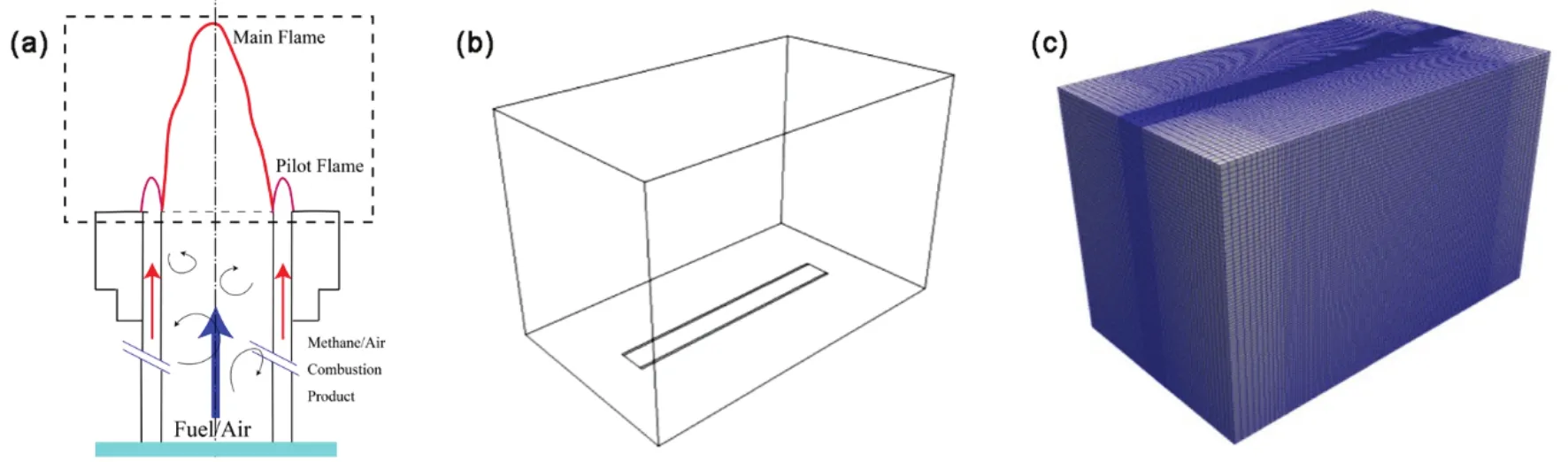
图1 (a) 燃具示意图;(b) 三维数值模拟计算域;(c) 计算域网格Fig.1 (a) Schematic of reactor-assisted turbulent slot burner;(b) computational domain of three-dimensional numerical simulation;(c) the grid mesh in the simulation.
2.2 化学动力学机理
在数值模拟计算中使用的是美国 Sandia National Laboratories的Liu等人提出的简化正庚烷骨架机理21,包含44种物质与112步基元反应,可在计算能力允许的范围内较好反映燃料的化学特性。图3为该简化机理与CURRAN ver 3.1详细机理22在CHEMKIN零维均质燃烧器中不同当量比、温度与压力条件下的滞燃期对比。图3a,b分别对应的是化学当量比φ = 1和0.6的正庚烷混合气。本文中着火延迟时间定义为温度梯度最大时所对应的时刻。从图3a中可见在100 kPa,750 K条件当量燃烧下,第一阶段点火延时 τ1st为9.6 ms;而压力增至1350 kPa时,因分子碰撞加剧导致初始活性自由基团数量增加,继而使得 τ1st缩短至1.6 ms。在压力P = 100 kPa的工况下,简化机理(实心红点)与详细机理(蓝色实线)滞燃期对比吻合较好。图3b显示在φ = 0.6,一个大气压条件下,简化机理与详细机理的第二阶段滞燃期基本吻合,第一阶段滞燃期较长,但是三维计算中的分析是基于第一阶段点火之后的组分、温度分布对湍流火焰传播速度的影响。因此本研究使用此简化机理替代详细机理CURRAN ver 3.1。
图4a,b表示了在初始100 kPa、700 K、φ = 0.6条件下该简化机理计算得到的两阶段点火特性:压力、燃料以及中间组分CH2O随时间的变化。可以看出在第一、第二点火阶段压力各有两次快速提升,第一阶段低温化学反应发生后,燃料正庚烷大量分解并产生各类中间产物;二次点火后燃料完全分解,反应到达高温阶段。
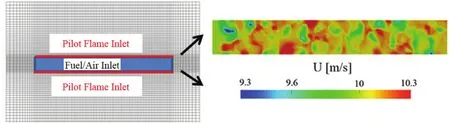
图2 计算域底面入口(a)和底面速度入口湍流场(b)Fig.2 Bottom inlet of the computational domain (a);inlet turbulent velocity (b).
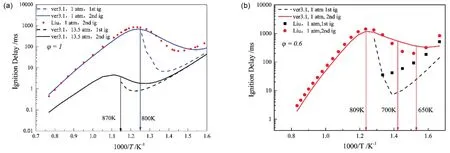
图3 简化机理与ver3.1详细机理在φ = 1 (a)和φ = 0.6 (b)时的滞燃期对比Fig.3 Comparison of ignition delay time for n-heptane mechanism at φ = 1 (a) and φ = 0.6 (b) conditions between reduced and ver3.1 detailed mechanism.

图4 简化机理压力(a)和部分组分(b)随时间变化Fig.4 Time-dependent change of pressure (a) and important species (b) of simplified mechanism.
2.3 初始参数设置
本文主要研究的是化学当量比φ = 0.6的正庚烷空气混合气火焰燃烧情况。计算域内大环境为常温状态下的空气,这里取一个标准大气压,温度301 K,近似认为空气中仅含有氮气与氧气两种物质(以质量分数的形式给出)。入口燃料由正庚烷、氧气与氮气三者构成,对于化学当量比为φ = 0.6的正庚烷混合气,表1给出了相应组分质量分数。根据自由发展段燃料滞留时间的不同,其初始混合物状态(温度、组分)做相应的改变。
为点燃并稳定主流火焰,引燃火焰一般采用甲烷、乙烯等简单燃料。在本模拟中引焰采用的是GRI3.0详细甲烷动力学机理,包含53种物质,353步反应。将经过CHEMKIN燃烧计算后得到的主要高温产物作为入口初始条件给入计算模型。CHEMKIN燃烧模型中初始温度为298 K,甲烷/空气当量比φ = 1,燃烧后温度为2230 K。引焰的目的是提供足够的热环境使得主流区的燃烧能够顺利进行,并且保证周围空气对主流没有干扰。本文选取的引焰中的组分是甲烷和空气完全燃烧得到的主要产物,即:H2O,CO,CO2,O2,H2,OH 和N2。除组分构成外,引焰的速度也会影响主焰的燃烧情况。在实际模拟计算前,针对入口主流速度10 m·s-1,分别研究了引焰速度 7.5 m·s-1与 10 m·s-1的燃烧情况。当引焰速度为10 m·s-1时,引焰速度过快使得火焰面未能形成即被吹走,并未发生着火现象。这也说明引焰的速度大小会影响到火焰的形成,因此在模拟计算中将引焰速度选取为主焰速度的0.75倍。
本文主要着眼于处于化学反应冻结区与低温点火区的火焰,即初始反应物温度T在450–700 K范围之内。入口速度U的大小将对脉动速度u´与加热流动滞留时间 τres产生影响。滞留时间与对应温度下的第一阶段点火燃期 τ1st存在着大小关系,影响着低温反应的发生与计算域入口组分的含量。算例中使用φ = 0.6的正庚烷/空气混合气。层流火焰速度SL由对应机理通过CHEMKIN一维层流火焰自由传播模块计算得出。综合考虑相关因素后,表2给出了本模拟研究中计算使用的12个算例的初始参数具体设置情况。

表1 φ = 0.6正庚烷混合气组分含量(质量分数)Table1 Component mass fraction of n-heptane mixture (φ = 0.6).
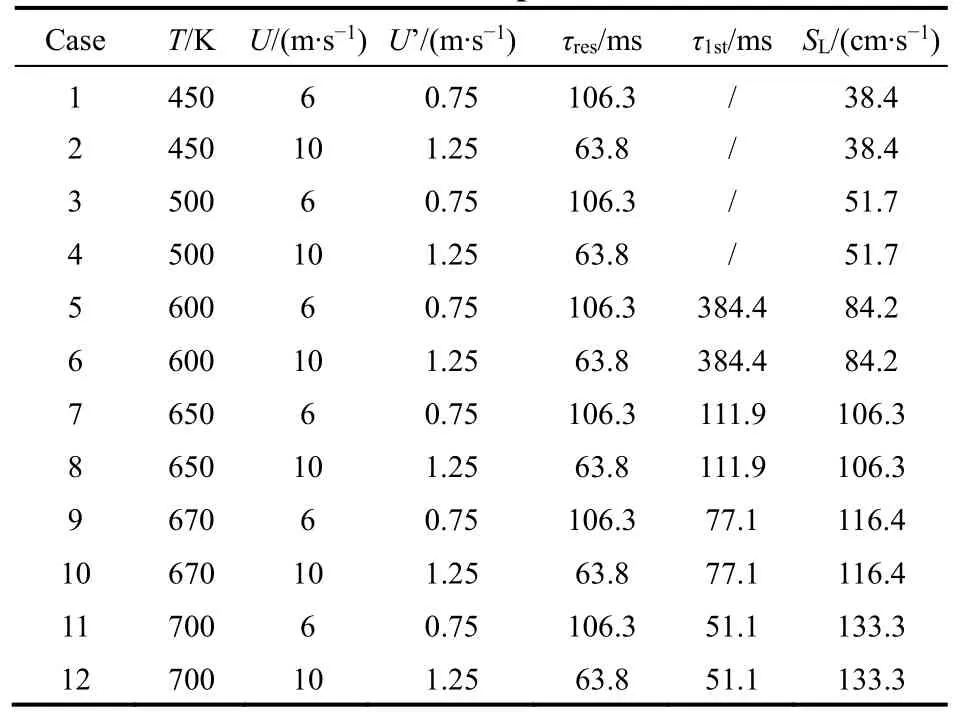
表2 算例初始参数Table2 Initial simulation parameters of 12 cases.

图5 450–700 K,当量比φ = 0.6混合气NXC7H16 (a)和CH2O (b)组分随时间变化情况Fig.5 Temporal evolution of NXC7H16 (a) and CH2O (b) mass fraction at 450–700 K with equivalence ratio φ = 0.6.
根据初始算例中不同初始温度、燃料滞留时间,首先通过对自由发展段中燃料的化学动力学特性做简要分析。图5显示初始温度在450–700 K,当量比φ = 0.6的混合气质量分数和中间组分CH2O随时间的变化,图中分别标出了流动滞留时间为63 ms与 106 ms的位置(即入口速度 10 m·s-1与 6 m·s-1)。可看出在120 ms的时间范围内,较低温度(450–600 K)的算例下正庚烷含量不发生改变,始终维持在初始值;温度逐渐提升后,正庚烷随时间增长含量逐渐减小。随着温度逐渐增高(650–700 K),正庚烷裂解消耗发生的时间也越早,组分变化曲线也更加陡急,说明燃料裂解速度加快。从图 5b也可得到相似结论,因低温情况下燃料组分保持不变,CH2O一直没有产生,数值上表现始终为零;对于高温情况,CH2O的出现时间则会随初始温度增长而逐渐提前。
结合图4和5,对于存在低温反应的情况,在第一阶段化学反应发生后,压力快速增长,主体燃料与氧气发生复杂异构化与分解,正庚烷部分分解形成较小的中间产物CH2O、C2H4等。中间产物的形成一方面促进了化学反应,一方面使得混合气平均分子质量降低,导致局部区域 Le数减小,两者都会对火焰湍流燃烧速度的提高起到一定作用。第一阶段过后,大部分燃料被分解为中间组分。在第一阶段后第二阶段前,CH2O、OH等组分逐渐被消耗并放热,在临近第二点火延时τ2nd时H2O2分解放热加速反应,使得燃料组分进入第二阶段23,24。
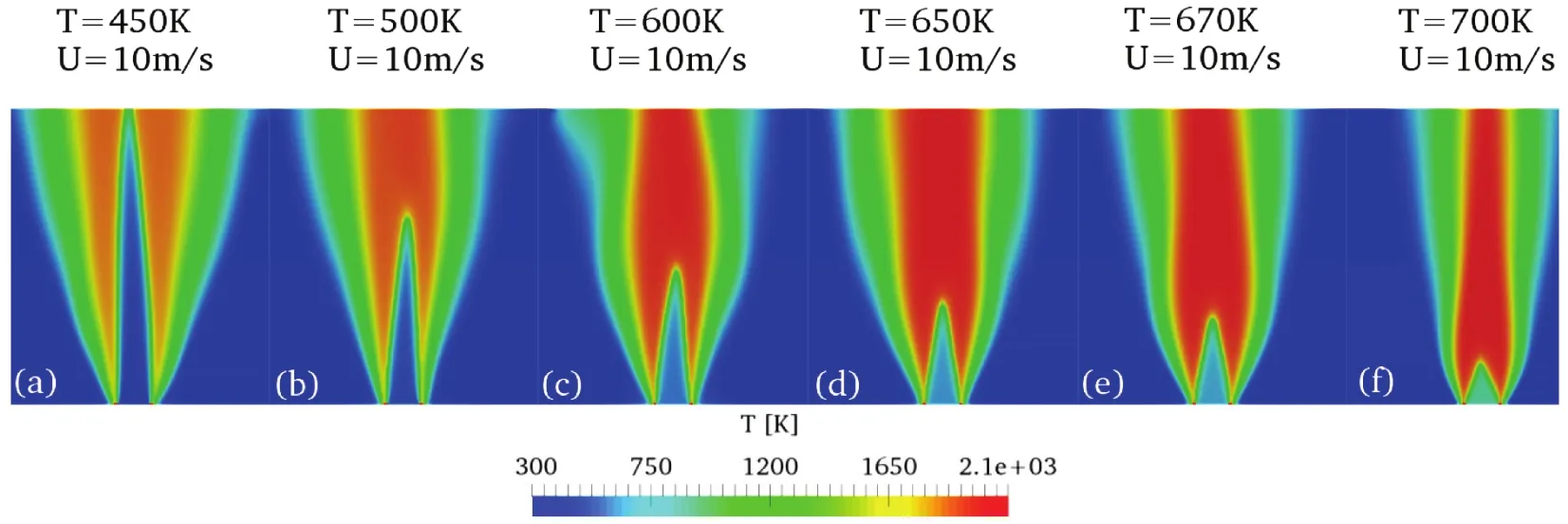
图6 U = 10 m·s-1、T = 450–700 K范围内稳定火焰情况Fig.6 2D temperature distributions at the burner outlet from 3D results for different reactant temperatures(450–700 K) but the same inlet velocity (U = 10 m·s-1).
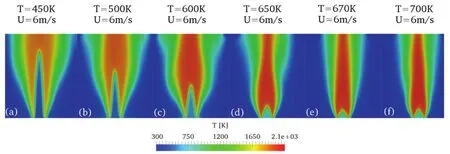
图7 U = 6 m·s-1、T = 450–700 K范围内稳定火焰情况Fig.7 2D temperature distributions at the burner outlet from 3D results for different reactant temperatures (450–700 K) but the same inlet velocity (U = 6 m·s-1).
3 结果与讨论
3.1 火焰燃烧情况
在保持化学当量比(φ)与入口速度(U)恒定(即流动滞留时间一定)的情况下,通过改变混合气初始反应温度(Treactor),可得到正庚烷/空气混合气燃烧随温度的整体变化情况。图6显示了在当量比φ = 0.6,入口速度保持在10 m·s-1的情况下,逐渐将反应初始温度从450 K增加至700 K所得到的稳定后的湍流预混火焰状态(三维模型的二维中间截面)。在相对较低的反应温度阶段,燃烧火焰处于化学反应冻结区(CF区),如图6a,b所示,可得到类似于本生火焰的燃烧状态。如图6c–f所示,将温度继续增加,从500 K提升至700 K,可明显看到最高火焰燃烧温度随之逐渐上升,且火焰高度逐渐下降,说明湍流燃烧速度ST随温度升高逐渐增大。图6d–f各温度阶段的火焰燃烧情况受低温化学反应程度的影响较大,属于低温点火区(LTI),与实验结论一致14。
图7同样显示了当量比及流动停留时间一定,改变初始反应温度得到的湍流火焰情况。不同于图6,此时入口速度U = 6 m·s-1,流动滞留时间虽仍保持恒定,但较图6有所增加。由下图可见火焰整体变化规律与图6一致,随着温度增加火焰温度逐渐提升,火焰面高度逐渐减小,湍流燃烧速度增加。
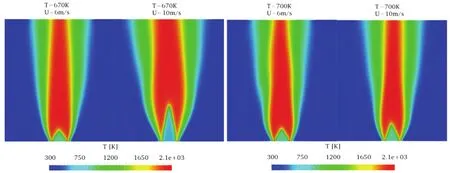
图8 670 K与700 K不同入口速度火焰对比Fig.8 2D temperature distributions at the burner outlet for two reactant temperatures 670 K,700 K and two inlet velocities 6 m·s-1,10 m·s-1.
图8 对比了同一温度不同进气速度的火焰温度图像,发现不同入口速度对反应温度影响不大,但对火焰面高度有较大影响。从670 K与700 K两种温度四个算例的对比中可见,低入口速度(6 m·s-1)的火焰面高度明显低于高入口速度(10 m·s-1)。这种情况的发生主要是由于不同的入口速度对应不同的加热流动滞留时间,使得第一阶段化学反应的程度有所不同。在低速入口情况下,燃料在自由发展段有较长停留时间(> 100 ms),低温化学反应较为充分,在燃具出口的正庚烷大部分已发生分解转变为中间物质,很快就能着火形成稳定火焰;而对于高速入口情况,流动滞留时间约为60 ms,与燃料的第一滞燃期近似或小于第一滞燃期,燃料的低温反应程度受温度影响较大,所以化学反应不如低速情况完全,进入模型的燃料仍需要一段时间的发展才能继续分解并着火形成火焰。
3.2 湍流火焰燃烧速度
模拟研究中需要测定的湍流火焰速度 ST根据质量守恒定律由公式1确定:

式中U是喷嘴出口处混合气平均流速;w是燃烧器的宽度,在本模拟模型中w = 10 mm;Pavg是平均火焰的长度。在本模拟中,通过对火焰面上CH自由基的等值面拟合得到火焰面的锥形轮廓,继而得到火焰面的平均长度。通常OH-PLIF所显示的火焰面包含了反应区和高温区,对应火焰厚度比较宽。在计算中可以方便地提取CH分布,得到的是最中心的反应层厚度,更适合用来定义火焰锋面25。同样方法可得到450–700 K各个算例不同温度下的火焰面轮廓并求得其火焰面长度。图9显示了化学当量比φ = 0.6,温度在450–700 K范围内,模拟计算所得12个工况下正庚烷/空气混合气的标准化湍流燃烧速度 ST/SL随标准化湍流强度 u´/SL的变化关系。ST/SL表示由层流燃烧速度 SL标准化得到的湍流燃烧速度,所有层流燃烧速度 SL都是由CHEMKIN一维层流预混火焰模型计算得到。
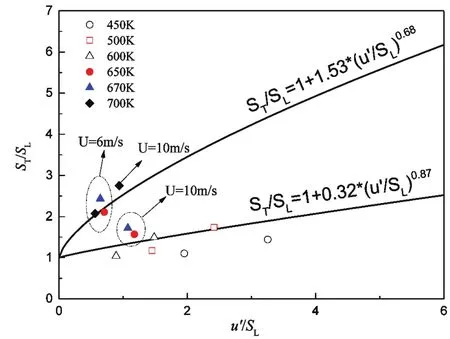
图9 被测标准湍流燃速ST/SL与标准化湍流强度u'/SL的函数关系Fig.9 Measured turbulent burning velocity normalized by SL as a function of normalized turbulent intensity,u'/SL.
图9 中的两条实线是实验测定得出的多个工况点进行拟合所得14,离散点分别对应本文12个数值模拟工况点。从图中可以看出,标准化湍流燃烧速度与混合气初始温度以及流动滞留时间有关。两条实线中的下线可代表火焰的下限,主要由较低温度的算例分布构成(空心图标与部分实心图标)。在下限范围内,混合气温度过低或流动滞留时间过短,都不利于低温燃料氧化反应的发生,在这些情况下CH2O仅存在于薄反应区中,在未燃烧反应物区域中没有 CH2O,表明进入计算域的燃料不存在化学反应。对应的在上限处算例的初始反应温度较高(600–700 K),流动滞留时间较长(> 100 ms),出口处的焰前未燃区域内存在大量 CH2O,表明在自由发展段混合气发生了低温氧化反应,并改变了反应物化学组成。图9中两个实点(算例8和10)靠近火焰下线是因为,算例8(650 K,10 m·s-1)处于化学反应冻结区/薄反应区(CF区),CH2O只在薄反应层出现,不受未燃区域燃料化学动力学的影响。算例10(670 K,10 m·s-1)的燃料滞留时间与低温化学反应时间相当,此时的火焰处于冻结区向低温反应区的过渡。图10选取了500 K与670 K两个不同工况在流动滞留时间为100 ms情况下,主要中间产物的分布情况。明显可见两种工况分别属于不同的火焰分区。在500 K算例工况下,CH2O如上文所述只存在于火焰面周围,属于薄反应区(或化学反应冻结区);在670 K工况下,CH2O存在于未燃反应物区域内,且CH2O最高含量约为500 K工况的4.4倍,燃烧位于低温点火区。中间物质的分布情况说明了低温化学反应的发生改变了火焰的湍流燃烧速度。
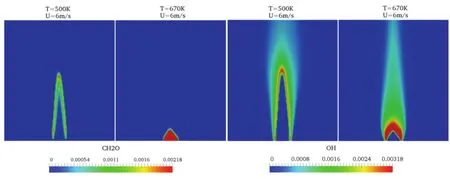
图10 中间产物CH2O和OH在初始温度500 K、670 K,流动时间100 ms时的浓度对比Fig.10 2D contour of intermediate species (CH2O,OH) mass fraction comparisons for different reactant temperatures 500 K and 670 K at flow residence time of τres = 100 ms.
3.3 时间尺度关系
表3列出了本文所研究的12个算例中点火时间尺度 τ1st与流动时间尺度 τflow的详细数值及两者大小关系,此外还分别划分了每个算例火焰的化学区域,本文的研究范围主要为化学反应冻结区/薄反应区(CF区)与低温点火区(LTI)。
根据入口燃料的初始温度与入口速度不同,点火时间尺度、流动时间尺度以及火焰时间尺度的关系会相应有所区别,分别会对应不同的火焰区域。当初始温度较低,如算例1–6的情况,第一点火阶段不会发生或开始时间较迟,此时 τ1st> τflow> τflame,火焰尺度为主要尺度,火焰表现出层流燃烧特征,燃烧速度与层流速度一致。当初始温度增高,点火延时缩短,逐渐与另外两者数值相近或小于流动时间时 τ1st~τflow~τflame,低温化学反应的发生会改变反应物的组分,对燃烧的影响占主要地位,此时的火焰属于特殊的低温湍流火焰点火区。当温度继续升高时,由图4可以预测,高温高压下时间极快极短的第一阶段点火(0.1–10 ms)将远小于流动时间 τ1st<< τflow,化学反应更多将为高温反应,燃烧将位于高温点火区域。
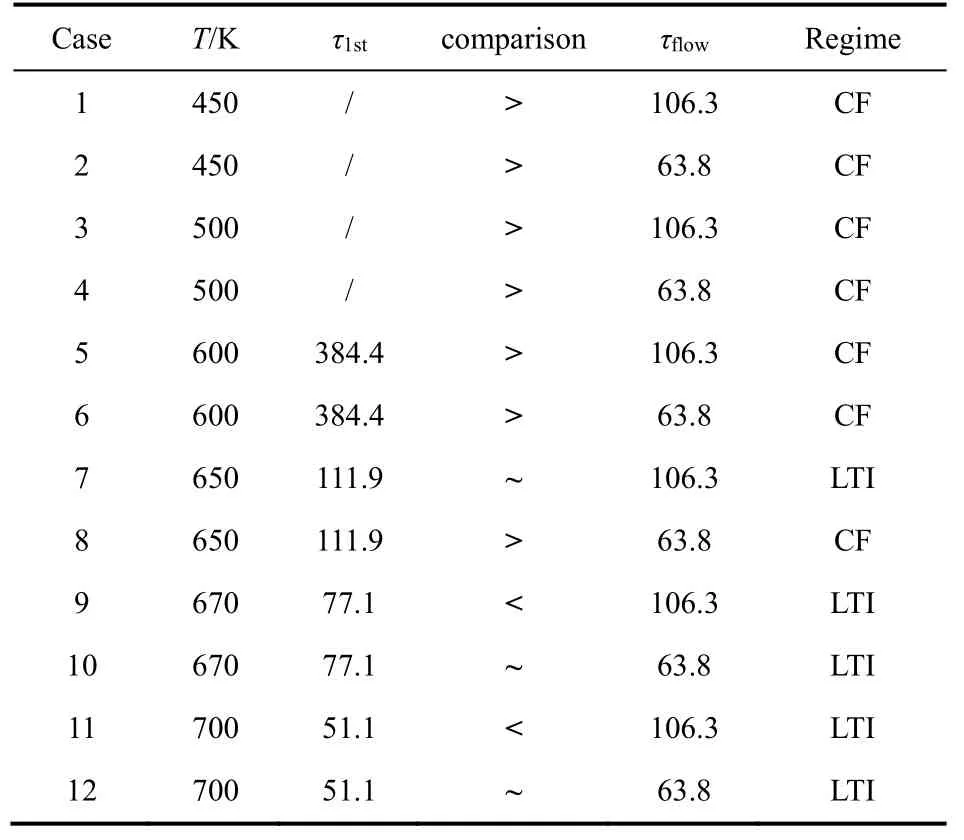
表3 12算例时间尺度关系及火焰分区Table3 Time scale relations and flame regimes for 12 cases.
4 结果与讨论
本文使用了数值模拟的方法,研究了低温化学反应对正庚烷/空气混合气湍流燃烧火焰传播的影响。研究针对不同的初始条件,模拟了φ = 0.6、入口速度6 m·s-1与10 m·s-1、初始反应物温度450–700 K的 12种工况,发现了在负温度系数区域内主要存在薄火焰区与低温点火区两种火焰分区,并推测出之后存在有高温反应区。对于普通的薄火焰区或化学反应冻结区(CF)内,中间产物CH2O等主要存在与薄反应区中,在预热区中并未被发现,说明第一阶段化学反应并未发生。随着初始温度的升高,点火时间尺度逐渐下降并与流动时间尺度数值近似,燃料正庚烷在第一阶段部分或全部氧化分解,产生大量可在入口处发现的中间产物,此时的火焰位于低温点火湍流火焰区(LTI)。在LTI区域中,初始温度及入口速度会造成湍流强度及流动时间的改变,低温反应的作用极为主要。燃料的组分及输运特性受低温反应影响发生改变,使得标准化湍流燃烧速度随LTC发生程度增加而逐渐提高。当温度进一步提高后,燃料燃烧由负温度系数区域内过渡到达高温反应区,燃料不再发生低温化学反应,此时的燃烧将处于高温点火区。
致谢:本工作的计算资源使用了中国天津天河一号(TianHe-1A)服务器。感谢普林斯顿大学Yiguang Ju教授和瑞典隆德大学Riixn Yu教授共同的讨论。
