雏鸡关节炎型沙门氏菌GZ2018株的分离鉴定
2019-03-07杨佰启温贵兰陈彦希张升波李昌红龚新勇周碧君
杨佰启, 温贵兰*, 陈彦希, 田 浪, 张升波,徐 丽, 李昌红, 龚新勇, 文 明, 周碧君, 张 军.3
(1.贵州大学动物科学学院,贵州 贵阳 550025; 2.贵州省动物疫病与兽医公共卫生重点实验室, 贵州 贵阳 550025; 3.贵州省六盘水市动物卫生监督所,贵州 六盘水 553000)
病原沙门氏菌属(Salmonella)为寄生于人和动物肠道内的无芽孢杆菌,是一大属与血清学相关的革兰氏阴性杆菌[1]。SALMON于1985年分离出沙门氏菌属的猪霍乱杆菌,因此定名沙门氏菌属Salmonella[2]。目前,沙门氏菌属有2个种,42个血清群,2 500个血清型以上,我国已报道的血清型达240种以上[3],其中与家禽密切相关的有40余种。鸡沙门氏菌病(AvianSalmonellosis)是由多种沙门氏菌引起的一类传染病的总称,其中引起鸡发病的沙门氏菌主要有鸡白痢沙门氏菌、鸡伤寒沙门氏菌及有鞭毛能运动的多种副伤寒沙门氏菌[4];大多数禽类对沙门氏菌病易感,以3周龄以内雏鸡的发病率与病死率最高,4周龄后的发病率和死亡率显著下降[5]。临床上多表现为败血症和肠炎,少数表现为关节炎;鸡沙门氏菌病对养鸡业的危害较大,会导致鸡的生产性能下降,种蛋的孵化率降低。目前,我国控制该病的主要措施是检疫淘汰带菌鸡,净化培育鸡群;对于一些没有条件净化或短期内无法净化的鸡群采用抗菌药物预防和治疗[6-7]。笔者等2018年11月对贵州某肉鸡养殖场送检的病鸡进行细菌分离培养鉴定,通过药敏试验筛选出分离菌株的敏感药物,并进行分离菌株16S rRNA基因序列分析鉴定,确诊送检病鸡为鸡沙门氏菌感染,对该鸡场鸡沙门氏菌的防控具有指导作用。
1材料与方法
1.1材料
1.1.1病料与健康雏鸡病料5份,来源于贵州某肉鸡养殖场处于3~4周龄发病的5只雏鸡。健康雏鸡8只,购自贵州某肉鸡养殖场。
1.1.2主要试剂普通肉汤琼脂平板、普通肉汤液体培养基、麦康凯琼脂培养基(MAC)、亚硫酸铋(BS)琼脂平板、革兰氏染色剂、抗菌药物(红霉素、先锋霉素、头孢曲松、环丙沙星、丁胺卡那、新霉素、氯霉素、庆大霉素、多黏霉素、克林霉素、四环素、万古霉素、诺氟霉素、卡那霉素、青霉素)、革兰氏染色剂、生化管,均购自杭州微生物试剂公司;2×Es Taq DNA polymerase,购自康为世纪;DL 2000 DNA Marker,购自宝生物工程(大连)有限公司。
1.2方法
1.2.1细菌分离培养无菌采集病鸡关节液,用接种环接种于普通肉汤琼脂培养基,分别在需氧与厌氧条件下37℃培养24 h后,观察细菌菌落特征。挑取可疑单个菌落分别接种于麦康凯培养基(MAC)、亚硫酸铋(BS)琼脂平板上。
1.2.2细菌革兰氏染色取50 μL纯培养菌液均匀涂抹于干净载玻片上,经火焰固定、草酸结晶紫初染、碘液媒染、脱色液脱色、沙黄复染后,于10×100倍油镜下观察细菌形态。
1.2.3细菌生化试验用接种环分别接种纯培养菌液于麦芽糖、葡萄糖、甘露醇、甲基红、吲哚(靛基质)、乳糖生化管中,37℃培养48 h后观察记录结果。
1.2.4细菌药敏试验吸取100 μL纯培养菌液均于涂抹于琼脂平板上,用纸片法将15种药敏片粘贴于平板上,置于37℃培养箱中培养24 h,记录药敏片的抑菌圈大小,参照美国临床和实验室标准化协会(CLSI 2016)抗微生物药物敏感试验标准进行药物敏感性判断。
1.2.5分离菌株感染雏鸡试验将8只健康雏鸡平均分为2组,试验组肌肉注射200 μL菌液,对照组肌肉注射200 μL生理盐水,隔离饲养,观察雏鸡发病和死亡情况,采集关节液接种于普通肉汤琼脂培养基,37℃培养24 h,挑取单个菌落涂片镜检。
1.2.6分离菌株16S rRNA PCR 扩增及测序细菌16S rRNA引物序列,F:5′-AGAGTTTGATCMTGGCTCAG-3′;R:5′-AAGGAGGTGATCCAGCC-3′,引物由英潍捷基(上海)贸易有限公司测序合成。PCR反应体系20 μL:上游引物0.5 μL,下游引物 0.5 μL,菌液 2 μL,2×Es Taq DNA polymerase 10 μL,ddH2O 7 μL。PCR反应条件:94℃预变性2 min;94℃变性30 s,55℃退火30 s,72℃延伸90 s,共30个循环;72℃延伸10 min。PCR反应结束后经1.2%琼脂凝胶电泳检测PCR反应产物,并将产物送英潍捷基(上海)贸易有限公司测序。
1.2.7分离菌株16S rRNA基因序列分析将分离菌株的16S rRNA基因序列与GenBank 数据库中收录的序列进行比对,运用DNAStar 7.0软件的MegAlign将测序的16S rRNA基因序列与肠杆菌科沙门氏菌属、大肠杆菌属共17个菌株(表1)的16S rRNA基因序列比对,并应用MegAlign软件的Cluster W方法构建遗传进化树。
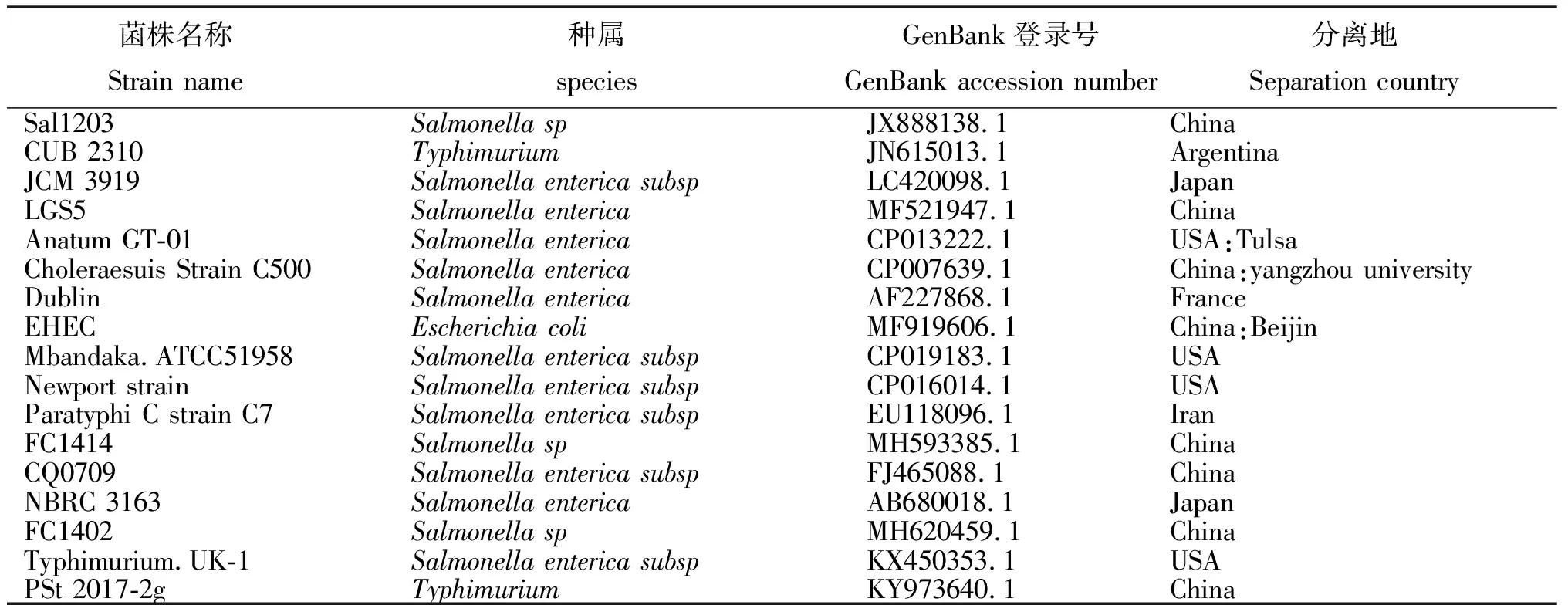
表1 比对菌株信息
2结果与分析
2.1细菌分离培养
接种分离菌37℃培养24 h后,在亚硫酸铋琼脂平板上显示黑色并有金属光泽的菌落,菌落周围培养基不变;在麦康凯琼脂平板上生长成无色、半透明、表面光滑的圆形小菌落(图1)。该菌在2种平板上生长的菌落形态均符合沙门氏菌的生长特性。

图1亚硫酸铋琼脂培养基(上)与麦康凯琼脂培养基(下)培养分离菌的特征
Fig.1 Characteristics of the isolated strain cultured on Bismuth sulfite agar medium (up) and Mackenzie agar medium (down)
2.2细菌革兰氏染色与生化反应
分离菌经革兰氏染色,镜检为革兰氏阴性、两端钝圆的短杆菌(图2),符合沙门氏菌属革兰氏染色的细菌形态。经生化试验,分离菌可以发酵葡萄糖、麦芽糖、甘露醇,产酸产气;不发酵乳糖,甲基红试验阳性(+),吲哚(靛基质)弱阳性(+/-),符合沙门氏菌的生化反应特征。
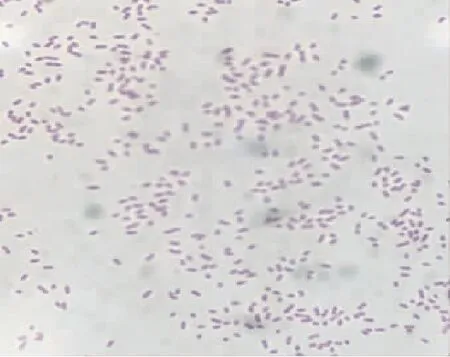
图2 细菌革兰氏染色结果
2.3分离菌的药物敏感性
从表2看出,分离菌对红霉素、头孢曲松、环丙沙星、丁胺卡那、氯霉素、庆大霉素和多黏霉素高度敏感;对先锋霉素V、新霉素和克林霉素中度敏感;对青霉素、四环素、万古霉素、诺氟霉素和卡那霉素不敏感(产生耐药性)。
表2分离菌对15种抗菌药物的敏感性
Table 2 Sensibility of the isolated strain to 15 antibacterial agents

药物名称Drug name抑制菌圈直径大小/mmDiameter of inhibition zone判定结果Evaluation result红霉素 Eryphilin30高度敏感先锋霉素V Pioneer V20中度敏感青霉素 penicillin10不敏感四环素 tetracycline12不敏感头孢曲松 Ceftriaxone 46高度敏感克林霉素 Clindamycin15中度敏感万古霉素 Vancomycin10不敏感环丙沙星 Ciprofloxacin24高度敏感丁胺卡那 Amikacin30高度敏感新霉素 Neomycin20中度敏感氯霉素 Chloramphenicol40高度敏感庆大霉素 Gentamicin25高度敏感诺氟霉素 Norfomycin12不敏感卡那霉素 Kanamycin10不敏感多黏霉素B Polymyxin B23高度敏感
2.4雏鸡感染试验
试验组雏鸡感染分离菌3 d后,病鸡表现精神沉郁,食欲不振,病初喜卧,随后出现跛行,一侧或双侧关节出现肿大。剖解病鸡关节腔、腿肌及腹腔,可见腿肌处淡黄色渗出液,关节及附近滑液囊高度肿大,与之相连接的腱鞘发炎肿大,关节腔内有黄色或淡黄色的液体渗出,囊壁增厚,腹腔内有大量淡黄色积液,心包膜增厚。对照组7 d无异常现象。接种试验组雏鸡分离菌涂片镜检,与沙门氏菌的形态特征一致,证明导致雏鸡感病的病原为沙门氏菌。
2.5分离菌株16S rRNA基因PCR扩增与及测序
从图3可知,分离菌株的16S rRNA基因 PCR扩增片段约为1 300 bp。目的条带测序得到分离菌株16S rRNA基因的部分序列,大小为950 bp,命名该菌株为GZ2018。
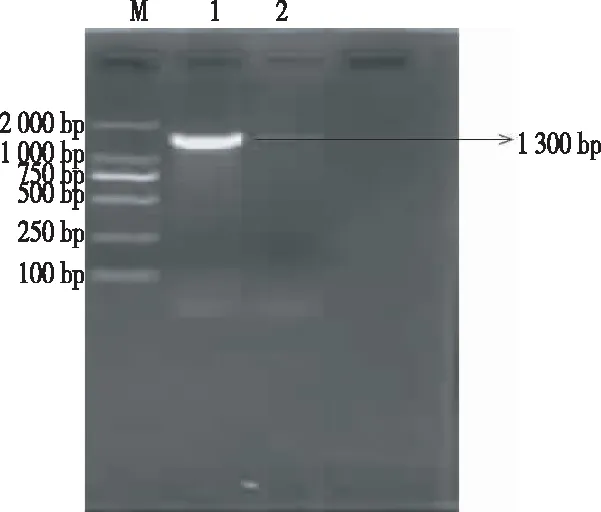
注:M为2000 DMarker,1为分离菌株,2为阴性对照。
Note: M. 2000 D marker; 1. The isolated strain; 2. Negative control.
图3分离沙门氏菌的16SrRNAPCR扩增图谱
Fig.3 16S rRNA PCR amplification pattern of the isolatedSalmonellastrain
2.6沙门氏菌GZ2018的16S rRNA基因序列
2.6.1同源性从图4看出,沙门氏菌GZ2018与沙门氏菌属和大肠杆菌属的17株细菌16S rRNA基因序列同源性为40.9%~100%,其中,GZ2018与肠炎型沙门氏菌CQ0709、NBRC 3163和Sal1203的同源性最高,均为100%;与Anatum GT-01株的同源性最低,仅40.9%。

图4沙门氏菌GZ2018的16S rRNA基因序列同源性对比
2.6.2系统进化树从图5可知,Anatum GT-01和Mbandaka.ATCC51958单独为一支,其中肠炎型沙门氏菌CQ0709与GZ2018处于同一分支,进化关系最近,进一步验证GZ2018为沙门氏菌。

图5GZ2018株16S rRNA序列系统进化树
Fig.5 Phylogenetic tree of 16S rRNA sequence ofSalmonellaGZ2018 strain
3结论与讨论
禽沙门氏菌病(PulourmDisease)是由沙门氏菌属中任何一个或多个成员所引起禽类的一种急性或慢性疾病。该病除水平传播外,主要通过卵传递,是贯穿整个养鸡周期的一种恶性循环式疾病[8]。病雏鸡以白痢为特征,雏鸡常表现急性败血症和肠炎型,病程短,死亡率很高,治疗主要以紧急接种为主;关节炎型为慢性发病,临床上有治疗意义,死亡率可以控制在最小范围内[9]。
通过细菌的分离培养、形态观察、生化试验、雏鸡的致病性试验、PCR反应以及16S rRNA基因序列分析,确认从发病雏鸡关节囊肿分离的细菌为沙门氏菌。发生鸡关节炎性疾病的病原体较多,有细菌性、病毒性和支原体;常见的病毒性关节炎有呼肠孤病毒(ARV),细菌性主要有大肠杆菌、沙门氏菌、巴氏杆菌等,支原体性有滑液囊支原体。各种关节性疾病通过肉眼难以分辨,为明确病因必需进行实验室诊断确诊[5]。试验从贵州某肉鸡养殖场3~4周龄发病雏鸡中分离出致病株,分离菌对红霉素、头孢曲松、环丙沙星、丁胺卡那、氯霉素、庆大霉素和多黏霉素高度敏感;对先锋霉素V、新霉素和克林霉素中度敏感;对青霉素、四环素、万古霉素、诺氟霉素和卡那霉素不敏感,表明该菌已对多种抗生素产生了耐药性,在临床用药时应该注意联合用药和穿梭用药。
分离株16S rRNA 基因核苷酸序列与GenBank中其他沙门氏菌的16S rRNA基因序列同源性达94.6%以上,其中,与CQ0709(GenBank:FJ465088.1)、NBRC 3163(GenBank:AB680018.1)和Sal1203(GenBank:JX888138.1)的同源性为100%;分离菌株与肠炎型沙门氏菌CQ0709(GenBank:FJ465088.1)处于同一小分支上,进化关系最近。综上所述,贵州某肉鸡养殖场3~4周龄雏鸡由肠炎型沙门氏菌感染导致发病。肠炎型沙门氏菌引起雏鸡常见的症状有精神沉郁、食欲不振、腿软、下痢,病程稍长者可引起严重脱水;剖解常见心冠脂肪出血、心包积液,有些肝脏有灰白坏死点,肠道肿大充血、出血[10];对于肠炎型沙门氏菌引起关节炎型的病例较为少见,故此在临床诊断时应把肠炎型沙门氏菌纳入考虑范围,再结合实验室诊断做出准确的判断,继而在短时间内做出预防与治疗方案,减少养殖场的经济损失。试验结果对该养殖场鸡沙门氏菌的临床防控与治疗具有指导作用。
